馬鈴薯塊莖形成的生理生化基礎和分子機制
雷春霞 李燦輝 陳永坤,3 龔明
(1.云南師范大學生命科學學院 生物能源持續開發利用教育部工程研究中心 云南省生物質能與環境生物技術重點實驗室,昆明 650500;2.云南師范大學馬鈴薯科學研究院 云南省馬鈴薯生物學重點實驗室,昆明 650500;3.新疆師范大學生命科學學院,烏魯木齊 830054)
馬鈴薯(Solanum tuberosum L.)是繼小麥、水稻之后,全球第三大糧食作物,糧菜兼用,營養豐富,根據單位種植面積產生的供人體消耗的卡路里,它是世界上最高效的糧食作物[1-3]。馬鈴薯在中國的種植面積和總產量均位居世界第一,但單位面積產量僅為發達國家的1/3左右[2]。為保障國家糧食安全、促進農民持續增收,2015年初,我國啟動馬鈴薯主糧化戰略[4]。馬鈴薯塊莖形成過程是馬鈴薯植株最重要的生長發育和產量決定事件之一,對其進行深入研究有利于改進和提高馬鈴薯塊莖的產量和質量。
馬鈴薯起源于氣候相對涼爽的南美安第斯山脈,塊莖是由地下匍匐莖膨大形成的淀粉儲存器官,其形成受內部因素與環境條件互做的調控。在馬鈴薯生長的各發育階段,結薯期是受外界環境影響最敏感的階段,不同地區的氣候差異限制其種植區域和實際產量[5]。本文概述了馬鈴薯塊莖形成的生理生化基礎,討論了塊莖誘導形成過程中信號轉導途徑及相關基因、蛋白、miRNAs、激素和第二信使分子等對塊莖形成的調節,構建了塊莖誘導形成過程中可能的分子互作網絡,展望了未來研究的方向和可能的突破點。隨著各類生物技術的成熟與應用,通過分子遺傳改良提高馬鈴薯產量成為一種發展趨勢[5-7];而闡明塊莖形成的分子機制,可為將來通過精準分子育種提高馬鈴薯產量和改良品質提供理論基礎。
1 馬鈴薯塊莖形成的生理生化基礎
馬鈴薯植株生長發育到一定時期形成匍匐莖,在特定的誘導條件下,匍匐莖進一步膨大形成塊莖,該過程涉及一系列的生理生化變化,如內源激素成分、含量及其比值發生明顯的變化,植株葉片光合速率提高、同化物外運速度加快、匍匐莖頂端的蔗糖和淀粉含量增加以及特異蛋白的出現等[8]。早先的C/N 假說認為,馬鈴薯植株中C∶N比率的變化與塊莖形成密切相關,在短日照(SDs)條件下,碳水化合物在匍匐莖亞頂端積累引起C∶N 比率增加,從而誘導塊莖形成[9]。Zheng等[10]的研究也表明,隨著CO2濃度的增加,馬鈴薯植株C∶N比率增大,塊莖形成時間提早,施氮量的減少也會導致C∶N比率的升高和塊莖形成時間的提前[10]。
1.1 馬鈴薯塊莖形成的過程
馬鈴薯塊莖的形成是一個復雜的發育過程,包括幾個連續的階段:匍匐莖的發生和伸長、隨后頂端彎曲成鉤狀,亞頂端區域膨大形成塊莖(圖1)。在匍匐莖生長過程中,細胞分裂主要局限于頂芽和接近頂端垂直于匍匐莖生長軸方向的區域。塊莖形成啟動后,匍匐莖停止生長,匍匐莖亞頂端區域髓區、環髓區和皮層細胞的數量增多與體積增大引起塊莖膨大,這一過程中伴隨著淀粉合成和一組特定的貯藏蛋白質的積累[1,11-12]。匍匐莖的伸長和塊莖的膨大是連續的、密切相關的兩個獨立的發育階段,受外界環境和內源激素的共同調控[1,5,13]。然而,并非所有的匍匐莖都能產生塊莖。受遺傳基因、外界環境及栽培條件的影響,一般來說,匍匐莖的成薯率為50%-70%[14]。在某些情況如在離體培養或在黑暗中,塊莖也可以從地上莖的芽或先前發育的塊莖中產生。因此,匍匐莖的形成和生長并不一定是塊莖形成的必經階段。
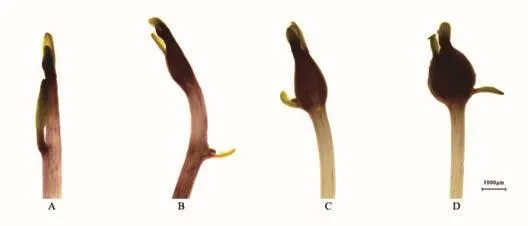
圖1 離體培養條件下馬鈴薯塊莖形成過程圖示Fig.1 Illustration of S.tuberosum tuberization in vitro
1.2 影響馬鈴薯塊莖形成的內部因素
1.2.1 基因型和生理年齡 馬鈴薯塊莖形成主要由其遺傳特性調控,同樣的外部環境,不同品種的馬鈴薯結薯能力不同[15]。另外,馬鈴薯植株發育階段也是決定塊莖形成的重要因素,植株必須達到一定的生理年齡才能對誘導塊莖形成的環境因素作出響應。塊莖形成過程需要生化代謝途徑和形態發生過程的精確同步,其受特定基因表達的調控,同時負責誘導塊莖形成的信號分子(如各種信號蛋白、mRNAs、miRNAs、植物激素和糖)的產生伴隨著塊莖的誘導與形成[16]。
1.2.2 植物激素 馬鈴薯塊莖形成受到多種植物激素的共同調控,各種激素對塊莖形成的功能不一。大量研究表明赤霉素(gibberellins,GAs)是植物激素中調控馬鈴薯塊莖形成的主要負調控因子[17]。抑制結薯發生的主要生物活性GAs是GA1和GA3,它們在匍匐莖生長過程中含量高,在塊莖形成前迅速下降[16,18]。GAs在塊莖形成中作用的另一個證據是,施用GAs生物合成抑制劑(如氯膽堿、多效唑或嘧啶醇)可以促進塊莖的形成[16]。
與GAs不同,細胞分裂素(CKs)能促進馬鈴薯的塊莖形成[19]。離體培養條件下,CKs可通過促進細胞分裂來促進塊莖形成[20-21]。此外,在塊莖形成之前,匍匐莖中的生長素(IAA)水平升高,在隨后的塊莖生長期間仍保持較高水平,表明生長素在塊莖形成中的促進作用[22]。而脫落酸(ABA)可能是通過降低GA的活性來促進塊莖形成[23]。在塊莖形成起始階段,ABA/GA比值迅速上升,塊莖膨大期間,ABA含量上升,GA含量下降;但二者的絕對濃度變化并不是影響塊莖形成的關鍵因素,重要的是GA/ABA比值起決定作用[24]。因此,ABA與GA相互作用來參與塊莖形成調控。
乙烯也參與了匍匐莖生長的調節。乙烯及其前體乙烯利對匍匐莖伸長具有抑制作用,而對頂端膨大具有促進作用[25]。此外,施用茉莉酸(JA)可增加分生組織的厚度,匍匐莖彎曲部位和初膨大匍匐莖的細胞面積分別增大達4倍和6倍,使亞頂端區域分生組織膨大形成塊莖[26]。JA還對塊莖干物質和淀粉的積累有促進作用,而CKs在塊莖形成中對JA 具有拮抗作用[27]。
總體而言,植物激素是馬鈴薯塊莖形成的關鍵因子,不同激素對塊莖形成的影響存在互作效應,對這種互作效應的分子解析將有助于更好地理解植物激素對塊莖形成調控的分子機制。
1.2.3 淀粉和蛋白質 馬鈴薯塊莖的誘導與形成涉及一系列生理生化變化,如植株光合速率增加,同化產物的運輸加快,干物質快速積累,形成塊莖的匍匐莖頂端蔗糖、淀粉及塊莖特異蛋白含量增加。
塊莖形成伴隨著匍匐莖頂端淀粉合成的急劇增加和ADP-葡萄糖焦磷酸化酶(AGPase)含量和活性的同時升高;AGPase是淀粉合成的關鍵酶,因此,淀粉曾一度被認為是塊莖誘導形成所必需的[28]。在反義AGPase基因植株中,淀粉合成受阻,合成量僅為正常植株的2%,但塊莖形成數量并未降低,甚至還高于正常植株。因此,淀粉合成對塊莖誘導形成沒有直接影響,但淀粉的積累會最終影響塊莖產量[29-31]。Andersson等[32]的研究表明,通過 RNAi下調馬鈴薯質體水溶性無機焦磷酸酶(psPPase)基因,塊莖總淀粉和直鏈淀粉含量顯著降低,淀粉顆粒減小,糖中間體的數量發生了變化,ADP-葡萄糖含量顯著增加。單個下調StpsPPase基因或ATP/ADP轉運體基因StNTT均可提高單株塊莖數量和鮮重;相反,當這兩個基因同時被抑制時,一些株系只發育出少數形狀扭曲的小塊莖,表明PPase水解PPi對馬鈴薯塊莖中功能淀粉的積累至關重要[32]。這暗示著未來可望通過改變淀粉合成相關基因的表達或敲除來提高塊莖產量。
塊莖形成的過程還伴隨著一些貯藏蛋白的動態變化。塊莖貯藏蛋白Patatin僅在馬鈴薯塊莖形成過程中才在匍匐莖頂端特異性的出現和累積,其含量占塊莖總可溶性蛋白含量的 40% 左右,被認為是塊莖形成的生化標志;蛋白酶抑制劑Ⅱ(protease inhibitor Ⅱ,Pin Ⅱ)是在塊莖發生后才開始出現和逐漸積累的。Patatin和 Pin Ⅱ只存在于塊莖中,其含量大約占塊莖總可溶性蛋白含量的 60%以上[33],其作用尚待進一步深入研究。
1.3 影響馬鈴薯塊莖形成的外界因素
各種環境因子中,溫度和光照是影響馬鈴薯塊莖形成最重要的因素,水分和礦質營養對塊莖形成也有一定影響。
1.3.1 溫度 塊莖的誘導和形成、數量、大小和產量都受到溫度的影響[34]。塊莖發生的最低溫度是4-5℃,但生長遲緩;最適溫度為15.6-18.3℃;高于2l℃,塊莖的生長速度減慢[35]。在塊莖形成期間,夜間溫度的影響尤為關鍵,當夜晚的溫度增加至25-27℃時,塊莖的數量和重量均大幅度減少。因此,低溫可以使馬鈴薯結薯提早,高溫則會延遲甚至是完全抑制塊莖形成[36-37]。
1.3.2 光照 光周期在誘導馬鈴薯塊莖形成的啟動過程中起著重要的作用。SDs有利于結薯,長日照(LDs)抑制或延遲塊莖形成[38]。不同基因型對光周期反應不一,如野生種S.tuberosum ssp.andigena的塊莖形成受光周期嚴格控制,而有些廣泛種植的栽培品種盡管對光周期不敏感,但減少日照時間和降低溫度仍然可以促進其塊莖形成[39]。
光照強度也影響塊莖形成。低光照強度通過降低光合速率,導致蔗糖合成水平和濃度降低,進而延遲結薯。此外,低光強對塊莖形成的影響類似于高溫,較高光照水平可以緩解高溫對塊莖形成的抑制作用。低光照強度能增加馬鈴薯葉片中的GAs水平,因此推測溫度和光照強度都可通過調控GAs代謝來介導塊莖形成[37]。
1.3.3 水分與礦質營養 馬鈴薯植株的蒸騰系數在400-600之間,屬于需水較多作物,充足的水分供給對于塊莖的形成至關重要。塊莖誘導形成階段需水量約占整個生育期的23%-28%以上,塊莖逐漸膨大的過程占45%-50%以上,水分供應不足會延遲甚至抑制塊莖形成,水分供應過多則會導致塊莖品質下降[40]。
土壤營養狀況也會影響馬鈴薯的塊莖形成。氮素營養對塊莖形成有顯著影響,氮素形態、濃度及其施用時間與塊莖形成時間和最終產量密切相關[9,41]。合理的氮、磷、鉀肥施用和最佳配比配施有機肥能夠提高馬鈴薯的產量和營養品質,適當的施用鈣肥可以增加塊莖數量和提高產量[42-44]。
2 馬鈴薯塊莖誘導形成過程中的信號轉導途徑
馬鈴薯塊莖形成過程中受到多種內部因素和外界環境的誘導,引發多條信號轉導途徑,這些途徑又有上下游關系和相互作用。
2.1 光周期信號途徑
光周期在馬鈴薯塊莖誘導形成中起重要作用。馬鈴薯植株通過葉片感知光周期,葉片中的光受體(photoreceptor)感知光信號后,將光信號傳遞給晝夜節律鐘(circadian clock)和節律調節基因(circadian regulated genes),并由它們將信號向下游傳遞[45]。
2.1.1 光周期信號的感知 馬鈴薯中與光周期誘導塊莖形成有關的重要光受體是光敏色素A(StPHYA)、光敏色素B(StPHYB)和光敏色素F(StPHYF)[45-46]。StPHYA能夠在遠紅外光條件下感知光信號,參與馬鈴薯生物節律的重建并調控塊莖形成。StPHYB能夠在綠色葉片中穩定積累,作為長距離運輸的信號分子,在紅光條件下參與光周期變化的感知,StPHYF與StPHYB以異源二聚體的形式介導馬鈴薯塊莖形成的潛在光周期調控模式,LDs條件下抑制塊莖形成[45-46]。馬鈴薯中的另一個藍光受體蛋白FLAVINBINDING KELCH REPEAT F-BOX PROTEIN 1(FKF1)與晝夜節律鐘的重要核心調控蛋白GIGANTEA(GI)形成復合物(StFKF1/StGI),感知藍光來測量日長[47]。
2.1.2 光周期信號的傳遞及對塊莖形成的調控
2.1.2.1 CONSTANS(CO)與 CYCLING DOF FACTOR 1(CDF1) 轉錄因子CONSTANS(CO)是調控開花和塊莖形成的重要基因,晝夜節律鐘對該基因的表達具有嚴格的調控作用[45]。在馬鈴薯中CO有兩種形式(StCO1 和 StCO2),StCO1/2又稱 StCOL1/2,對塊莖形成起負調控作用[48],在馬鈴薯中過表達StCO延遲塊莖形成,StCO對塊莖形成的負調控作用可以通過嫁接傳遞[49]。DOF(DNA-binding with one finger)基因家族是植物專有的一類轉錄因子,參與調控植物生長發育過程中多種基因的表達。CYCLING DOF FACTOR 1(CDF1)蛋白屬于DOF轉錄因子家族,馬鈴薯中的CDF1(StCDF1)是生物鐘組件StGI1和StFKF1的下游作用因子,與 StGI1和StFKF1相互作用,StFKF1/StGI復合物調節StCDF1的穩定性,而StCDF1的穩定性控制StCOL1/2基因的表達,因此,StCDF1是晝夜節律鐘調控StCO環節中的重要分子[45,47,50]。
2.1.2.2 FLOWERING LOCUST(FT,成花素)同源基因 產生于葉片并可以在植物韌皮部運輸的FT蛋白被認為是誘導開花的信號分子,成花素基因FT是CO調控開花的直接下游基因,CO蛋白是調控FT基因的轉錄因子[49]。煙草和馬鈴薯的嫁接實驗表明,開花和塊莖形成是通過相同的移動信號來介導的,成花素是開花的移動信號,也可以誘導塊莖形成,被稱為成薯素[38]。在馬鈴薯中有4種FT同源基因:StSP6A、StSP5G、StTFL1和StSP3D。其中,StSP6A的激活與塊莖誘導形成密切相關[45,48-49]。
StSP6A蛋白是產生于葉片的移動信號,可以移動到地下匍匐莖的莖尖誘導塊莖形成。過表達StSP6A株系可使塊莖形成提前,并且在非誘導(LDs)條件下形成塊莖[48]。沉默StSP6A,在SDs條件下延遲結薯,但最終產量與野生型相比相差無幾[48]。StSP6A參與塊莖形成起始的激活,但是可能不參與后期的塊莖形成[48]。在早熟品種中,StSP6A基因的表達量較高,而晚熟品種StSP6A基因的表達量相對較低。使用誘導型啟動子誘導StSP6A可引起幾個塊莖標記基因(包括StGA2OX1)的激活。在一個光周期響應品種中,SDs誘導葉片和匍匐莖中StSP6A的mRNA 積累,StSP6A大量表達促進結薯[48-49]。但這種轉錄調控的機制目前還不明確。
LDs條件下,StPHYB感知光信號,再由光受體E3泛素化連接酶FKF1與核蛋白GI形成復合體,該復合體能夠分解調節StCOL1/2基因的轉錄因子StCDF1,使StCOL1/2基因大量表達,抑制StSP6A基因的表達,抑制結薯[50-52]。StCOL1/2對塊莖誘導的影響可以通過嫁接傳遞表明StCOL1/2參與遠程調控信號分子的基因表達,這與StCDF1抑制StCOL1/2轉錄和增強StSP6A活性相一致。StCOL1/2對StSP6A的抑制作用也受StSP5G的控制,LDs能夠促進StPHYF與StPHYB結合形成異源二聚體,穩定StCOL1并激活StSP5G基因的表達,進而抑制StSP6A的表達,使馬鈴薯在LDs下結薯受阻[39,46]。此外,在誘導塊莖形成前,FT同源基因StTFL1 mRNA在匍匐莖中的豐度較高,在塊莖發育的早期下降,過表達StTFL1可引起塊莖產生數量的增加[53],表明StTFL1在塊莖誘導和發育中的促進作用。已發現StSP3D可控制開花途徑[48],但對馬鈴薯塊莖形成的影響至今尚未見報道。
2.1.2.3 StBEL5與 POTH1 StBEL5(Solanum tuberosum BEL5) 和 POTH1(potato homeobox1) 是 馬鈴薯中兩個相互作用的三氨基酸環擴展(TALE)蛋白[54]。
StBEL5 mRNA產生于葉片,通過韌皮部被運輸到地下匍匐莖的莖尖誘導塊莖形成[55]。StBEL5基因在葉片中的表達受低水平藍光和紅光的刺激,而不受日照長度的影響。在幾個獨立的株系中過表達StBEL5引起結薯提早、結薯率增加,而RNA干擾抑制StBEL5則顯著降低塊莖產量[56]。StBEL5蛋白激活多種塊莖形成基因,如StSP6A和StCDF1基因[39,56]。在誘導條件下,產生于葉片的StSP6A 和StBEL5通過mRNA作為移動信號被運輸到匍匐莖莖尖誘導塊莖形成,StCOL1/2通過抑制葉片中StSP6A和 StBEL5 mRNAs的積累抑制塊莖形成[57]。
馬鈴薯中的POTH1 基因受光誘導表達,編碼POTH1的 mRNA被運輸到匍匐莖頂端參與塊莖形成[45]。Chen等[54]的研究發現 POTH1和 StBEL5協同互作抑制馬鈴薯赤霉素氧化酶基因StGA20ox1的表達,StGA20ox1能夠將具有生物活性的GA1、GA4轉變為無活性的GA8和GA34,從而調節塊莖形成期間的GA合成。StBEL5-POTH1復合體還可以增加細胞分裂素水平。這表明StBEL5和伙伴蛋白POTH1相互作用,通過調節匍匐莖頂端激素水平介導塊莖形成[45,54]。
2.1.2.4 參與塊莖誘導調控的microRNAs 現已發現馬鈴薯中的兩種microRNAs(miR172和miR156)可作為移動的信號分子來調控塊莖形成[58,59]。
StPHYB和StBEL5參與了馬鈴薯塊莖誘導對光周期的響應,然而它們是否在相同的結薯途徑中起作用尚不清楚。Martin等[58]的研究表明,miR172在SDs下的表達量更高,在塊莖形成的起始階段,匍匐莖中miR172的表達量上調。在馬鈴薯中過表達miR172,在適宜的光周期誘導條件下可促進開花、加速塊莖形成,LDs條件下也能誘導塊莖形成。在LDs條件下結薯的植株中StPHYB的豐度降低,StBEL5 mRNA和miR172水平在葉片中降低,在匍匐莖中增加。再加上維管束中miR172的存在以及嫁接傳遞對塊莖形成的影響,表明miR172可能是可移動的,或者是通過調節遠距離信號誘導結薯。與此一致的是,過表達miR172的植株中StBEL5 mRNA水平升高,而StBEL5可以作為移動信號參與塊莖形成[57]。這些結果表明,miR172可能作用于結薯抑制因子StPHYB的下游和結薯促進因子StBEL5的上游,由StPHYB、miR172和StBEL5協同控制結薯的過程[58]。
LDs條件下,miR156在馬鈴薯葉片和莖中顯示較高的豐度,而在SDs條件下,匍匐莖中的miR156豐度增加,這表明miR156受光周期調控。過表達miR156的馬鈴薯植株塊莖產量下降,miR172和SPLs水平都下降,研究表明miR156是通過StSPL9轉錄因子調節miR172,進而對塊莖的形成起負調控作用[59]。
綜上所述,光周期對馬鈴薯塊莖發生的調控與其遺傳機制密切相關,是一個復雜的綜合調控網絡。馬鈴薯葉片中的光受體StPHYA、StPHYB等首先感知光信號,并將光信號傳遞給晝夜節律鐘的重要核心調控蛋白復合物StFKF1/StGI,StGI可以調控轉錄因子StCDF1的含量,最終負調控StCO的表達。同時,StPHYA、StPHYB和StPHYF等還可以直接對StCO的表達量進行調控[45-48]。StCO可以調控StSP6A、StBEL5的表達。而StSP5G對StSP6A起負調控作用,從而抑制塊莖形成[39,49]。StBEL5-POTH1 復合體通過調節匍匐莖頂端激素水平介導塊莖形成[54]。miR172也受StGI的調控,并影響StBEL5的表達[58]。miR156是通過StSPL9轉錄因子調節miR172,進而影響塊莖形成[59]。
雖然光周期調控馬鈴薯塊莖形成的分子機理研究已經取得了許多重要進展,但其中一些信號轉導通路是通過相關實驗推測而來的,未來仍需要大量研究來證實。
2.2 溫度信號途徑
溫度是另一個重要的控制塊莖形成的外部信號。已知較高環境溫度不利于塊莖形成。Menzel[60]的研究表明,高溫對塊莖形成的抑制作用是通過增加GA水平介導的,用GA生物合成抑制劑氯乙基三甲基氯化銨(矮壯素)處理植株或莖段,可克服由高溫引起的對塊莖形成的抑制作用。然而,GA信號轉導通路中溫度響應組件的分子機制尚未建立。
高溫可通過減少同化物進入塊莖的量和增加植株其它部分的量來影響同化物的分配。高的土壤溫度并不影響誘導信號的產生,但會阻止匍匐莖形成塊莖[61]。在高的土壤溫度下匍匐莖會向上生長,一旦它們到達土壤表面遇到冷空氣,則形成塊莖。炎熱的天氣會使塊莖上長出匍匐莖,這一過程稱為熱發芽。如果在熱發芽后溫度變冷,在匍匐莖尖將會開始形成一個新的塊莖,通過高/低溫的重復循環可以形成一個“鏈塊莖”[37]。
作為馬鈴薯塊莖形成的重要調控分子,StSP6A的積累除了依賴于日照長度外,還受溫度控制。高溫導致StSP6A的表達下調,這與塊莖產量下降有很高的相關性。但其分子機制目前并不清楚[48,62-63]。
外界環境對馬鈴薯塊莖形成的誘導可能是光周期和溫度共同作用的結果。盡管有充分證據表明環境溫度影響馬鈴薯塊莖形成,但其分子機制目前知之甚少。這一部分尚需借鑒光周期信號途徑的研究成果,闡明環境溫度如何觸發信號轉導途徑來調控馬鈴薯塊莖的誘導與形成。
2.3 植物激素信號途徑
塊莖形成是環境信號和內源激素互作的結果。大量研究表明,多種植物激素對塊莖形成的各個階段都有顯著影響,同一種植物激素對塊莖形成的不同階段影響不同[64]。
GA參與多種外界因素(光周期、溫度、氮素等)對塊莖形成的影響。大量研究表明GA不僅抑制塊莖發生的誘導,還抑制塊莖形成的啟動[65]。GA可刺激匍匐莖的萌發、生長和分枝。高的GA水平有利于匍匐莖的萌發,但不利于塊莖發生。因為塊莖發生與匍匐莖生長停止及其頂端細胞分裂有關,伴隨著GA含量減少,匍匐莖伸長停止。因此,所有誘導塊莖發生的條件,如SDs、較低生長溫度和有限的氮供應,都能顯著降低匍匐莖中GA的含量[65]。
馬鈴薯結薯非誘導狀態與高的內源GA水平相關。LDs條件下,馬鈴薯葉片中GA活性和含量比SDs誘導條件下高出數倍。SDs條件下,用GA處理的植株結薯延遲。LDs條件下,用抑制劑阻斷GA合成可以促進塊莖的形成[65]。在馬鈴薯塊莖發育的早期階段,可見的膨大之前,GA 2-氧化酶基因(StGA2ox1)的表達上調,它主要在匍匐莖的亞頂端區域和生長的塊莖中表達,因此,StGA2ox1的作用是在塊莖萌發早期,在塊莖形成的起始階段改變匍匐莖亞頂端區域的GA水平,促進塊莖發育和生長[14,52]。
轉基因植株在SDs條件下赤霉素氧化酶20基因(StGA20ox1)的表達水平與塊莖形成時間呈負相關。該基因轉錄的增強延緩了塊莖的形成,而表達的抑制則加速了塊莖的形成。然而,由于抑制StGA20ox1基因轉錄而導致的GA水平下降并不能抵消LDs對塊莖形成的抑制作用,即在LDs下不能形成塊莖[66],故LDs抑制結薯可能不完全依賴GA信號,還有其他機制。
其中一個機制是StPHYB參與抑制LDs下的光周期誘導結薯[64]。無論在SDs還是LDs條件下,StPHYB合成受阻的轉基因植株都能快速、密集地產生塊莖。與一般認為的GA抑制結薯的觀點相反,與野生型植株相比,這些轉基因植株葉片和地上嫩枝中GA1的含量增加了3-5倍;GA20和GA8水平升高,但GA29水平降低。這表明在LDs條件下參與抑制結薯的StPHYB影響了活性GA組分的含量、比例和代謝[67]。
在馬鈴薯中過表達StBEL5,使StGA20ox1表達量降低,StGA2ox1表達量升高,GA活性下降,誘導塊莖形成[52]。提高培養液中的氮含量,匍匐莖中GA活性增加,抑制塊莖形成。蔗糖濃度可以改變匍匐莖頂端的GA1水平從而影響塊莖形成[52]。此外,GAs對馬鈴薯塊莖形成的影響不僅是通過GAs的合成/失活,它們在植株或特定器官中的運輸也可能是重要的因素,然而,GA分配的機制尚不明確。近年來,優先負責糖轉運的SWEET促進因子被認為參與了 GA 轉運[16,68]。
脫落酸(ABA)也是控制匍匐莖生長的一個激素,通常對馬鈴薯塊莖形成的誘導有積極的影響[65]。用ABA處理馬鈴薯葉片可促進塊莖的形成,然而,塊莖的形成過程本身與ABA在葉片中的積累并沒有明顯的直接關系,它的刺激作用是通過拮抗GA信號來實現的[65]。
茉莉酸(JA)及其衍生物茉莉酸甲酯(MeJA)即塊莖酸(tuberonic acid,TA)和塊莖酸葡糖苷(glucoside of tuberonic acid,TAG)是體外培養馬鈴薯外植體中促進塊莖形成和生長的化合物[65]。早期的研究認為,這些化合物是塊莖誘導形成的遠距離刺激物。然而,目前還沒有闡明葉片中這些化合物具體參與塊莖形成誘導相關過程。JA、TA和TAG在馬鈴薯植株中通過脂氧合酶(LOX)合成;LOX催化多不飽和脂肪酸(FA)的氧化,主要形成亞油酸和亞麻酸,并形成相應的氫過氧化物[69]。
綜上所述,塊莖形成是環境信號和內源激素互作的結果,環境信號通過調控內源激素的合成/分解代謝途徑、基因表達、內源水平與活性、各種激素比例等來調節塊莖形成。但環境信號如何調控這些過程尚待進一步闡明。
2.4 參與塊莖誘導形成的第二信使分子
馬鈴薯塊莖形成受到各種外界和內源信號的激活或抑制,而這些信號常常通過一些第二信使分子參與信號轉導途徑來調控馬鈴薯塊莖的形成。
2.4.1 蔗糖信號分子 蔗糖是植物主要的光合產物之一,不僅為細胞提供必要的能源物質,還作為信號分子調控植物的生長發育、細胞周期、基因表達等[70-71]。蔗糖信號系統對馬鈴薯塊莖的發生、發育具有調控作用[52]。蔗糖水平可能是塊莖形成的主要調控因子,離體塊莖形成高度依賴蔗糖濃度[72]。蔗糖誘導馬鈴薯塊莖形成過程伴隨著塊莖形成相關基因表達的提高,如patatin基因、Pin Ⅱ基因和鈣依賴蛋白激酶 I(CDPK1)基因等[52,70]。
植物體源器官(葉片)中合成的蔗糖除少部分用于滿足葉片自身的代謝活動外,大部分被運輸到庫器官,對產量和品質有重要影響。馬鈴薯塊莖是營養物質的儲藏器官,塊莖形成與蔗糖的合成、運輸、代謝密切相關。蔗糖轉運蛋白(sucrose transporters,SUTs)對于蔗糖在不同器官中的運輸和分配具有重要作用。目前已知的SUTs分為SUT1、SUT2和SUT4共 3個亞群[52]。StSUT1負責蔗糖的運輸,SUT2是質膜上的蔗糖信號感受器,SUT4能促進GA的生物合成,GA也可以通過反饋調節使SUT4的表達增加[52,73]。StSUT4能促進StCO 蛋白對 StFT基因表達的抑制作用,從而抑制結薯[74]。
在塊莖形成啟動初期,蔗糖的卸載模式發生了從質外體到共質體的轉變,這種轉變可能是通過StSP6A和蔗糖流出運輸器StSWEET11之間的相互作用來調節的。StSP6A與StSWEET11的結合阻止了蔗糖外流到質外體,因此可能促進共質體的蔗糖轉運。StSWEET11和StSP6A蛋白之間的直接互作表明調控馬鈴薯塊莖形成的糖信號和光周期通路之間存在交互作用(crosstalk)。StSP6A作為源-庫分配的重要調節者,為修改源-庫相互作用提供了可能[75]。
“(現有)電力市場是上世紀中葉設計的,而當時的體系如今已不再存在。我們看到,在許多地區多次出現一種情況,即電廠利潤接近零,或者在一天的某個時段實際為負值,一些相對較舊的水電設施正在虧損。”
近年來有關糖在塊莖誘導中作用的研究主要集中在其對植物激素水平的影響及其相互作用上[76]。相對于8%蔗糖,生長于含有1%蔗糖培養基中的馬鈴薯匍匐莖頂端含有較高水平的GA1,蔗糖被認為可以調節匍匐莖尖內源GA的含量,進而調控塊莖形成[52]。高濃度GA處理可完全防止馬鈴薯結薯;但在培養基中添加高濃度蔗糖時,盡管植株內源GA含量高,但也會形成大量的塊莖。因此,GAs和蔗糖調節塊莖形成可能是兩條平行途徑[16]。
2.4.2 Ca2+信號 Ca2+是植物細胞信號轉導中最重要的第二信使之一,并作為信號分子參與馬鈴薯塊莖形成的誘導。在馬鈴薯中,蛋白質脫磷酸化是一些塊莖形成相關基因轉錄激活所必需的[14]。植物中的鈣依賴蛋白激酶(CDPK)是一類Ca2+信號受體蛋白。StCDPK1是馬鈴薯塊莖誘導形成和發育期間蔗糖信號通路的一個關鍵因子,高濃度蔗糖和促進塊莖形成的ABA和6-芐基腺嘌呤(BA)正向調控StCDPK1的表達,在馬鈴薯塊莖形成的起始階段,StCDPK1在匍匐莖膨大的部位大量表達,該部位同時也有蔗糖的大量積累,表明蔗糖可能通過對StCDPK1 特異性誘導表達促進結薯[52,70]。
細胞內鈣離子濃度通過CDPK調節活性氧(ROS)爆發,參與NADPH氧化酶的激活過程[77]。在馬鈴薯塊莖形成期間由Ca2+和 StCDPK1介導的活性氧爆發的作用值得被研究。盡管Ca2+和各種Ca2+調控蛋白在馬鈴薯塊莖形成中發揮了積極作用,但Ca2+和Ca2+誘導的信號通路調控塊莖形成的分子機制尚有許多待解之謎。
植物細胞產生的各種ROS在信號轉導途徑中發揮重要作用。H2O2激活Ca2+內流,胞內Ca2+濃度增加,進而引發植物對各種環境因子和內部信號的響應。最新的研究發現了植物細胞質膜表面存在過氧化氫受體HPCA1(hydrogen-peroxide-induced Ca2+increases 1),H2O2能夠激活HPCA1的細胞內激酶活性,觸發了Ca2+通道引起Ca2+內流,從而將環境信號傳遞到細胞內進而調節基因表達[78]。目前尚無關于ROS與馬鈴薯塊莖形成相關的直接證據。另外,作為植物體內重要信號分子的NO和H2S,有沒有可能參與馬鈴薯的塊莖形成?至今尚未見報道。
馬鈴薯的塊莖形成受到外部環境(光周期、溫度、氮供應等)和內源激素及糖水平的共同調控。塊莖形成對日長、溫度、激素、碳水化合物和氮營養條件的響應是相互關聯的,并具有適應性,它們構成了馬鈴薯發育的季節性策略。塊莖形成的誘導是自身結薯能力和對有利環境信號感知相結合的結果。在適宜的環境條件下,各種各樣的信號被激活并誘導塊莖形成,這些信號或者在葉片中起作用,或者是在葉片中產生并向下移動到匍匐莖頂端誘導塊莖形成。這些信號轉導途徑已日趨明晰,呈現出了一個復雜的塊莖形成的調控網絡。
3 馬鈴薯塊莖形成的分子機制
馬鈴薯塊莖形成是一個復雜的綜合控制過程,外界環境和內源激素通過啟動多條信號轉導途徑調節相關基因的表達,從而調控塊莖形成。在適宜的環境條件下,馬鈴薯的塊莖形成受到調節蛋白的激活,在這些調節蛋白中,有些是在葉片中起作用,另一些是產生于葉片并被運輸到匍匐莖頂端誘導塊莖形成。有3個最重要的調控塊莖形成起始的調節蛋白是StCDF1、StSP6A和 StBEL5。StCDF1和StBEL5是轉錄因子,StSP6A是輔助調節因子家族的一個成員。這3種調節蛋白分別與其它相關蛋白形成復合物,通過相互作用調控塊莖形成[47,49,57]。
3.1 StGI-StKFK1-StCDF1復合物
日長感知是通過FKF1/GI復合物來完成的,是開花和塊莖形成共享的一個調節機制。SDs條件下,StGI-StKFK1-StCDF1復合物中的StCDF1可以結合StCO1/2啟動子的特定區域抑制StCO1/2轉錄和激活StSP6A 基因的表達,誘導結薯[45,47,50,57]。
3.2 StBEL5/POTH1復合物
在塊莖形成起始階段,StBEL5和POTH1在葉片中相互作用,通過誘導StCDF1和 StSP6A的轉錄,而后信號放大發生在匍匐莖里,StBEL5在剛剛開始形成塊莖的匍匐莖頂端通過自動調節增強自身的轉錄,在匍匐莖里StBEL5再次和POTH1相互作用誘導 StSP6A 和 StBEL5 的轉錄[47]。
StBEL5/POTH1復合物識別一個特定的順式元件,該順式元件是存在于StBEL5靶基因的一個TTGAC基序[1]。StBEL5過表達和抑制株系的發育研究表明,StBEL5與StSP6A基因的活性呈高度正相關[56]。分析表明StSP6A上游序列顯示有5個TGAC串聯基序[1]。作為StBEL5/POTH1的靶標基因,StCDF1的上游序列含有6個TTGAC串聯的元件[56],StBEL5可以激活塊莖形成相關基因StCDF1[47]。StBEL5/POTH1復合物能夠抑制StGA20OX1的轉錄并提高StGA2OX1的活性[1]。研究發現,StGA20OX1啟動子區域含有兩個TGAC串聯基序,StBEL5/POTH1可以與該序列結合并抑制StGA20OX1的活性。StGA2OX1啟動子上也有10個TTGAC串聯基序,過表達StBEL5植株中StGA2OX1的表達量增加,GA活性降低,促進塊莖形成[79]。
總之,StBEL5和POTH1互作來調節上游的StSP6A 和StCDF1表達,進而調控下游多個塊莖形成相關基因來誘導塊莖形成。
3.3 成薯素復合物(tuberigen activation complex,TAC)
在匍匐莖頂端部位起作用的TAC由StSP6A、14-3-3調節蛋白和類FD(ferredoxin-like,FDL)蛋白組成。酵母雙雜交分析表明,StSP6A蛋白與馬鈴薯的14-3-3蛋白和FDL蛋白相互作用。過表達StSP6A植株以一個14-3-3蛋白依賴的方式誘導早期結薯,抑制StFDL1則延遲塊莖形成。這些結果表明該復合物的組件是塊莖形成的局部觸發器。然而,過表達StFD1對塊莖形成沒有影響[80]。塊莖形成通常是通過在離散時間點產生塊莖植株的百分比來判斷的,不考慮整體的塊莖產量,這表明該復合物的組件調控塊莖形成的起始,但不一定影響整體塊莖產量[80]。
在過去的20年,馬鈴薯塊莖形成及其調控的分子機制方面的研究已取得了重要進展。蛋白質依賴的正向信號傳導機制主要涉及StSP6A、StBEL5和POTH1轉錄因子及其許多靶基因。值得一提的是,StSP6A的靶基因還包括GA2-氧化酶GA2ox和蔗糖轉運體SUT1。然而,碳水化合物平衡與其他信號通路之間的相互作用尚未得到充分的研究。基于已經獲得的結果,包括自發形成塊莖(spontaneously tuberizing,ST)植株中StSP6A豐度升高的結果,可以推測糖依賴和赤霉素依賴通路之間的信號交談至少部分是由StSP6A介導的。然而,這個假設仍需實驗來驗證[16]。
根據上述的研究結果,本文構建了塊莖誘導形成過程中可能的分子互作網絡圖示(圖2)。
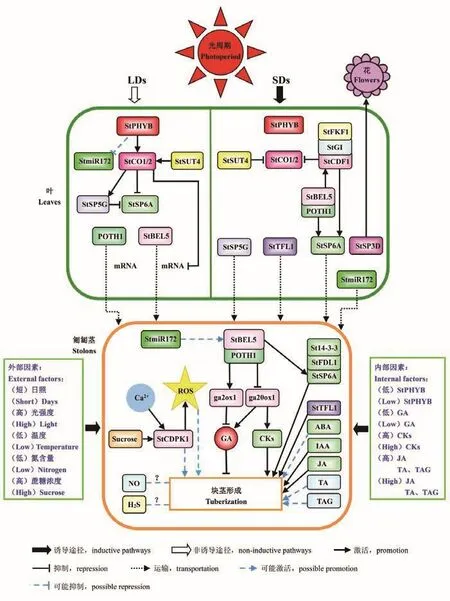
圖2 馬鈴薯塊莖誘導形成的可能分子互作網絡圖示Fig.2 Schematic diagram showing the possible molecular interaction network during tuber induction and formation in potato
4 展望
馬鈴薯塊莖的誘導形成和生長是一個受各種外界環境信號和內源植物激素及信號分子調控的復雜過程。盡管歷經數十年的研究,但塊莖誘導和形成的信號轉導途徑和分子機制仍有許多待解之謎。面對全球氣候變化和將馬鈴薯主糧化以滿足日益增長人口的糧食和營養需求的期望,徹底闡明馬鈴薯塊莖形成機制變得尤為重要和迫切。
近年來,各國研究人員一直在努力破解馬鈴薯塊莖發生的分子機制,以識別和開發塊莖發生的關鍵觸發點和分子開關。這可能使馬鈴薯可以在一個更廣泛的地域范圍內結薯和種植,該范圍包括大多數限制性的和關鍵的環境因素(如溫度和光周期)。為了更好地了解馬鈴薯塊莖形成的分子機制,科學家們對各種基因和蛋白質進行了鑒定。此外,一些參與從地上組織傳遞感知信號到匍匐莖的信號分子已經被識別出來并正在進行進一步的分析。雖然馬鈴薯基因組測序的完成[81]將有助于更好解析馬鈴薯塊莖形成的分子途徑,但進一步的功能基因組和蛋白組學研究將需要精確地描述與結薯過程相關的各個因子的相互作用。例如有一些證據表明StBEL5和 StSP6A可能協同工作。StSP6A 和 StBEL5在形成塊莖的匍匐莖中共表達,激活一些相同的下游靶基因;兩者都誘導StGA2OX1,但StSP6A作為一個輔助調節因子起作用,不能獨立介導這種誘導。值得注意的是,StGA2OX1的上游序列包含6個串聯的TTGAC元件,表明StBEL/POTH1或者StBEL/StSP6A復合物在該調節中起作用。凝膠位移實驗證實StBEL5/POTH1特異性結合在StGA2OX1上游序列的這些串聯基序上[1]。進一步闡明它們之間的互作及其在塊莖形成中的作用無疑會有助于我們更好理解塊莖形成的分子機制。
近年來興起及廣泛應用的各種生物技術和基因組學研究工具如基因編輯等[6,82]可用來確定塊莖形成的關鍵分子靶點(基因和蛋白質),這些靶點可用于基因工程介導的馬鈴薯塊莖形成過程的調控。如可 以 選 擇 StSP6A、StPOTH1、StBEL5、miR172和StCDF等作為過表達的候選基因來正向調控塊莖形成過程,而選擇StPHYB、StCO、StSUT4和StSP5G等基因通過抑制靶點負向調控塊莖形成,從而通過基因工程來提高馬鈴薯的產量。
調控塊莖形成的多個信號轉導途徑之間存在相互作用,如高濃度蔗糖對StCDPK1的誘導表達表明Ca2+信號與蔗糖信號之間存在交互作用。且同一結薯基因可被不同的信號轉導途徑誘導表達,如高濃度蔗糖和SDs都可以特異性的誘導patatin class I 基因的大量表達。此外,盡管已知各種激素參與調控塊莖形成,但關于激素的研究結果多是孤立的,沒有確定任何一種激素作為塊莖誘導形成唯一的發育開關。同樣,也沒有確切證據表明其它代謝產物(如蔗糖、氧化脂類、塊莖貯藏蛋白或塊莖酸等)能單獨啟動塊莖形成。未來的挑戰在于闡明參與塊莖形成的多個信號分子和信號轉導通路之間的相互作用及其這種互作對塊莖形成的調控。
綜上所述,馬鈴薯塊莖形成是一個多種外界環境因素與內源植物激素和信號分子互作來激活或抑制多個特定基因表達、調控多條生化途徑及同化物分配、最終使匍匐莖特定區域膨大的過程。基于現有和將來進一步細化的馬鈴薯基因組信息,通過多組學聯合分析手段,可望全面解析控制馬鈴薯塊莖形成的多重關鍵基因、代謝途徑以及信號分子和轉導途徑之間如何互作來調控這些基因和途徑,以最終闡明塊莖形成的分子機制。這將有助于通 過精準分子育種手段來培育高產優質的馬鈴薯品種提供借鑒和新思路。

