鹽脅迫對大豆種子萌發(fā)過程中子葉超微結構的影響
廖珍鳳, 王劍, 宋西嬌, 陳光, 沈夢夢, 苗瑞祥, 徐盛春
(浙江省農業(yè)科學院 公共實驗室,浙江 杭州 310021)
大豆含有豐富的蛋白質和油脂,是重要的糧食、經(jīng)濟作物[1-2],也是異黃酮、維生素、纖維和礦物質的重要來源[3]。目前,全球對大豆的需求正在持續(xù)增加,但是大豆品質和產量受溫度、水分、鹽堿化等非生物脅迫的影響日益顯著[4]。鹽脅迫是長期制約作物生長的主要逆境之一。全球超過6 000萬 hm2的耕地遭受不同程度鹽堿化的威脅,約占世界灌溉土地總面積的20%[3]。鹽脅迫易引起作物組織滲透失衡、過度離子毒害,抑制細胞分裂和增殖,甚至導致植物死亡[3,5]。
目前,國內外對鹽脅迫下大豆生長形態(tài)、生理生化、產量和品質等各方面進行了大量研究。大豆、苦豆萌芽期經(jīng)鹽脅迫處理后,胚根的抗氧化酶含量和活性均發(fā)生變化。幼苗期出現(xiàn)發(fā)黃和萎蔫、根系生長狀況差等現(xiàn)象,當鹽處理濃度達到0.9%時,幼苗甚至出現(xiàn)干枯死亡的情況[6]。此外,在不同類型鹽堿脅迫下,大豆單株莢數(shù)、單株粒數(shù)、百粒重等多個性狀均呈下降趨勢,直接造成大豆產量的減少[7]。種子萌發(fā)是植物成苗的關鍵時期,亦是植物生命周期中對鹽脅迫最敏感的時期。研究[8-10]表明,鹽脅迫處理顯著降低水稻、油菜、玉米等種子發(fā)芽率和活力。種子萌發(fā)所需蛋白質、脂質等能量物質主要集中在子葉細胞中的蛋白質貯藏液泡、油體中[11-12],但相關研究較少。細胞內研究主要集中在葉綠體、線粒體等細胞器受鹽脅迫的影響,且多集中在幼苗或成熟植株時期。高濃度鹽脅迫下,野大麥、玉米的葉肉細胞超微結構發(fā)生嚴重病理變化,葉綠體的基粒類囊體片層結構消失,線粒體腫脹,細胞器膜都受到不同程度的破壞[13-14]。
目前,鹽脅迫對大豆種子萌發(fā)期影響的研究多集中在生理生化水平,而對大豆萌發(fā)過程中鹽脅迫影響子葉細胞超微結構的研究甚少。鑒于此,本研究利用電鏡技術,結合有關生理指標的測定,研究鹽溶液脅迫下,大豆萌發(fā)過程中子葉細胞的超微結構和形態(tài)的動態(tài)變化,簡析蛋白質貯藏液泡、油體、質體及其他細胞器的降解轉化過程。
1 材料與方法
1.1 材料
供試大豆品種為浙農6號,由浙江省農業(yè)科學院蔬菜研究所提供。
1.2 方法
1.2.1 大豆萌發(fā)期鹽脅迫試驗
挑選籽粒飽滿、種皮無破損、無病斑的大豆種子(浙農6號),用無菌水沖洗數(shù)次后用于萌發(fā)試驗。用不同濃度鹽溶液潤濕的雙層長方形濾紙(20 cm×30 cm)墊底,將種子置于濾紙距離上下邊緣3 cm處,每排為9粒種子,按間隔1.5 cm依次平鋪在濾紙上,放置兩排,再將一層潤濕濾紙覆蓋于鋪好的種子上,從左至右將夾有種子的3層濾紙卷起,放入帶蓋水桶中(20 cm×20 cm),桶內加少量不同濃度鹽溶液保持濕潤,設3組重復。將準備萌發(fā)的大豆種子置于培養(yǎng)箱中,培養(yǎng)條件:25 ℃/25 ℃(晝/夜),相對濕度70%,分為對照組(蒸餾水),50、100和150 mmol·L-1NaCl進行萌發(fā)實驗,每24 h更換1次相應濃度的鹽溶液。
1.2.2 大豆萌發(fā)相關性狀指標測定
大豆種子分別用NaCl處理,設50、100和150 mmol·L-13個濃度梯度,以蒸餾水為對照,設3組重復,每組重復18粒大豆種子。試驗期間每天記錄發(fā)芽數(shù),以萌發(fā)大豆胚根長1 cm為萌發(fā)臨界點統(tǒng)計發(fā)芽率。統(tǒng)計一直持續(xù)8 d,并每天測定下胚軸與根的長度。統(tǒng)計大豆種子在不同濃度NaCl溶液處理后的發(fā)芽率、發(fā)芽勢、下胚軸與根的長度以及側根數(shù)量。計算發(fā)芽率、發(fā)芽勢。
1.2.3 透射電子顯微鏡樣品制備
在大豆萌發(fā)0 h、12 h、2 d、5 d、8 d時,對處理組和對照組進行透射電鏡樣品取樣。以大豆胚軸為中心點,取去掉種皮的子葉中間部位切下1 mm×1 mm×2 mm小條,每個處理組取相同部位,重復取樣3次。樣品放入3.5%戊二醛溶液中固定,并且真空抽沉,將固定的樣品用1%鋨酸二次固定,乙醇梯度脫水,spurr樹脂滲透、包埋。制好的包埋塊用Leica UC6型超薄切片機進行超薄切片,醋酸雙氧鈾和檸檬酸鉛雙重染色,Hitachi H7650型透射電子顯微鏡觀察、拍照。
1.2.4 掃描電子顯微鏡樣品觀察
在大豆種子萌發(fā)5 d、8 d時進行掃描電鏡樣品取樣。以種臍為中心點,用雙面刀片將子葉切成2 mm的薄片,每個處理組取相同部位,重復取樣3次。樣品放入3.5%戊二醛溶液中固定,并且真空抽沉,將固定的樣品用1%鋨酸二次固定,乙醇梯度脫水,乙酸異戊酯過渡,經(jīng)Quorum K850臨界點干燥儀干燥,離子濺射儀噴金,用日立Hitachi Regulus 8100掃描電鏡觀察,拍照。
2 結果與分析
2.1 鹽脅迫對大豆萌發(fā)的影響
用50、100和150 mmol·L-1NaCl 3個鹽濃度處理萌發(fā)大豆后,發(fā)現(xiàn)隨著鹽濃度的增加,大豆種子發(fā)芽率、發(fā)芽勢、根長、側根數(shù)量等均呈下降趨勢(圖1、圖2、表1)。對照組的發(fā)芽率在4 d后與最終發(fā)芽率一致,鹽處理組的種子萌發(fā)持續(xù)時間隨鹽濃度升高而延長,并且隨鹽濃度的升高,大豆的發(fā)芽率、發(fā)芽勢均降低(圖1、圖2)。50 mmol·L-1和100 mmol·L-1NaCl溶液處理時,發(fā)芽率、發(fā)芽勢與對照相比差異不顯著,說明低鹽溶液對大豆種子萌發(fā)抑制作用較低。150 mmol·L-1NaCl脅迫下,大豆種子發(fā)芽率、發(fā)芽勢顯著低于對照組,說明高濃度的鹽脅迫顯著抑制種子萌發(fā)(圖1、圖2)。與發(fā)芽率相比,胚根、下胚軸及側根的生長對鹽脅迫更加敏感,生長受抑制較為嚴重。50、100和150 mmol·L-1NaCl溶液處理時,胚根、下胚軸長度以及側根數(shù)均顯著小于對照組。當鹽濃度達到150 mmol·L-1時,胚根基本無側根生長(表1)。

相同萌發(fā)時間不同處理間無相同小寫字母者表示組間差異達顯著水平(P<0.05)。圖2同。圖1 不同濃度NaCl處理對種子發(fā)芽率的影響

圖2 不同濃度NaCl處理對種子發(fā)芽勢的影響

表1 NaCl脅迫對大豆胚根和下胚軸生長的影響
2.2 透射電鏡觀察鹽處理對萌發(fā)子葉細胞超微結構的影響
為觀察不同鹽濃度處理下,大豆種子萌發(fā)過程中子葉細胞超微結構的變化,本試驗對不同萌發(fā)時間的大豆子葉進行透射電鏡觀察。結果顯示,未萌發(fā)的大豆種子子葉細胞中分布著大量大小、形狀不一的蛋白質貯藏液泡和油體。細胞內僅含1~2個質體,極少細胞器存在(圖3)。

PSV,蛋白質貯藏液泡;OB,油體;SG,淀粉粒;P,質體;CW,細胞壁;圖a-1為圖a的局部放大圖,字母-1為相應字母的局部放大圖,圖4~6同。圖3 未萌發(fā)大豆子葉細胞超微結構的透射電鏡照片
種子萌發(fā)12 h時,對照組質體內淀粉顆粒增多,周圍已形成少量的粗面內質網(wǎng)(圖4中a、a1),而鹽溶液處理組尚未觀察到內質網(wǎng)或其他細胞器(圖4中b~d1)。鹽溶液處理組子葉細胞基質電子密度加深,油體數(shù)量較對照組增多,并且與蛋白質貯藏液泡膜接觸的油體直徑小于遠離液泡膜的油體(圖4中b1、c1、d1)。種子萌發(fā)2 d時,對照組大豆子葉細胞內,蛋白質貯藏液泡聚集融合成大的電子密度較淺的貯藏液泡,質體數(shù)量增加,尚未形成片層結構(圖4中e、e1)。鹽溶液處理組,子葉細胞內蛋白質貯藏液泡體積均小于對照組,而油體數(shù)量較萌發(fā)12 h時減少,并被擠到細胞壁邊緣(圖4中f~h1)。50 mmol·L-1NaCl溶液處理時,油體數(shù)量與對照組相差不大,當鹽濃度達到100和150 mmol·L-1時,大量油體密集分布在胞質中,細胞質基質電子密度也明顯加深(圖4中g1、h1)。150 mmol·L-1NaCl溶液處理下,發(fā)現(xiàn)細胞質壁出現(xiàn)輕微分離(圖4中h1),基質中分布大量小的空泡化結構,蛋白質貯藏液泡和質體的膜結構也遭到破壞(圖4中h1)。
種子萌發(fā)5 d時,對照組子葉細胞內的蛋白質貯藏液泡融合形成大液泡,極少量的油體顆粒分布在細胞壁周圍。質體數(shù)量增多,基質中出現(xiàn)稀疏的片層結構,線粒體結構還比較簡單,沒有形成嵴膜(圖5中a、a1)。鹽溶液處理組,子葉細胞內蛋白質貯藏液泡聚集在一起,形成大小、形狀不規(guī)則的大液泡,而油體的數(shù)量,隨鹽濃度的升高而增加。這表明種子萌發(fā)過程中,蛋白質和脂質降解轉化速度受到鹽脅迫的影響而延緩。細胞內質體的數(shù)量隨著鹽濃度增加而減少,基質均為無定形基質,無片層結構,淀粉粒幾乎充滿整個質體(圖5中b~d1)。種子萌發(fā)8 d時,對照組子葉細胞內的蛋白質貯藏液泡與油體都已消耗殆盡,形成中央大液泡。質體內形成基粒類囊體片層結構,發(fā)育轉化為葉綠體,基質內的淀粉粒并未增加反而減少。線粒體和內質網(wǎng)大量分布在胞質中,線粒體的基質區(qū)逐漸變小,嵴膜逐漸密集(圖5中e、e1)。50 mmol·L-1NaCl溶液處理組,質體內基粒片層結構稀疏,少量線粒體、內質網(wǎng)分布在胞質中(圖5中f、f1)。隨著NaCl濃度的升高,100 mmol·L-1NaCl溶液處理時,胞質中分布著大量未完全降解轉化的油體顆粒,液泡內含大量絮狀蛋白質。2個處理組均未形成完整的葉綠體,且鹽濃度越高,質體轉化成葉綠體的程度越低,線粒體內也只有連成片的網(wǎng)狀膜和較大的基質區(qū)。當NaCl溶液濃度達到150 mmol·L-1時,胞質中含大量形狀不規(guī)則的油體顆粒,質體膜結構受損,基質內出現(xiàn)空泡化結構,未觀察到線粒體及內質網(wǎng)(圖5中g~h1)。
2.3 掃描電鏡觀察鹽處理對萌發(fā)子葉細胞超微結構的影響
種子萌發(fā)5 d時,對照組子葉細胞內含大量質體內的淀粉顆粒,未觀察到蛋白質貯藏液泡與油體(圖6中a、a1)。而鹽溶液處理組,子葉細胞內分布著大量蛋白質貯藏液泡,表明蛋白質和脂質降解轉化速度延緩(圖6中b~d1)。萌發(fā)8 d時,鹽處理組細胞內的淀粉顆粒隨NaCl濃度增加而減少(圖6中e~h1),這與透射電鏡觀察結果一致。

圖a~d1,大豆萌發(fā)12 h;a、b、c、d分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。圖e~h1,大豆萌發(fā)2 d;e、f、g、h分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。白色箭頭指示質體,黃色箭頭指示質壁分離處。PSV,蛋白質貯藏液泡;OB,油體;SG,淀粉粒;P,質體,CW,細胞壁;M,線粒體;ER,內質網(wǎng)。圖4 萌發(fā)12 h和2 d時大豆子葉細胞超微結構的透射電鏡照片
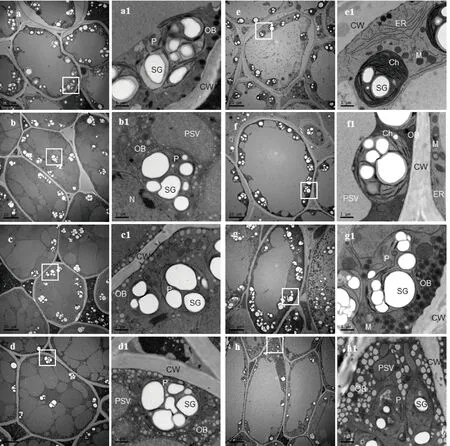
圖a~d1,大豆萌發(fā)5 d;a、b、c、d分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。圖e~h1,大豆萌發(fā)8 d;e、f、g、h分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。PSV,蛋白質貯存液泡;OB,油體;SG,淀粉粒;P,質體;CW,細胞壁;Ch,葉綠體;M,線粒體;ER,內質網(wǎng);N,細胞核。圖5 萌發(fā)5 d和8 d時大豆子葉細胞超微結構的透射電鏡照片
3 討論
隨著全球土壤鹽堿化面積的逐年增加,鹽脅迫已經(jīng)成為限制作物產量的主要非生物脅迫之一[15]。作物在種子萌發(fā)期和幼苗期對鹽分最敏感,鹽脅迫引起的滲透脅迫和過度離子毒害,造成作物發(fā)育遲緩,抑制組織的分化和生長[5]。種子萌發(fā)期間,子葉內各種酶被激活,促進貯藏物質降解成小分子,保證自身的呼吸作用,并轉運到胚根或胚芽等生長點,促進下胚軸和胚根的生長發(fā)育[16-17]。本研究結果表明,NaCl處理組的種子萌發(fā)持續(xù)時間隨NaCl濃度升高而延長,發(fā)芽率、發(fā)芽勢隨鹽濃度升高而降低。NaCl濃度為50、100 mmol·L-1時,大豆種子的發(fā)芽率、發(fā)芽勢與對照組差異不顯著,直至NaCl濃度達到150 mmol·L-1時,大豆種子的發(fā)芽率、發(fā)芽勢均顯著低于對照組。說明低鹽濃度對大豆種子萌發(fā)沒有明顯的抑制作用,高鹽濃度的脅迫強烈抑制種子活力,降低種子的萌發(fā)率,這與前人的研究結果一致[18-19]。種子萌發(fā)受抑制程度隨鹽濃度增加而加劇,這種現(xiàn)象應該是鈉離子和氯離子對萌發(fā)種子的毒性作用可以隨鹽處理濃度的升高得到積累[20],另一方面,高鹽離子產生的滲透壓也可以阻止水分的吸收,從而影響種子的萌發(fā)[21]。根系是植物吸收土壤中營養(yǎng)物質的主要器官,鹽脅迫下水稻、油菜種子萌發(fā)主根長和側根數(shù)等生長性狀均受到顯著抑制[22-23]。這與本試驗中,鹽溶液處理組的胚根、下胚軸長度以及側根數(shù)量均顯著小于對照組的結果一致。
子葉是種子重要的貯存器官,細胞中的蛋白質和脂質分別貯存于蛋白質貯藏液泡和油體內。豆類的蛋白質貯藏液泡是由磷脂雙分子層包裹的囊泡,囊泡內主要含大豆球蛋白[11],而油體是由單層磷脂分子和鑲嵌于其中的油體膜蛋白組成,核心是三酰甘油[24]。大豆萌發(fā)時,大豆蛋白酶C1誘導子葉貯藏蛋白液泡內的蛋白水解產生游離氨基酸,為生長提供重要的氮源、碳源和硫源[25],油體則在脂肪氧化酶、脂肪分解酶等作用下,被分解為甘油、脂肪酸并生成碳水化合物,參與到體內物質轉化和能量代謝過程中[26-27]。目前,鹽脅迫對大豆種子萌發(fā)時期子葉營養(yǎng)成分變化的研究多集中在生理生化水平,而對大豆種子萌發(fā)過程中鹽脅迫影響子葉細胞超微結構的研究甚少。多數(shù)研究表明,大豆種子發(fā)芽過程中,蛋白質、脂質含量會明顯減少,游離氨基酸含量顯著增加[28-29]。本研究通過透射電鏡和掃描電鏡觀察可知,正常萌發(fā)大豆,隨著發(fā)芽天數(shù)延長,蛋白質貯藏液泡逐漸聚合增大,變成電子密度較淺的大液泡,油體的數(shù)目也隨發(fā)芽天數(shù)的延長逐漸減少。說明貯藏蛋白質被酶解成小分子肽運送出細胞,三酰甘油也逐漸被消耗提供能量,支持胚根、胚芽的生長,這與王慧等[11,28-29]的研究結果一致。通過比較對照組和鹽處理組,發(fā)現(xiàn)種子萌發(fā)5 d時,對照組子葉細胞內的蛋白質貯藏液泡融合形成大液泡,僅剩極少量的油體顆粒分布在細胞壁周圍。鹽溶液處理組,子葉細胞內還存有大量未降解轉化的蛋白質貯藏液泡和油體。萌發(fā)8 d時,對照組子葉細胞內蛋白質貯藏液泡與油體都已消耗殆盡,而鹽處理組液泡內含大量絮狀蛋白質,油體顆粒也未完全降解。這說明鹽溶液處理下,大豆種子蛋白質貯藏液泡和油體水解轉化速度要比對照組緩慢,并且隨著鹽濃度的增加,延緩效應越明顯。這種現(xiàn)象可能是鹽離子對細胞代謝產生毒性,破壞了蛋白酶、肽酶、脂肪氧化酶等相關水解酶的活性和功能,抑制了子葉細胞內蛋白質貯藏液泡和油體降解成小分子參與到合成其他物質的過程,導致根長、下胚軸長以及側根數(shù)量等生長性狀受到不同程度的影響,最終抑制大豆的發(fā)芽率。鹽脅迫可以通過破壞絲氨酸蛋白酶活性延緩腰果萌發(fā)時子葉中蛋白質的水解和轉運,限制游離氨基酸的釋放,破壞其與組織生長過程中物質供給之間的平衡關系,抑制種子的萌發(fā)[30-31]。在玉米和向日葵種子萌發(fā)過程中,鹽脅迫還會延緩子葉內油脂的分解,從而降低種子的發(fā)芽率[32-33]。已有的研究表明,乙醛酸途徑在大多數(shù)油料作物種子萌發(fā)過程中,將儲存的脂質轉化為可溶性糖時起著至關重要的作用。然而,鹽脅迫會抑制乙醛酸循環(huán)中一些重要酶的活性,如過氧化氫酶、蘋果酸合酶和異檸檬酸裂解酶[34]。大豆萌發(fā)12 h和2 d時,透射電鏡觀察還發(fā)現(xiàn)鹽處理組子葉細胞質基質電子密度明顯加深。鹽濃度達到150 mmol·L-1時,萌發(fā)2 d的子葉細胞出現(xiàn)輕微的質壁分離,基質中分布大量小的空泡化結構,蛋白質貯藏液泡的膜結構也遭到破壞。這可能是高濃度鈉離子一方面引起細胞滲透失衡,產生滲透壓阻止水分的吸收,另一方面破壞生物膜表面膜蛋白導致膜系統(tǒng)紊亂等。本研究中150 mmol·L-1鹽溶液處理組,最終無法形成葉綠體、線粒體、內質網(wǎng)等細胞器,這應該是高鹽脅迫下一系列生理反應的累積,包括酶活性受到抑制、膜系統(tǒng)紊亂、活性氧產生等[5,35]。

圖a~d1,大豆萌發(fā)5 d;a、b、c、d分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。圖e~h1,大豆萌發(fā)8 d;e、f、g、h分別為對照組(蒸餾水)、50、100和150 mmol·L-1 NaCl處理組。PSV,蛋白質貯存液泡;SG,淀粉粒;CW,細胞壁。圖6 萌發(fā)5 d和8 d時大豆子葉細胞超微結構的掃描電鏡照片
綜上所述,NaCl處理對大豆的發(fā)芽率、發(fā)芽勢、根長、下胚軸長以及側根數(shù)量等性狀的抑制作用隨著濃度的增加而升高。不同鹽濃度處理下,蛋白質貯藏液泡和油體降解轉化速度都明顯延緩,葉綠體、液泡、內質網(wǎng)、線粒體等細胞器形成速度也隨鹽濃度增加而變慢。但本試驗僅是模擬鹽脅迫條件,探討了一種鹽分對大豆種子萌發(fā)的影響。實際鹽土都是復合鹽堿成分,試驗光照、氣溫等與田間環(huán)境也存在差異。因此,實際生產中的鹽堿脅迫對大豆萌發(fā)的影響機制還有待進一步研究探討。

