骨橋蛋白基因沉默對子宮內膜異位癥患者在位內膜細胞侵襲性的影響
白治苗,劉玉鋒,郭玉琳,趙 樂
(1.榆林市第二醫院婦科,陜西 榆林 719053;2.榆林市第二醫院神經外科,陜西 榆林 719053)
子宮內膜異位癥(Endometriosis,EMS)是具有生物活性的子宮內膜出現在宮腔以外任何部位,好發于育齡期女性,以25~45歲為甚,生育少且晚的婦女發病概率明顯低于生育多者。研究[1-4]發現EMS是引發20%~90%患者出現慢性盆腔疼痛、痛經,25%~35%患者不孕以及5%~15%婦科手術的根本原因。每個人對EMS的易患性受遺傳、體內性激素及環境因素的共同影響。當前EMS的明確病因及機制尚無定論,但被統一接受的是1921年Sampon提出的經血逆流學說[5-6],但是該學說的具體分子機制及細胞因子通路仍不明確。因EMS患者子宮內膜組織可侵襲、轉移到人體內任何器官,影響相應器官功能,出現相應癥狀,對女性健康危害較大[7-9]。EMS在病理診斷上是良性的,但病理和發病機制卻類似于惡性腫瘤,如黏附、侵襲及遠處轉移等生物學能力。當前對EMS的診治手段有限。研究[10-11]發現,核因子(Nuclear factor,NF)-κB、骨橋蛋白(Osteopontin,OPN)、基質金屬蛋白酶(Matrix metalloproteinase,MMP)-9在EMS患者中高表達,且呈正相關。針對大鼠EMS模型的實現[12]亦證實上述因子高表達,且與子宮內膜異位黏附、侵襲性明顯相關。有研究[13]在對大鼠EMS模型行OPN基因敲除后發現病灶較前明顯縮小,但是對于OPN如何發揮作用并未給出明確的結果。研究[14]發現OPN與其受體結合后激發NF-κB及其相關通路因子,致使該因子從NF-κB-IkBs復合物中分離,從胞質進入胞核后具有活性,與其他因子發生結合后可參與相關基因的有關細胞凋亡及轉錄調控。所以,OPN可能是導致EMS發生,子宮內膜遠處黏附、侵襲的關鍵因子。鑒于此,本研究通過沉默OPN基因觀察EMS患者在位內膜細胞侵襲性的變化。
1 材料與方法
1.1 實驗材料 本實驗所獲取的子宮內膜組織來源于從2019年1月至2020年1月因“單側或雙側卵巢巧克力囊腫”于我院行腹腔鏡下卵巢囊腫剝除術的患者20例。在手術中刮取子宮內膜組織,且根據末次月經計算均處于月經分泌期(前期實驗發現分泌期OPN的表達高于增殖期)。
1.2 主要試劑 OPN多克隆抗體(批號:716-456-142,稀釋濃度1∶100,美國Abcam公司);DAB顯色試劑盒(批號:180704,北京中杉生物工程公司);PV-6001試劑盒(北京中杉生物工程公司);TRIzol、反轉錄試劑盒、熒光定量試劑(上海生工生物工程有限公司);RIPA裂解液(上海碧云天生物技術有限公司);特異小RNA(siRNA)片段(上海吉瑪生物制藥有限公司);細胞培養小室(密理博中國有限公司);RT-PCR反轉錄試劑盒(美國Invitrogen公司)。
1.3 實驗方法
1.3.1 原代細胞培養及鑒定:將手術中刮取的內膜組織于低溫條件下帶入細胞間,用PBS溶液沖洗數次后放置于培養皿中,剪刀剪碎至1 mm×1 mm×1 mm大小的組織塊,倒入10 ml離心管中,加入5 ml 0.03% Ⅳ膠原酶,在37 ℃條件下反復消化3次,每次8 min。于離心器中以500 r/min離心30 s。反復離心后結合顯微鏡下觀察,獲得子宮內膜腺上皮細胞,添加細胞培養液,打勻后分至80~100 mm培養皿中,放入培養箱中培養。每日更換細胞培養液,直至達到90%融合。免疫細胞化學鑒定:待細胞融合至90%,用0.25%胰酶將其消化,用一次性吸管將細胞懸液滴至預先放有蓋玻片的6孔板中,將6孔板放置于5% CO2細胞培養箱進行細胞爬片。于第 7 天用無水乙醇固定細胞約 10 min。滴加一抗(鼠抗人細胞角蛋白多克隆抗體和鼠抗人波形蛋白抗體稀釋濃度均為1∶100)4 ℃孵育過夜。滴加二抗(PV6000),DAB 顯色。細胞質被染成棕黃色視為陽性。
1.3.2 OPN siRNA干預:當細胞融合度為90%時行siRNA干預。用500 μl無血清培養基稀釋10 μl Trans Lipid HL(北京全式金公司),500 μl無血清培養基稀釋10 μl OPN siRNA,靜置5 min后將稀釋好的OPN siRNA與Trans Lipid HL輕柔混合,室溫靜置20 min后將混合物加入含5 ml無血清培養液的60 mm培養皿中作為干預組,將不加混合物的培養皿(加入等量培養液)作為未干預組。放入培養箱中培養4~6 h后更換培養液,繼續培養24 h。 OPN siRNA序列:正義鏈為5’-GGUCAAAAUCUAAGAAGUUTT-3’,反義鏈為5’-AACUUCUUAGAUUUUGACCTC-3’。 未干預組無意義鏈siRNA序列:正義鏈為5’-UUCUCCGAACGUGUCACGUTT-3’,反義鏈為5’-ACGUG-
ACACGUUCGGAGAATT-3’。
1.3.3 RT-PCR檢測mRNA表達:提取原代細胞中RNA并設計引物。OPN正向引物序列為5’-ACAGCCGTGGGAAGGACAGTTA-3’,反向引物序列為5’- CCTGACTATCAATCACATCGGAATG-3’。β-actin正向引物序列為5’-AGCGAGCATCCCCCAAAGTT-3’。按照北京中杉公司cDNA合成試劑盒進行反轉錄獲得cDNA,取4~5 μl反應產物行瓊脂糖凝膠電泳。OPN的相對表達量采用2-△△CT計算。
1.3.4 Western blot檢測蛋白表達:提取細胞中蛋白,采用凱基蛋白提取試劑盒檢測蛋白表達(根據說明書,OPN按1∶100稀釋)。制備SDS分離膠、濃縮膠,插入相應的梳子,加入干預前后蛋白樣品及標準蛋白標志物,電泳分離蛋白質后,轉印蛋白于硝酸纖維素膜。載有蛋白的硝酸纖維素膜經5% 脫脂牛奶封閉后,加入OPN及β-actin等一抗4 ℃過夜,經TBST換洗5 min×5次后,加相應二抗孵育2 h,進行增強型ECL顯影,于Bio-Rad成像儀中曝光成像并測定各蛋白條帶光密度值,計算相應的光密度比值。
1.3.5 穿膜實驗:制備細胞懸液,當培養于60 mm培養皿中腺上皮細胞及OPN siRNA干預24 h后的原代細胞融合大約80%~90%時,采用胰酶消化,用細胞培養液將其制成原代細胞懸液,計數后將細胞懸液加入小室(ECM550,購置于Chemicon公司)中,把侵襲小室的膜置于載玻片上,蓋上蓋玻片,行蘇木素染色后于顯微鏡下行細胞計數和拍照,每張分別選取16個固定位置的視野,計數細胞數量并比較OPN siRNA干預前后腺上皮細胞穿膜數目的變化。
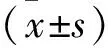
2 結 果
2.1 EMS患者腺上皮細胞鑒定 見圖1。培養原代EMS患者子宮內膜腺上皮細胞,鏡下觀察發現最初幾天腺上皮細胞成團生長,呈鋪路石樣,后向周圍擴散,直至融合。通過腺上皮細胞和間葉細胞獨有的標志物廣譜角蛋白、波形蛋白,結果發現絕大多數細胞pan-CK染色陽性,而VIMITEN染色陰性,說明培養出來的團塊狀細胞為子宮內膜腺上皮細胞。
A:pan-CK染色陽性,細胞質內出現棕黃色顆粒(免疫組化染色,×400);B:VIMITEN染色陰性,細胞質及核內均未見明顯的棕黃色顆粒(免疫組化染色,×400);C:原代細胞培養第2天,細胞成團生長(免疫組化染色,×100)
2.2 兩組細胞OPN蛋白和mRNA表達比較 見表1。與未干預組比較,干預組腺上皮細胞OPN蛋白和mRNA表達明顯下降(均P<0.05)。
2.3 兩組細胞侵襲性比較 見圖2。與未干預組比較,干預組穿膜細胞數明顯降低(P<0.05)。
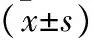
表1 兩組細胞OPN蛋白和mRNA表達比較
A、B:干預組(A)和未干預組(B)穿膜實驗結果(蘇木素染色,×200);C:與未干預組比較,*P<0.05
3 討 論
EMS雖然是常見良性疾病,但有類似惡性腫瘤的黏附、轉移特點,是導致女性經期疼痛、慢性盆腔痛、繼發性不孕等癥狀的重要原因[15-16]。目前EMS治療手段局限,術中全部病灶清除困難,術后仍有慢性盆腔痛,需要藥物鞏固治療。
OPN是1979年Senger等于骨基質中發現的,研究[17]發現其與正常細胞的惡性變密切相關,其本質是帶負電荷的鈣結合的分泌型磷酸化糖蛋白,組織結構中富含精氨酸-谷氨酸-天冬氨酸序列。OPN在人體胚胎、妊娠子宮蛻膜、腎和許多惡性腫瘤細胞等中有較高的表達[18]。腫瘤機制學研究中發現OPN與惡性腫瘤的形成緊密相關。分子學研究[19]發現OPN通過與自身受體avβ3結合后激活依賴MAPK/PI3K通路的NF-κB通路,激發細胞中尿激酶型纖溶酶原激活物(uPA)和MMPs等相關因子的分泌,引導細胞侵襲過程、細胞胞質中MMPs降解和重塑、細胞遷移及宿主免疫細胞逃逸和新生血管形成,發揮抑制細胞凋亡、促進腫瘤血管生成及腫瘤細胞轉移等作用,從而誘導腫瘤的發生。
目前已經有學者通過實驗證實OPN在乳腺癌、胃癌以及婦科宮頸癌等惡性腫瘤中呈高表達,由此引發猜想,該因子是否與惡性腫瘤細胞于正常組織處黏附、侵襲及遠處轉移的生物學特性有關。許多研究發現OPN在EMS患者內膜組織整個月經周期中波動性表達,并且其表達明顯高于正常內膜組織,于月經周期分泌期的表達明顯高于增殖期,充分說明OPN是與孕卵著床密切相關的一種窗口期黏附因子,并受孕激素的調控,與該EMS的臨床藥物治療機制相吻合。本實驗組前期實驗[20]已經證實以上說法。有研究通過誘導形成大鼠異位病灶,敲除OPN基因后發現大鼠EMS病灶明顯縮小,顯示OPN與EMS病灶大小、數目及體積密切相關。
本研究通過原代細胞培養,分離并培養出純度較高的子宮內膜腺上皮細胞,排除了間質細胞的擾亂。經過其獨有的角化蛋白、間質細胞波形蛋白證實其為子宮內膜腺上皮細胞。與未干預組比較,干預組腺上皮細胞OPN蛋白及mRNA表達均明顯下降,穿膜細胞數目明顯減少。由此我們得出,OPN可能是引起EMS的關鍵因子。結合既往研究分析, OPN與其受體結合后可能促進相關因子的釋放,進而介導了一系列的細胞反應,導致EMS的發生。
綜上所述,OPN基因沉默后子宮內膜腺上皮細胞OPN蛋白及mRNA表達下降,穿膜數量減少,侵襲性降低。本研究為臨床醫生從機制學出發對EMS進行有效靶向藥物干預、指導臨床用藥和術后隨訪提供了可靠的依據,擬于后期研究中進行質粒導入聯合藥物干預增強OPN的表達,再次檢測細胞黏附能力及侵襲性的變化,以進一步證實我們的推測。本研究存在的不足之處為樣本量較少,原代細胞培養繁瑣,后期會加大樣本量,嘗試細胞傳代,以增加數據的可靠性。

