培養學生高階思維的“影響鹽類水解的因素”教學設計
曾賽欽 張賢金
摘要:陌生情境下復雜問題的解決需要學生具有高級思維能力。鹽類水解是學科核心概念,本文以“影響鹽類水解的因素”教學為例,設計真實情境,開展概括關聯、解釋說明、推斷預測、設計驗證和分析評價等多樣化活動,培養學
生高階思維。
關鍵詞:高階思維;鹽類水解;影響因素;多樣化活動
文章編號:1008-0546(2022)06x-0035-04?? 中圖分類號:G632.41?? 文獻標識碼: B
doi:10.3969/j.issn.1008-0546.2022.06x.009
一、教學內容及現狀分析
本課為蘇教版化學選擇性必修1《化學反應原理》專題3“水溶液中的離子反應”第三單元“鹽類的水解”第二課時[1]。《普通高中化學課程標準(2017年版2020 年修訂)》對這節內容的要求是:“認識鹽類水解的原理和影響鹽類水解的主要因素”[2]。在該課時之前學生已經能從宏觀和微觀兩方面認識弱電解質的電離平衡,以及影響電離平衡移動的因素;學會運用電離平衡常數、電離度、水的離子積來描述弱酸、弱堿和水的電離程度;認識了溶液酸堿性和pH 的檢測方法。對于化學反應的限度、平衡移動的方向等已有一定的認識和分析能力。鹽類的水解這一特殊平衡是對前面所學知識的綜合應用和提升,理論性強,在高考命題中往往將鹽類水解的綜合應用融入到新穎的工藝流程中,情境新,考查應用能力要求高。這就要求學生對鹽類水解的內容要深度學習。該課的教學設計在近幾年體現出關注培養學生的化學學科核心素養,從不同的視角開展教學。如:胡愛彬[3]采用循證教學實驗探究的方法,王建娣[4]基于學科觀念建構進行教學設計。采取怎樣的教學策略能更有效地引導學生建構“鹽類水解”的化學知識,促進學科核心素養發展?本文以高階思維培養為“影響鹽類水解的因素”一課的教學設計總思路,為素養為本的化學教學提供新的視角。
二、教學思想與創新點
1.設計真實學習情境,激發高水平問題
選擇碳酸鈉、碳酸氫鈉、84消毒液等熟悉的物質在生活中的應用為情境,讓學生意識到化學就在身邊,嘗試用化學的視角去看待身邊的事物。對于碳酸鈉和碳酸氫鈉的應用,學生較為熟悉,但未從化學學科本原上去思考原因。新冠疫情期間84消毒液是家庭、學校必備品,它的使用中蘊含著哪些化學知識?這樣的真實情境,對學生的思維有很強的驅動性,可引發高水平思考。
2.開展多樣化活動,發展高階思維能力
依據所授課程內容和教學目標,設計并開展多樣化活動,提高課堂教學的有效性,達到思維能力的發展要求。針對影響鹽類水解平衡因素的特點,用不同功能性設計開展學生活動,引導學生學會從本質角度去思考,由因及果。如:弱酸陰離子結合氫離子的能力大小決定強堿弱酸鹽水解程度的大小,其宏觀表征是溶液堿性的差異。對于溫度、外加酸(或堿)這兩個因素,在前面所學基礎上可鼓勵學生自主設計、交流實驗方案,分組進行實驗探究,并對實驗結果進行理論解釋。在學以致用方面,大膽拋給學生一組科研數據,讓學生結合數據進行分析評價。開放性的思維培育,會提升學生多角度、深層次的解釋說明能力。
三、教學目標
(1)能正確測定溶液的pH,會依托宏觀實驗現象判斷離子水解程度。
(2)學會從本質看問題,建構Ka與Kh聯系,化定性分析為定量計算。
(3)通過小組合作學習,完成實驗方案設計與實
驗操作,并能對現象表征做出理論解釋。
(4)能綜合運用影響水解平衡的因素,分析、解決
生產生活中的實例,感知化學學科的社會價值。
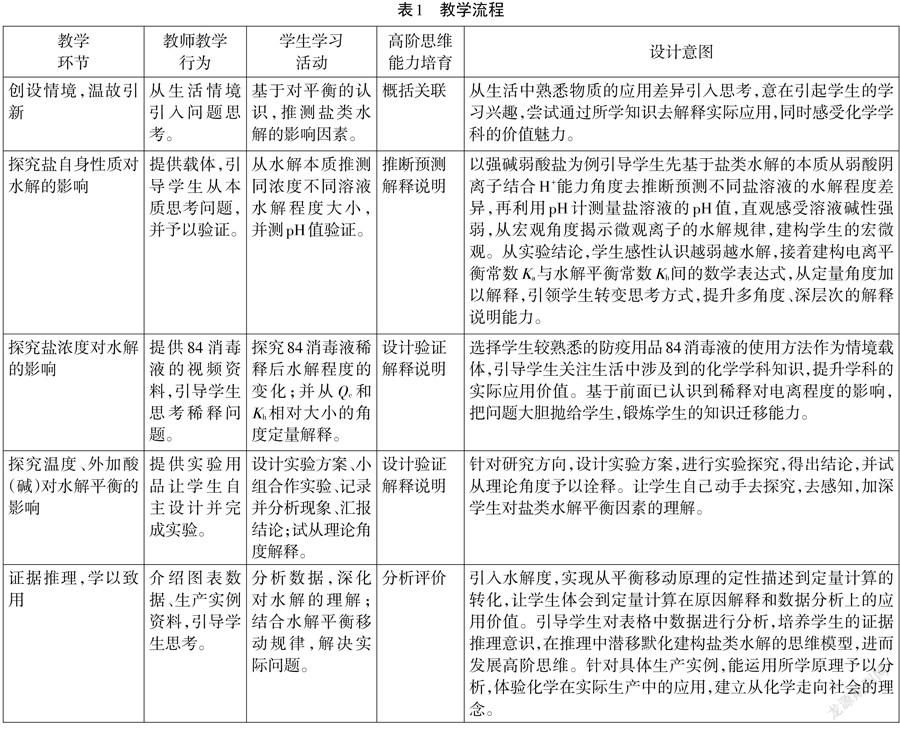
四、教學流程
依據教學目標,筆者精心設計概括關聯、解釋說明、推斷預測、設計驗證和分析評價等高階思維活動,引導學生在主動參與活動的過程中,發展高階思維能力。教學流程設計如表1所示。
五、教學過程
1.環節一:創設情境,溫故引新
[師]通過前面的學習我們知道Na2CO3和NaHCO3溶液都顯堿性,大家有沒發現這樣一個問題:為何碳酸鈉可用于去除油污,而碳酸氫鈉很少這樣應用?為何碳酸氫鈉可以用作胃藥,而碳酸鈉不可以?
[生]二者的堿性不一樣,碳酸鈉強于碳酸氫鈉。
[追問]為什么同濃度下,碳酸鈉堿性大于碳酸氫鈉?
[生]水解程度不一樣。
[師]鹽類的水解程度受哪些因素影響?基于前面學習中對化學平衡的認識,大家試著推測一下。
[生]討論與交流,教師引導。
[小結]鹽自身的性質(內因)、溶液的溫度、鹽的濃度、外加酸或堿(外因)。
2.環節二:探究鹽自身性質對鹽類水解的影響
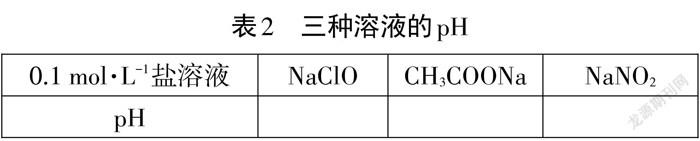
[師]對于物質的量濃度相同的不同種類的鹽溶液,它們的水解程度有沒有差異?同學們的實驗臺上有三瓶濃度均為0.1 mol ·L-1的NaClO、CH3COONa、NaNO2溶液,大家預測一下三種溶液的水解程度是否相同?你推導的理論依據是什么?同學們可進行討論并給出解釋。
[生]水解程度不同,因為不同的弱酸陰離子結合水電離產生的H+能力有差別。結合H+能力越強,生成弱電解質的傾向越大,水解程度越大。
[師]怎么驗證水解程度呢?
[生]三種鹽溶液堿性有差異,可測三種溶液的 pH來判斷其水解程度大小。
[學生活動]用pH計測量三種溶液的pH,完成表2。
[師]請第三小組同學說一下你們的測量數據。
[生]NaClO溶液 pH 為11.1,CH3COONa 溶液 pH 為9.3,NaNO2溶液pH為9.1。
[師]pH測量的結果是NaClO溶液最大,NaNO2溶液最小。已知常溫下HClO:Ka=4.0×10-8;CH3COOH: Ka =1.8×10-5;HNO2:Ka =5.6×10-4[1],結合測量數據說出你的想法?7E0DD87B-56B0-4708-AA1B-C0DF1EB86194
[生]鹽水解生成的弱酸越弱,該鹽的水解程度越大。
[師]那么弱酸的電離平衡常數Ka與水解平衡常數Kh間能否建立起聯系呢?
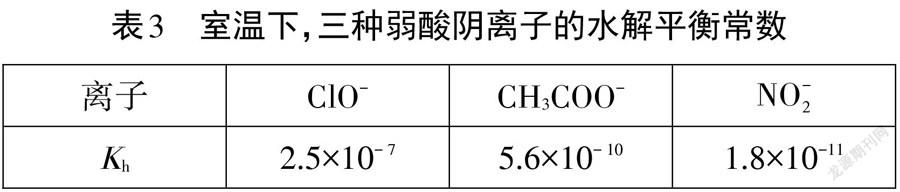
[學生活動]推導得到強堿弱酸鹽水解平衡常數的數學表達式Kh=KW/Ka,完成表3。
[師]通過定量計算三種弱酸陰離子的水解平衡常數,我們直觀感受到了它們的水解程度。
3.環節三:探究鹽濃度對鹽類水解的影響
[師]今年因為新冠疫情,預防性消毒成為常態化防控措施,家庭中常用什么物質來消毒呢?
[生]84消毒液,酒精等。
[師]84消毒液的有效成分是什么?能殺滅新冠病毒嗎?要怎樣正確使用?
[視頻]認識84消毒液。
[師]專家強調:84消毒液使用前一定要稀釋,對于NaClO這種強堿弱酸鹽溶液稀釋后,水解是不是減弱了?可如何探究?
[生]可測量溶液稀釋前后的pH變化。
[師]現提供NaClO溶液、pH計、100 mL 的針筒注射器、小燒杯、純凈水,請大家設計實驗,測量一下。
[學生活動]用pH計測量NaClO溶液稀釋10倍前后的pH變化。
[師]我們請第一組同學來分享一下他們的探究過程與結果。
[生]先用pH計測量NaClO溶液稀釋前的pH值為12.2,接著用注射器先抽取5 mLNaClO溶液,再抽取純凈水直至溶液體積為50 mL,實現稀釋10倍,后將溶液置于小燒杯中,用pH計測量稀釋后的pH值為11.5,pH值減小了0.7。
[師]實驗數據直觀表征NaClO溶液稀釋10倍前后pH變化小于1,說明什么?
[生]說明稀釋促進了NaClO水解。
[師]能否從定量角度用水解平衡常數來解釋呢?
[小結]可以從濃度商 Qc和水解平衡常數Kh相對大小的角度定量地解釋實驗結論。理論證明;溶液稀釋后,水解平衡正向移動。
4.環節四:探究溫度、外加酸(堿)對鹽類水解的影響
[師]溫度、外加酸(堿)對水解平衡的影響,以氯化鐵溶液為實驗載體進行探究,請同學們結合化學平衡移動原理及所提供實驗用品設計實驗方案,小組討論后完成實驗,并記錄好實驗現象(表4)。
[學生活動]實驗探究“溫度、溶液酸堿性對水解平衡的影響”。
實驗用品:試管若干、試管夾、酒精燈、火柴、0.1 mol ·L-1氯化鐵溶液,6 mol ·L-1鹽酸。
[師生]小結整理得到結論。依據氯化鐵溶液加熱后顏色變深可得結論:升高溫度,水解平衡正向移動。
[追問]能否從理論角度解釋?
[生]水解反應的逆反應是中和反應,中和反應是放熱反應,因而水解反應是吸熱反應。根據平衡移動原理,升溫促進水解。
[師]依據氯化鐵溶液加入幾滴濃鹽酸后溶液顏色變淺可得,外加酸對水解平衡的影響:鹽溶液呈酸性,增大H+濃度,水解平衡逆向移動。
[追問]當鹽溶液顯堿性呢?怎樣抑制其水解?
[生]外加堿,增加OH-的濃度。
[師]推論:鹽溶液顯堿性,增大OH-濃度,水解平衡逆向移動。
5.環節五:證據推理,學以致用
[師]在了解了鹽類水解程度大小受哪些因素影響后,有這樣一組水解度數據(表5),同學們試著分析一下,從中能得出什么結論?
[生1]從表中Na2CO3與 NaHCO3的水解度數值可以看出 CO -比 HCO-3水解程度大。
[生2]從表中CH3COONa 和NH4Cl 的水解度數值相同可見CH3COO-和 NH 的水解程度一樣,CH3COONH4溶液應該顯中性。
[生3]CH3COONH4中 CH3COO-與 NH 水解相互促進,水解程度變大,但從數值看仍很有限,CH3COO-與 NH 可以大量共存。
[師]同學們能從多角度分析,幾位同學都講得很好。當兩種不同離子都能水解時,它們就會相互影響。大家可以多思考,相互探討交流。
[師]與同學們交流兩個生產實例。
生產實例一:防曬劑的“新寵”—納米TiO2,既能吸收紫外線,又能反射、散射紫外線,還能透過可見光。已知:工業上可用TiCl4與大量水進行水解生成TiO2?xH2O。
TiCl4+(x+2)H2O(過量)TiO2·xH2O ↓+4HCl
[思考]制備時要加入大量水,同時加熱,其目的是什么?
生產實例二:工業從海水提取鎂。
苦鹵→Mg(OH)2→MgCl2溶液→MgCl2·6H2O→無水MgCl2→Mg
[思考]在海水提取鎂的生產工藝中,將MgCl2·6H2O 轉化為無水MgCl2時,該如何控制生產條件?
六、總結與反思
學生化學高階思維能力的形成與發展,離不開化學高階思維活動。教師作為教學活動的設計者,應根據教學目標設計多樣化的活動,并明確各活動的素養定位。讓學生在分組討論、設計實驗方案、交流完善方案、實驗實際操作、分析總結、數據證據推理等多樣化的活動中學會求知,學會將已有知識與陌生信息進行有機整合。本節課開展多樣化活動,在挑戰性任務的驅動下,學生由被動接受知識轉變為自主完成學習,對“知識遷移能力”“預測、觀察和解釋能力”“推理能力”“問題解決能力”的培育都起到了一定作用,達到預期的教學效果。從課堂實施過程中學生的表現反饋及課后交流中也發現了一些問題:一是在探究溫度、外加酸對氯化鐵溶液水解的影響中,有的學生不懂得做對比實驗;二是在用pH計測定同濃度的NaClO、CH3COONa、NaNO2溶液的pH 時,兩個小組的數據出現偏差,存在 pH計使用不當和實驗操作不規范等問題;三是實驗儀器、試劑均由老師框定,弱化了學生對儀器、試劑選擇的思考。建議在氯化鐵水解實驗中除提供6mol ·L-1? 鹽酸外,也提供0.1 mol ·L-1鹽酸和0.1 mol ·L-1氫氧化鈉溶液,增設干擾因素,考驗學生的問題解決能力。另外,在創造性思維培育方面可查閱資料適當拓展,留給學生課后思考空間。學生高級思維能力的培養,需要教師在教學中有意識地不斷嘗試、滲透。
參考文獻
[1]王祖浩.普通高中教科書(化學選擇性必修1·化學反應原理)[M].南京:江蘇鳳凰教育出版社,2021.
[2]中國人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[S].北京:人民教育出版社,2020.
[3]胡愛彬.以循證教學實驗探究啟迪學生深度學習——以“水解平衡的移動和應用”為例[J].中學化學教學參考,2021(5):15-16.
[4]王建娣,葉靜.基于學科觀念建構的中學化學教學設計——以“影響鹽類水解的因素為例”[M].化學教與學,2020(3):60-63.
[5]解慕宗,林建芬.從“鹽與水的故事”到“鹽與鹽的故事”——深圳市高三名師好課“鹽類的水解”觀感論析[J].中學化學教學參考,2018(3):12-15.7E0DD87B-56B0-4708-AA1B-C0DF1EB86194

