NLR、PLR 以及網織紅細胞系列指標對肥胖合并OSAHS 患者病情的臨床價值分析
趙男
OSAHS 是睡眠時出現的呼吸道阻塞綜合征,主要是睡眠時呼吸暫時受阻和精神狀態差的臨床表現。近年來,OSAHS 在全球上其發病率一直快速增加。根據相關流行病學調查證實,OSAHS 和高血壓病、冠心病等疾病關系緊密。而且,肥胖人群在OSAHS 患者中的比例高達60%以上。如果不及時治療,會增加高血壓、糖尿病甚至猝死的風險。因此,有必要采取積極的減肥措施,降低重度肥胖患者發生OSAHS 的風險[1]。但是,如何及時評估肥胖合并OSAHS 的嚴重程度,并指導下一步的治療,成為臨床研究者面臨的問題。目前,多導睡眠圖(PSG)已被公認為診斷本病的金標準,但是操作過程很繁瑣,患者不易接受。所以,能否提供一個既能準確診斷OSAHS,其操作又較簡便的檢查方式,就是現在研究的關鍵。研究發現,肥胖通常伴有OSAHS,而且肥胖可以誘發全身的炎癥作用。而間歇性缺氧(IH)是OSAHS 患者的主要病理生理特征。同時,缺氧又可導致細胞壞死、巨噬細胞浸潤的發生。另一項研究發現,IH 暴露數天后,RET 明顯升高[2]。所以,通過研究上述指標的變化情況和OSAHS 輕重情況的聯系,就能夠得到一種便捷的生化指標對肥胖合并OSAHS 的患者進行診斷,并預測治療效果,為臨床診治提供更多幫助。
1 資料與方法
1.1 一般資料 選取2019 年6 月~2020 年6 月沈陽醫學院附屬第二醫院收治的20 例肥胖合并OSAHS 患者作為觀察組,同時選取同期本院健康體檢者20 例作為對照組。觀察組男14 例,女6 例;年齡36~70 歲,平均年齡(56.2±6.7)歲。對照組男15 例,女5 例;年齡34~72 歲,平均年齡(58.4±6.5)歲。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。其中觀察組依據AHI 分為輕度OSAHS 組(5 次/h≤AHI<15 次/h,16 例)與重度OSAHS 組(AHI≥30 次/h,4 例)。
1.2 診斷、納入及排除標準
1.2.1 診斷標準 所有患者均依據《美國睡眠醫學會睡眠及其相關事件判讀手冊》中記錄的診斷標準評定為OSAHS。
1.2.2 納入標準 ①符合診斷標準的患者;②體質量指數(BMI)≥32.5 kg/m2;生活方式變化和醫療難以控制,并滿足至少2 種代謝綜合征或糖尿病;③患者語言能力正常,積極配合實施PSG;④對試驗目的及過程充分了解,并簽署知情同意書。
1.2.3 排除標準 ①BMI<27.5 kg/m2,或者沒有并發癥和代謝異常綜合征;②患有急慢性肝腎功能不全、腫瘤及免疫系統疾病等;③患有急慢性心肺系統疾病;④患有精神疾病或嚴重認知障礙者;⑤近半年接受抗凝或全身皮質類固醇治療;⑥依從性差,不能配合完成PSG 的患者;⑦患有甲狀腺功能減退(甲減)或肢端肥大癥等誘發的繼發性肥胖,或者已接受或正在接受減肥的患者。
1.3 方法 所有納入者均在安靜舒適的狀態下,使用Anoba S4500 多導監護儀進行檢查,給予患者夜間睡眠呼吸監測,使用國際標準同步記錄腦電圖(EEG)、眼電圖(EOG)、肌電圖(EMG)、胸腹呼吸、鼻呼吸氣流、心率及外周血氧飽和度等,以上數據由兩位醫師共同分析。經數據分析后,選取18:00~19:00 采集兩組外周靜脈血2 ml,并通過Sysmex K-4500 全自動血液分析儀分析血液指標,包括NLR、PLR、RET 和IRF。
1.4 觀察指標 比較觀察組與對照組、輕度OSAHS組與重度OSAHS 組的NLR、PLR、RET、IRF 水平。
1.5 統計學方法 采用SPSS20.0 統計學軟件處理數據。計量資料以均數±標準差()表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗。P<0.05 表示差異有統計學意義。
2 結果
2.1 觀察組與對照組血液指標水平比較 觀察組NLR、PLR、RET、IRF 水平均顯著高于對照組,差異有統計學意義(P<0.05)。見表1。
表1 觀察組與對照組血液指標水平比較()
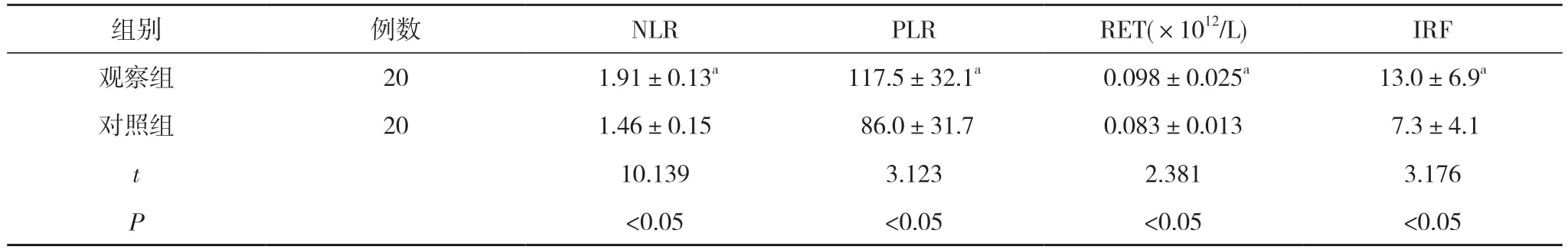
表1 觀察組與對照組血液指標水平比較()
注:與對照組比較,aP<0.05
2.2 輕度OSAHS 組與重度OSAHS 組血液指標水平比較 重度OSAHS 組NLR、PLR、RET、IRF 水平均顯著高于輕度OSAHS 組,差異有統計學意義(P<0.05)。見表2。
表2 輕度OSAHS 組與重度OSAHS 組血液指標水平比較()
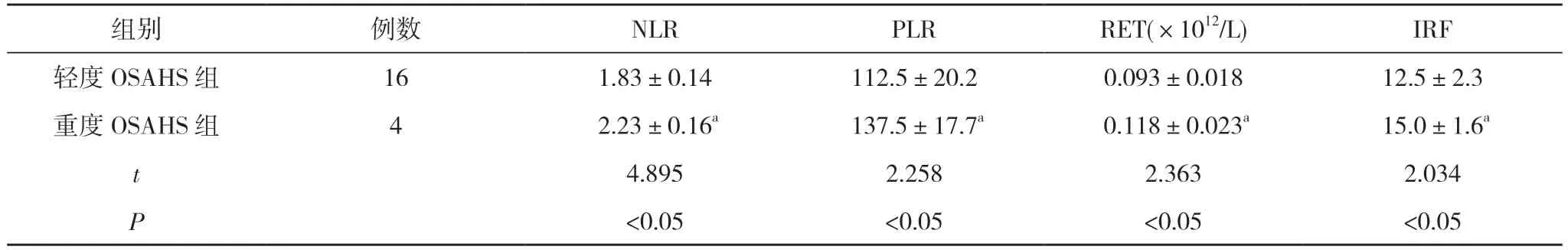
表2 輕度OSAHS 組與重度OSAHS 組血液指標水平比較()
注:與輕度OSAHS 組比較,aP<0.05
3 討論
OSAHS 是一種非常多見的睡眠呼吸阻塞綜合征,臨床癥狀是睡眠時發生上呼吸道的阻塞,導致呼吸被迫停止或者明顯減弱,出現短暫的乏氧,致使患者睡眠質量差、白天精神差,影響其精神及生理功能[3]。而肥胖是發生OSAHS 的一個常見病因。病理上,肥胖的患者,其上呼吸道周圍旁有大量的脂肪層,可壓迫氣道、塌陷,導致管腔狹窄,影響氣流通過。人體乏氧時,會導致患者睡眠質量差,干擾正常的睡眠規律,同樣導致酯類代謝功能低下。所以,肥胖和OSAHS 是互為因果的。另外,肥胖也是一種慢性的輕微炎性反應,黃海濤等[4]試驗證實,肥胖與脂肪細胞增殖和細胞缺氧有關,細胞缺氧也會刺激巨噬細胞大量分泌缺氧誘導因子1(HIF-1),從而加速單糖產生,促進M1 基因的復制,導致全身炎性反應。考慮到乏氧、炎性反應等因素和OSAHS 的密切關系,肥胖患者的免疫指標水平可以明顯有利于診斷OSAHS。中性粒細胞全程參與了感染性癥狀的祛除過程,在免疫系統中有很多作用。正常情況下惡炎性反應,其外周血的中性粒細胞計數增加,同時淋巴細胞計數減少。而NLR 同時代表兩種不同的免疫表達,經常被用來診斷急性心血管疾病、惡性腫瘤和急性炎癥。陸治平等[5]試驗證實了OSAHS的嚴重程度與NLR 值具有重要關系。重度OSAHS 組的NLR 值明顯高于輕度OSAHS 組,隨著AHI 的增加,NLR 也相對增加,與本次試驗結果基本相同。網織紅細胞是介于晚期紅細胞和成熟紅細胞之間的一種過渡細胞,反映了骨髓的造血功能。IRF 是未成熟網織紅細胞占網織紅細胞總數的百分比。未成熟網織紅細胞的RNA 量略少于常規網織紅細胞,說明骨髓細胞的狀態早于網織紅細胞,在缺氧和溶血的應激下,骨髓可以通過嚴格的調節機制提高紅細胞生成率,導致外周血循環網織紅細胞增多。IH 是OSAHS 的基本生理特征。OSAHS 中血細胞的變化可能是由于缺氧產生的HIF,增強了促紅細胞生成素(EPO)的產生,從而提高了基礎紅細胞的產生率[6]。
綜上所述,IRF、PLR、NLR 以及RET 水平的變化和肥胖合并OSAHS 患者的病情輕重變化情況關系密切,所以可以通過上述指標的共同測量對肥胖合并OSAHS 的患者進行簡單的診斷,預測患者的病情輕重情況。

