中焦點穴對功能性消化不良大鼠十二指腸動力的干預作用及部分效應機制研究
楊丹妮 陳幼楠 葛東宇 曲萌 賀萌 林小娟
功能性消化不良(functional dyspepsia,FD)是一種涉及胃和十二指腸區域復雜癥狀的疾病,包括上腹痛或灼燒、餐后飽腹或早期飽腹[1]。因FD多為復合癥狀,難以針對性治療,從而影響患者的生活質量。大約80%的消化不良患者沒有結構性的病變,其生理病理機制尚不完全清楚,其中十二指腸運動障礙是主要的癥狀之一[2]。有研究發現[3],十二指腸的輕度炎癥能引起局部感覺、運動障礙,從而導致腹脹、腹痛。腹部推拿可以調節中焦氣機升降,促進胃腸道的蠕動。闌門穴是臟腑圖點穴法第一式的起始穴,具有調理小腸分清泌濁的功效[4]。建里屬任脈穴位,善于調理脾胃,具有消積化滯的功效,是治療胃腸相關疾病中中焦氣機不暢的常用穴[5]。闌門和建里都屬于中焦穴位,用推拿點穴的方法可以調節中焦氣機升降,對十二指腸動力產生良性調節作用[6-7]。胃腸動力的起搏和慢波的傳導根植于Cajal間質細胞(interstitial cells of cajal,ICC),SCF/C-kit通路與ICC的增殖、發育、分化、表型維持等作用密切相關[8]。本文通過觀察小腸推進率、十二指腸形態結構,檢測腫瘤壞死因子α(tumor necrosis factor,TNF-α)、干細胞因子(stem cell factor,SCF)、C-Kit原癌基因(C-Kit proto-oncogeneprotein,C-Kit)、磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)的表達,探究中焦點穴治療FD十二指腸動力障礙的可能機制。
1 材料與方法
1.1 實驗動物
36只雄性健康SPF級SD大鼠,購自北京維通利華實驗動物技術有限公司,6周齡,體質量約180~200 g。動物生產許可證號:SYXK(京)2016-0006。所有實驗大鼠均于北京中醫藥大學良鄉實驗動物房中飼養,相對濕度40%~50%,溫度(22±2) ℃,光照為12小時交替明暗,保持動物房環境通風整潔,及時更新食物及飲用水,適應性喂養7天后開始實驗。該實驗經北京中醫藥大學動物倫理委員會批準,審查批號:BUCM-4-2021032602-1058。
1.2 實驗藥物與試劑
枸櫞酸莫沙必利(MREDA公司,02008221),ACK2阻斷劑(BIOLEGEND公司,135131),SCF抗體(proteintech 公司,26582-1-AP),C-kit抗體(Abcam ,ab256345),GAPDH抗體(proteintech 公司,60004-1-lg),IgG兔二抗(proteintech 公司,SA00001-2),IgG鼠二抗(proteintech 公司 ,SA00001-1),TNF-α、SCF、C-Kit ELISA試劑盒(RGB&CHN,RGB-60080R、RGB-60501R、RRGB-60500R)。
1.3 實驗儀器
賽默飛多功能酶標儀、賽默飛低溫高速離心機、賽默飛超低溫冰箱(美國Thermo Scientific公司),艾本德微量移液器(德國艾本德國際貿易有限公司),CP124S電子天平(德國SARTORIUS AG公司),DYY-6C型電泳儀(BIO-RAD Mini-TRANS-BLOT CELL),TS-8搖床(海門市其林貝爾儀器制造有限公司),化學發光、熒光成像系統(BIO-RAD GelDoc XR+)。
1.4 動物分組、造模及給藥
36只大鼠編號后采用隨機數字表法分為空白組、模型組、模型阻斷組、西藥組、點穴組、點穴阻斷組,每組6只。采用輕度夾尾刺激法+不規則飲食法[7]對模型組、模型阻斷組、西藥組、點穴組、點穴阻斷組造模,建立FD模型。夾尾刺激時,將造模大鼠隨機分為5組,每6只一批放在同一桶內,用長海綿鉗夾大鼠尾巴遠端,激怒大鼠,使其前肢離地,尋釁與其他大鼠撕打以激怒全籠的大鼠,刺激30分鐘/次,2次/天,兩次間隔大于6小時。夾尾刺激后按原序號放回所屬組內。單日禁食,雙日投喂充足食物,飲水正常,造模共21天。模型阻斷組、點穴阻斷組從造模第5天起,以0.2 mg/kg的標準注射ACK2阻斷劑,隔日一次,持續到干預結束。
造模結束后,各組大鼠正常喂養1天,第2天點穴組與點穴阻斷組點撥闌門、建里穴(參照《實驗針灸學》《臟腑圖點穴法》)進行干預,以大鼠的頭部為上,在闌門、建里穴施以左右方向的點撥,點穴層次以觸及腹主動脈明顯搏動為標準。每穴點撥6分鐘,共12分鐘。西藥組給予莫沙必利藥液(以大鼠與人臨床用藥劑量、體型系數公式計算并稀釋成劑量為0.137 g/L水溶液)按照10 mL/kg灌胃,灌胃后抓取12分鐘。上述組干預大鼠的同時也對空白組、模型組大鼠進行抓取12分鐘、同體積生理鹽水灌胃。6組大鼠在最后1次灌胃后禁食,24小時后進行標本采集。
1.5 標本采集
測定當天制備營養性半固體糊,稱體重后按照10 mL/kg灌服。30分鐘后麻醉斷頭處死大鼠,開腹,結扎幽門并剪開,迅速取出整段小腸,在測完小腸推進率后,取距大鼠幽門2~4 cm的十二指腸組織,迅速放于凍存管中-80℃保存。取距大鼠幽門4~6 cm的十二指腸組織放于固定液中,48小時后將固定的標本進行包埋處理。
1.6 小腸推進率計算
取出整段小腸后剝離腸系膜,將小腸鋪于白紙上,用軟尺測量幽門至回盲腸部全長及幽門至半固體糊前沿的距離。計算公式:小腸推進率=幽門至營養半固體糊前沿的距離/幽門至回盲部全長×100%。
1.7 十二指腸組織形態學觀察
使用石蠟切片機切片(4 μm),室溫,切片盒保存; 使用二甲苯及各濃度乙醇進行脫蠟,蘇木素染色,分化,伊紅染色,脫水,透明,封片。于生物顯微鏡下觀察組織形態結構變化,經圖像采集系統收集圖片。
1.8 蛋白印記法(Weston blot,WB)檢測SCF、C-Kit、PI3K蛋白的表達
取凍存的組織約0.02 g,置于組織勻漿器中,離心后取得上清液,用BCA法測定蛋白濃度,將樣品加入loading buffer與PBS混勻,95℃加熱5分鐘使蛋白變性,上樣。電泳設置80V 15分鐘,100V 80分鐘,電轉400V 27分鐘,室溫封閉,加入稀釋后的一抗,孵育4℃過夜。12小時后加入稀釋后的二抗孵育1小時,成像。采用Image J軟件分析各條帶灰度值。
1.9 酶聯免疫吸附法(enzyme linked immunosorbent assay,ELISA)檢測十二指腸TNF-α、SCF、C-Kit的含量
取凍存的組織0.05 g,稱重后置于組織勻漿器中,離心后取得上清液,按照ELISA試劑盒操作步驟進行檢測,與標準品比較計算TNF-α、SCF、C-Kit的含量。
1.10 統計分析
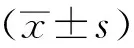
2 結果
2.1 一般情況的觀察
造模期間,空白組的精神狀況良好,食量及飲水正常,毛色鮮亮有光澤,排便成型。造模各組精神萎靡,出現瞇眼、活動次數減少的現象。毛色枯黃無光澤,造模各組體型明顯消瘦,食量減少。造模各組夾尾時易怒,常有與同伴廝打和跳出造模桶的現象,排便不成型,呈稀水樣便。
2.2 中焦點穴對小腸推進率的影響
與空白組相比,模型組、模型阻斷組、西藥組小腸推進率明顯降低(P<0.05);與模型組相比,點穴組、點穴阻斷組小腸推進率明顯上升(P<0.05);模型阻斷組與點穴阻斷組小腸推進率有顯著差異(P<0.05)。如表1。

表1 各組FD大鼠小腸推進率的比較
2.3 中焦點穴對十二指腸形態結構的影響
各組十二指腸無明顯器質性改變,模型組十二指腸黏膜層可見炎性細胞浸潤,肌層變薄;干預后點穴組炎性細胞浸潤有明顯減少,肌層有恢復的趨勢。如圖1。

注: A 空白組;B 模型組;C 模型阻斷組;D 西藥組;E 點穴組;
2.4 ELISA法檢測十二指腸組織中TNF-α、SCF、C-Kit表達的水平
與空白組相比,模型組、模型阻斷組、點穴阻斷組SCF、C-Kit表達顯著降低、TNF-α表達顯著升高(P<0.05);與模型組相比,西藥組、點穴組SCF、C-Kit表達顯著升高、TNF-α表達顯著降低(P<0.05);與點穴組相比,點穴阻斷組SCF、C-Kit表達顯著降低、TNF-α表達顯著升高(P<0.05)。如表2。

表2 各組FD大鼠十二指腸組織TNF-α、SCF、C-Kit含量的比較
2.5 Weston blot法檢測十二指腸組織中SCF、C-kit、PI3K蛋白表達的水平
與空白組相比,模型組、模型阻斷組、點穴阻斷組蛋白的表達均顯著降低(P<0.05),西藥組的C-Kit、PI3K的表達顯著降低(P<0.05);與模型組相比,西藥組、點穴組蛋白的表達均顯著升高(P<0.05);與點穴組相比,點穴阻斷組SCF、PI3K的表達顯著降低(P<0.05),C-Kit的表達有下降的趨勢但無顯著差異(P>0.05);西藥組與點穴組相比PI3K的表達有顯著差異(P<0.05)。如圖2、表3。

注: A 空白組;B 模型組;C 模型阻斷組;D 西藥組;E 點穴組;F 點穴阻斷組

表3 各組FD大鼠十二指腸組織SCF、C-kit、PI3K蛋白表達的比較
4 討論
現代研究中對功能性消化不良病理生理學的最新認識是將十二指腸作為致病中心,認為上腹痛或灼燒、餐后飽腹或早期飽腹多與十二指腸密切相關[9-11]。Miwa H等[11]人認為,FD的相關病理因素如胃酸分泌、幽門螺旋桿菌感染、微生物群、胃腸激素等都是通過刺激十二指腸而產生的。當十二指腸黏膜通透性增加時,會促使腸腔中的脂肪酸、膽汁酸、微生物等多種刺激物透過黏膜層,形成十二指腸低度炎癥。Samsom等人[12]發現,給FD患者和健康人對照組的十二指腸注入酸時,與對照組相比,FD患者會產生十二指腸運動障礙。還有研究顯示[13],FD常伴隨十二指腸無力性收縮導致十二指腸運動障礙的產生。本實驗結果與以上研究結論相一致,HE結果顯示模型組、模型阻斷組十二指腸黏膜層可出現炎性細胞浸潤、肌層變薄的現象,提示本實驗中FD模型可能存在十二指腸低度炎癥。干預后點穴組炎性細胞浸潤有明顯減少,肌層有恢復的趨勢。模型組小腸推進率與空白組相比顯著降低,而在使用C-Kit阻斷劑ACK2之后,模型阻斷組的小腸推進率進一步降低,經過中焦點穴治療后,小腸推進率明顯上升,與空白組無明顯差異,進一步提示本實驗中FD伴隨著十二指腸低度炎癥和十二指腸動力障礙,中焦點穴可以緩解十二指腸低度炎癥,并通過SCF/C-Kit通路恢復十二指腸動力。
實驗結果中點穴阻斷組的小腸推進率與空白組、點穴組無顯著性差異可能是因為中焦點穴可能通過機械刺激改變腹部壓力,從而加速食物通過胃腸道[14];中焦點穴通過調節交感神經與副交感神經促進十二指腸的運動。副交感神經起于第四腦室底部的迷走神經背核處,是迷走神經的主要成分,與交感神經在腹部共同負責內臟的運動[15]。Ting SJ等[16]發現,在十二指腸肌間神經叢中存在大量的交感神經與迷走神經軸突。研究顯示,FD患者存在副交感神經張力的降低[17-18],在腹部進行推拿可以調節交感神經與副交感神經的活動,從而促進胃腸的蠕動[19]。
十二指腸的運動由腸壁內層的環行肌和外層縱行肌的舒縮運動共同完成,其運動形式分為三種:緊張性收縮、分節運動及蠕動。蠕動將分節運動后的腸內容物向前推進一步,到新的腸段再開始新的分節運動。慢波對于蠕動和分節運動的產生非常重要[20]。ICC是腸運動基本單位中重要的協調者[21]在十二指腸中主要存在兩種ICC亞型,肌間ICC位于十二指腸環形肌與縱形肌之間,是慢波的起搏細胞;深肌神經叢位于十二指腸環形肌深部腸肌神經叢中,它們僅在小腸中發現,有介導腸道神經遞質的作用[22]。酪氨酸激酶受體(C-Kit)是ICCs的特異性標志物,C-Kit的丟失會引起十二指腸動力障礙,SCF是C-Kit的天然配體,二者特異性結合后SCF/c-Kit通路可以調控ICCs的增殖、發育、分化與表型維持[23-25]。
胃腸道炎癥因子TNF-α的表達上調被認為在FD的發病機制中起到了關鍵性的作用[26]。促炎性M1巨噬細胞分泌的TNF-α可以激活核因子κB通路抑制SCF的表達,通過降低ICCs細胞活力、增加細胞凋亡來誘導ICC的炎癥性損傷[27]。 在 ICC 中,TNF-α還會降低 C-Kit表達并抑制 ICC 中的起搏電流、破壞ICC的表型并使ICC數量減少,從而使腸道蠕動異常[28]。本實驗結果顯示,模型組、模型阻斷組、點穴阻斷組SCF、C-Kit表達與空白組相比顯著降低、TNF-α表達顯著升高;與模型組相比,西藥組、點穴組干預后SCF、C-Kit表達顯著升高、TNF-α表達顯著降低;與點穴組相比,點穴阻斷組SCF、C-Kit表達顯著降低、TNF-α表達顯著升高,TNF-α與SCF、C-Kit的含量呈負相關,提示中焦點穴可以抑制FD大鼠十二指腸TNF-α的生成,進而恢復SCF、C-Kit的表達,從而影響ICC的增殖、發育、分化與表型維持。
PI3K是一種由p85、p110兩種亞基組成的二聚體蛋白質[29]。PI3K的調節亞基p85 可經由SCF誘發,與C-Kit 的Tyr721、Tyr730相關位點結合,激活PI3K/Akt通路,磷酸化后的蛋白激酶B(protein kinase B,Akt)可使凋亡因子Bad蛋白構象發生改變從而使其失活,還可使凋亡因子Bax形成同源二聚體促進細胞凋亡[30],從而使PI3K/Akt通路發揮抗凋亡作用,維持ICC細胞增殖的狀態[31]。有研究表明[32],PI3K的抑制劑LY 294002可在2~4天內抑制慢波的發展并阻止節律,出現慢波的振幅和頻率隨時間的減少,慢波消失的同時出現了腸內肌間ICC細胞消失。由此可知PI3K是肌間ICC增殖的關鍵下游信號,PI3K表達的減少會引起慢波消失與活動減弱,這與本實驗結果相符。實驗結果顯示,模型組、模型阻斷組、點穴阻斷組SCF、C-Kit、PI3K蛋白的表達與空白組相比顯著降低,西藥組、點穴組蛋白的表達與模型組相比顯著升高;與點穴組相比,點穴阻斷組SCF、PI3K的表達顯著降低,C-Kit的表達有下降的趨勢但無顯著差異。提示中焦點穴可能通過上調SCF/C-Kit通路,加強了ICC增殖信號PI3K的表達。
綜上所述,中焦點穴可以抑制FD大鼠十二指腸TNF-α的生成,緩解十二指腸炎癥,進而調節SCF/C-kit通路激活Cajal間質細胞增殖的相關信號,從而恢復十二指腸動力。

