維生素D缺乏對非酒精性脂肪性肝炎患者FIB-4指數及病情嚴重程度的影響
周 荃, 李金強, 黎曉武
長沙市第一醫院 感染科, 長沙 410000
隨著生活水平的提高與飲食習慣的改變,非酒精性脂肪性肝病(NAFLD)流行率逐漸上升,已成為世界上最常見的慢性肝病之一,在亞洲國家患病率約為25%[1],而在我國成年人中,患病率達29.2%[2]。NAFLD是一種與胰島素功能障礙、遺傳密切相關的代謝性肝損傷,是排除了酒精,由已知的其他肝損傷因素引發的肝細胞內脂質過度沉積所導致的肝臟疾病[3]。NAFLD不僅造成肝損傷,據研究[4],其對心腦血管、內分泌、泌尿系統亦產生影響,導致患者心腦血管疾病、2型糖尿病以及慢性腎病患病風險明顯升高。
依據NAFLD嚴重程度,可分為非酒精性單純性脂肪肝、非酒精性脂肪性肝炎(NASH)、肝硬化及肝細胞癌[5]。非酒精性單純性脂肪肝通常被視為良性非進展性疾病,而NASH可逐漸發展至肝纖維化、肝硬化乃至肝細胞癌,故而NASH逐漸成為近年來研究的熱點和難點。
維生素D起初因調節鈣磷代謝而被人們熟知,之后有大量研究[6-7]發現其能夠通過調節不同基因的表達而調控細胞增殖與分化,維生素D缺乏不僅導致骨骼相關疾病,而且影響著代謝綜合征、內分泌系統疾病事件的發生。有研究[8]指出,維生素D水平與肝細胞脂質沉積、肝細胞壞死、肝纖維化程度密切相關。但也有學者[9]提出了不同觀點,認為維生素D缺乏反而挽救了高脂膳食誘導的肝臟脂肪積累及脂肪酸代謝關鍵基因的轉錄。脂肪組織的內分泌功能十分活躍,能夠分泌IL-18等細胞因子,IL-18依靠強大的生物活性能夠直接損害肝細胞,在NASH中逐漸被人們重視[10];而IL-37作為近年新發現的抗炎因子在維持免疫平衡中發揮重要作用。ALT、TBil、TC、TG已被證實為脂肪性肝病發生的獨立影響因素[11],因此,本研究通過比較不同1,25(OH)2D3水平下NASH患者ALT、AST、TBil、TC、TG水平及FIB-4指數、肝臟病理分級以闡明維生素D缺乏與肝纖維化及病情嚴重程度之間的關系,并檢測IL-18、IL-37水平以探究NASH可能的發生機制,為防治NASH提供更多參考。
1 資料與方法
1.1 研究對象 選取2020年1月—2021年10月冬春季在本院感染科住院治療的NASH患者。納入標準:(1)年齡18~60歲,無飲酒史;(2)符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[12]診斷標準;(3)臨床資料、數據完善無缺失。排除標準:(1)病毒性肝炎、酒精性肝炎、自身免疫性肝炎、藥物性肝炎、肝豆狀核變性等其他原因導致肝損傷者;(2)使用激素或免疫抑制劑;(3)合并惡性腫瘤、甲狀腺疾病、腎病、炎癥性腸病、庫欣綜合征等導致脂肪肝的特殊情況。
1.2 研究方法
1.2.1 觀察指標 入組時記錄患者年齡、性別,測定實驗室指標包括1,25(OH)2D3、ALT、AST、TBil、TC、TG、IL-18、IL-37、PLT。
1.2.2 研究方法 所有受試者在入組時抽取5 mL空腹靜脈血,以3000 r/min離心5 min,收集血清,儲存在EDTA試管中。通過串聯質譜法進行1,25(OH)2D3定性和定量檢測[美國AB公司液相色譜串聯質譜儀(API400)]。使用全自動生化分析儀(美國BECKMAN公司)檢測血清ALT、AST、TBil水平。采用ELISA法檢測血清TC、TG、IL-18、IL-37水平(美國PD公司),使用美國Thermo公司生產的MK3酶標儀測定450 nm處的A值。采用血細胞計數儀測量PLT水平。
1.2.3 分組 美國國家科學院醫學研究所定義血清1,25(OH)2D3缺乏的標準為<20 ng/mL,不足為20~30 ng/mL,充足為>30 ng/mL[13]。根據血清1,25(OH)2D3水平將受試者分為3組:A組為1,25(OH)2D3缺乏組(<20 ng/mL);B組為1,25(OH)2D3不足組(20~30 ng/mL);C組為1,25(OH)2D3充足組(>30 ng/mL)。
1.2.4 FIB-4指數計算 FIB-4=年齡(歲)×AST(U/L)/[PLT(109/L)×ALT(U/L)1/2]
1.2.5 肝組織活檢 在B超引導下,使用滬產160 mm×16G穿刺針,在患者呼氣末屏住呼吸時負壓吸取長度超過1 cm的肝組織,經10%中性甲醛固定、石蠟包埋,切片為5 μm后行HE染色,依據Kleiner等[14]及張榮春等[15]建議的肝臟病理分級標準進行分級。
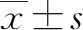
2 結果
2.1 一般資料 共納入NASH患者120例,其中男69例,女51例,平均年齡(39.71±10.49)歲。A、B、C 3組各40例,3組患者的年齡和性別比較差異均無統計學意義(P值均>0.05)(表1)。
2.2 3組患者1,25(OH)2D3水平及肝功能比較 結果顯示,與A組比較,B、C兩組患者1,25(OH)2D3水平均顯著升高(P值均<0.05),而ALT、AST、TBil水平均顯著下降(P值均<0.05)。與B組比較,C組患者1,25(OH)2D3水平升高,ALT、AST水平下降,差異均有統計學意義(P值均<0.05)(表1)。
2.3 3組患者FIB-4指數及TC、TG、IL-18、IL-37水平比較 結果顯示,與A組比較,B、C兩組患者FIB-4指數和TC、TG、IL-18水平均明顯降低(P值均<0.05),IL-37水平明顯升高(P<0.05)。與B組比較,C組患者FIB-4指數和TC、TG、IL-18水平均降低,IL-37水平升高,差異均有統計學意義(P值均<0.05)(表1)。

表1 3組患者觀察指標比較
2.4 1,25(OH)2D3與ALT、AST、TBil、TC、TG、IL-18、IL-37水平及FIB-4指數的相關性分析 相關性分析結果顯示,1,25(OH)2D3與ALT(r=-0.84,P<0.001)、AST(r=-0.77,P<0.001)、TBil(r=-0.32,P<0.001)、TC(r=-0.45,P<0.001)、TG(r=-0.42,P<0.001)、IL-18(r=-0.40,P<0.001)及FIB-4指數(r=-0.62,P<0.001)均呈負相關,而與IL-37(r=0.59,P<0.001)呈正相關(圖1)。

圖1 1,25(OH)2D3與ALT、AST、TBil、TC、TG、IL-18、IL-37水平及FIB-4指數的相關性
2.5 3組患者肝臟病理組織學比較 與A組相比,B、C組中與重度脂肪變、橋接纖維化與早期肝硬化、橋接壞死與大片壞死比例下降,且相較于B組,C組比例更低,差異均有統計學意義(P值均<0.05)(表2)。光鏡下可見A組患者肝細胞廣泛氣球樣變,肝細胞胞質內出現大量大泡性為主的脂滴,肝板排列紊亂,大量淋巴細胞浸潤,局灶橋接纖維化(圖2a);B組多數為點灶壞死,門靜脈周圍纖維化,脂滴大小不等,少量中性粒細胞浸潤,部分肝細胞氣球樣變,肝小葉結構尚清晰(圖2b);C組少量肝細胞氣球樣變,局灶竇周纖維化,少數點灶壞死,肝細胞胞質可見少量脂滴,大多數為大泡性,部分為小泡性或混合性(圖2c)。

表2 3組患者的肝臟病理組織學比較
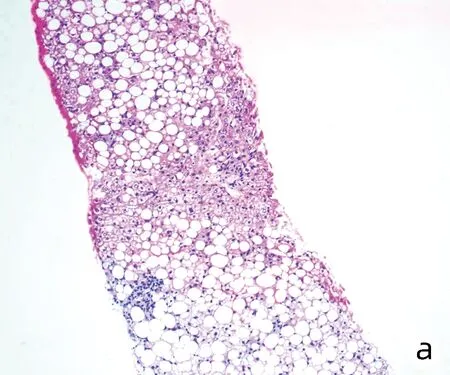
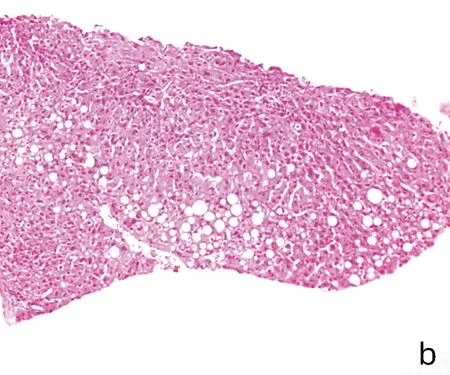

注:a,A組;b,B組;c,C組。
3 討論
在世界范圍內,一般人群中NAFLD患病率可達20%~30%[16],其中NASH作為NAFLD的嚴重類型是心血管疾病的獨立危險因素[17]。近年來,NASH發病率上升了5倍,且更多發生于年輕人,預測2030年德國NASH發病率將進一步增加15%[18],成為肝移植的最常見適應證。肝纖維化程度是反映NAFLD預后的主要標志[19],也可以用來區分非酒精性單純性脂肪肝和NASH,因此肝纖維化檢測在NASH患者中具有重要意義。已有FibroScan、FIB-4指數、APRI等無創方式來診斷及預測肝纖維化程度,但肥胖癥嚴重影響了FibroScan的檢測成功率,25%的患者無法獲取準確的肝臟彈性值[20],而FIB-4指數因易獲得,準確性與FibroScan相當,在幾種無創纖維化檢測方法中占據一定優勢。目前,肝穿刺活檢病理分級為評估脂肪變、纖維化及炎癥程度的金標準,因此,本研究選取FIB-4指數及肝臟病理組織學作為評判肝纖維化程度的指標。
維生素D作為一種多效性激素除了參與鈣穩態之外,也參與免疫炎癥和代謝過程。已有研究[21-22]證實,維生素D缺乏與胰島素抵抗相關疾病密不可分,如2型糖尿病、NAFLD及代謝綜合征。在以往的研究中,學者們試圖回答補充維生素D是否可以改善NAFLD,但結果存在爭議。例如,Dabbaghmanesh等[23]對NAFLD患者及轉氨酶正常的非糖尿病維生素D缺乏患者補充維生素D3(50 000 IU/周),結果發現與安慰劑相比,補充維生素D3未顯著改變肝酶水平;Geier等[24]研究中NASH患者每日補充2100 IU維生素D3,48周后NASH患者的血清ALT水平顯著降低。針對這一問題,本研究擬探討維生素D水平與肝纖維化及病情嚴重程度之間的關系,為后期NASH治療提供新的線索。
1,25(OH)2D3是人體內維生素D的最終活性形式,其半衰期為2~3周,這些條件決定了1,25(OH)2D3能夠作為評估人體維生素D含量的相對穩定指標。對大部分人而言,獲取維生素D的途徑來源于陽光照射,已有眾多研究[25-26]表明,適當的日照能夠改善維生素D缺乏性佝僂病、骨質疏松等,而維生素D的生成量與日照中紫外線照射時長及強度密切相關,夏季和秋季相對日照時間較長、強度較大,為避免日照時長和強度對1,25(OH)2D3水平的影響,本試驗選擇冬春季的住院患者為研究對象,提高結果的準確性。本研究結果顯示,1,25(OH)2D3水平越低,ALT、AST、TBil、TC、TG水平及FIB-4指數越高,肝細胞損傷范圍越大,胞質內脂肪沉積越多,表明維生素D缺乏的NASH患者肝損傷、肝纖維化程度更明顯,1,25(OH)2D3水平可以在一定程度上反映病情進展情況,NASH患者補充維生素D可提高脂肪清除能力,減少脂質沉積,減輕肝損傷,減慢肝纖維化進程。
IL-18致使肝臟微循環受損,逐步加重肝細胞線粒體破環,導致肝細胞脂質攝取和肝細胞炎癥因子的生成增加,亦可調節自然殺傷細胞分化,同時誘導多種多肽介質的產生,引起局部炎癥反應,還能夠刺激巨噬細胞生成一氧化氮,加強誘導型一氧化氮合酶的活性,誘導增強溶性細胞間黏附因子1的表達,促進肝細胞凋亡壞死[27]。IL-37降低肝細胞和Kupffer細胞產生的促炎細胞因子和趨化因子的能力,以及減少中性粒細胞激活和呼吸爆發,直接保護肝細胞免受氧化誘導的損傷[28]。本研究證實,隨著1,25(OH)2D3水平升高,肝損傷減輕,IL-18水平逐漸下降,而IL-37水平上升,提示NASH患者的肝纖維化及病情嚴重程度與IL-18高表達、IL-37低表達有關,炎癥反應及氧化應激促進了肝損傷的進展,通過補充維生素D可能減輕炎癥反應及氧化應激。
綜上所述,維生素D水平與NASH患者肝纖維化及病情嚴重程度密切相關,可以作為評估肝損傷程度的重要指標,同時為干預NASH提供新的方向,適時補充維生素D有望減輕肝損傷,減慢肝纖維化進程,但合適的補充劑量、時間及療程還有待進一步探討。
倫理學聲明:本研究方案于2019年7月1日經由長沙市第一醫院倫理委員會審批,批號:20190613030,所納入患者均簽署知情同意書。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:周荃負責實施研究過程,采集整理數據,設計論文框架,起草論文,修訂論文,終審論文;李金強負責調研整理文獻,提出研究選題,設計研究方案;黎曉武負責統計分析,提供指導性支持。

