降鈣素基因相關肽受體成分蛋白在肝細胞癌中的表達及其與預后的關系
孫冠群, 周思蕾, 曾榃倫, 劉君宇, 梁喜俊, 程 卓
1 海軍軍醫大學轉化醫學研究中心 臨床腫瘤研究所, 上海 200433;2 海軍軍醫大學附屬東方肝膽外科醫院 腫瘤科, 上海 200433
肝細胞癌(以下簡稱肝癌)是最常見的肝臟原發性腫瘤,致死率極高且預后差[1],5年生存率僅為18%,是繼胰腺癌之后排名第2位的致死性腫瘤[2]。根據世界衛生組織年度預測,2030年或將有超過100萬患者死于肝癌[3]。然而,目前尚缺少十分有效的肝癌標志物。因此,探索新的肝癌治療靶點和預測預后復發的生物標志物至關重要。降鈣素基因相關肽(calcitonin gene-related peptide,CGRP)是一種廣泛表達的神經肽,屬于降鈣素家族,在不同器官中表達差異較大[4-5]。CGRP受體成分蛋白(CGRP receptor component protein,CRCP)與降鈣素受體樣受體和受體活性修飾蛋白-1共同組成CGRP受體,并參與調控體內多種信號轉導過程[6]。此外,CRCP還被稱為DNA指導的RNA聚合酶Ⅲ亞基RPC9,在RNA轉錄過程中發揮重要作用。目前,CRCP在腫瘤發生發展過程中的功能尚無研究報道。本研究旨在觀察CRCP分子在肝癌和癌旁組織中的表達水平,并分析其與肝癌患者預后和臨床病理數據的關系。
1 資料與方法
1.1 研究對象 收集2003年6月—2009年9月在海軍軍醫大學附屬東方肝膽外科醫院行手術切除治療的肝癌患者的肝癌組織及相應癌旁組織標本79例,記錄其臨床病理數據(如病理分級、腫瘤大小、是否伴有門靜脈癌栓等)并進行術后隨訪,記錄患者腫瘤復發、死亡時間,末次隨訪時間為2012年3月。
1.2 CRCP分子檢測 免疫組化染色所用CRCP單克隆抗體購自Abcam公司。石蠟切片60 ℃烘烤1 h,二甲苯、乙醇脫蠟,室溫下于3% H2O2甲醇液中放置20 min,雙蒸水洗滌5 min×3次。酸性修復液煮沸,進行抗原修復15 min,自然冷卻至室溫,雙蒸水洗滌5 min×2次,PBS洗滌1次,5 min。均勻滴加1%BSA的封閉液,使其完整覆蓋整塊切片, 37 ℃孵育30 min。吸棄封閉液,滴加一抗(1∶200稀釋),4 ℃孵育過夜。第2天,取出切片,室溫復溫15 min,PBS洗滌4次,每次5 min,二抗孵育30 min,PBS洗滌5 min×4次。滴加DAB顯色液顯色,至切片出現明顯棕色即終止,雙蒸水洗滌5 min×2次,蘇木素復染10 min后用1%鹽酸分化1~2次,自來水流水沖洗20~30 min,洗去多余蘇木素,雙蒸水洗滌5 min×2次。二甲苯、乙醇脫水,滴加適量中性樹脂,蓋上干凈蓋玻片,徹底干燥后觀察染色情況并掃片分析。
1.3 免疫組化芯片評分方法 免疫組化芯片利用ImageScope(Aperio公司)軟件進行掃描,掃描后利用該軟件的Algorithms(Positive Pixel Count)程序對每個組織點進行“陽性Pixel”分析計算,選擇Positivity數據(Positivity=Positive例數/Total例數)作為分析對象。
1.4 Western Blot檢測 取約3 mm×3 mm大小的肝癌與癌旁組織樣本,加入M-PER裂解液研磨(70 Hz,180 s),冰上裂解10 min后,于4 ℃,12 000 r/min離心10 min。BCA法測定蛋白濃度,加入6×上樣緩沖液,煮沸變性。通過10%聚丙烯酰胺凝膠電泳分離蛋白,利用電轉儀將蛋白轉移至硝酸纖維素膜上(100 V,60 min),使用含5%脫脂奶粉的TBST溶液封閉1 h,于TBST稀釋的一抗(購自Abcam)中4 ℃孵育過夜。次日,回收一抗,TBST洗滌3次,每次10 min,加入HRP標記的兔二抗,室溫孵育1 h,TBST洗滌3次后,使用ECL化學發光顯色底物法檢測蛋白條帶。
1.5 統計學方法 采用SPSS 21.0軟件進行統計學分析。計數資料兩組間比較采用χ2檢驗。采用受試者工作特性曲線(ROC曲線)分析獲得曲線下面積(AUC),評估擬合優度確定其預測效能,計算Youden指數確定最佳截斷值,利用Kaplan-Meier生存分析法分析CRCP表達與肝癌復發和預后的關系,兩組間比較采用log-rank檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 79例肝癌患者中,男67例,女12例,年齡10~72歲;病理分級4級1例,3級61例,2級17例;20例合并門靜脈癌栓;巴塞羅那分期0期5例,A期55例,B期11例,C期8例。
2.2 CRCP分子在肝癌中的表達情況 Western Blot檢測6例患者肝癌及癌旁組織中CRCP表達水平,結果顯示,4例患者肝癌組織中CRCP表達水平低于癌旁組織(圖1)。利用免疫組化法檢測79例患者肝癌及癌旁組織中CRCP的表達水平及定位情況,60例(75.9%)的患者肝癌組織中CRCP表達水平明顯低于癌旁組織(圖2)。
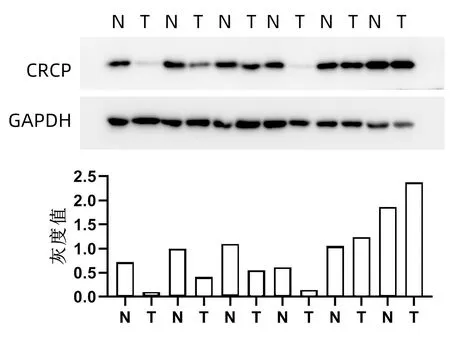
注:N,癌旁組織;T,腫瘤組織。

注:a,2例肝癌患者癌組織及癌旁組織中的CRCP表達情況(×12.8),CRCP在胞漿與胞核中均有表達,與癌組織相比,癌旁組織染色更深,提示癌旁組織中CRCP表達量更高。b,79例肝癌患者CRCP的相對表達,每位患者癌組織與癌旁組織的免疫組化評分(Positivity,簡稱P)相除后取log值[即log(P癌組織/P癌旁組織)]并作圖,其中60例(75.9%)患者的癌組織CRCP表達量低于癌旁組織即為低表達部分,19例(24.1%)癌組織CRCP表達量高于癌旁組織即為高表達部分。
2.3 CRCP分子表達與肝癌預后的關系 使用ImageScope軟件對79例患者的免疫組化芯片染色結果進行定量分析,利用SPSS 21.0軟件將患者癌組織中CRCP表達量對預后(生存和復發)的影響進行ROC曲線分析,評估生存和復發的AUC分別為0.770、0.644, 計算約登指數確定CRCP最佳截斷值(生存:0.425,復發:0.245),依據最佳截斷值將CRCP表達分為低表達組和高表達組。采用Kaplan-Meier 生存分析法分析CRCP表達與肝癌患者生存、復發的關系,結果顯示,與CRCP低表達組相比,CRCP高表達組患者的總體生存期更長,復發率更低(P值分別為<0.001、0.009)(圖3)。
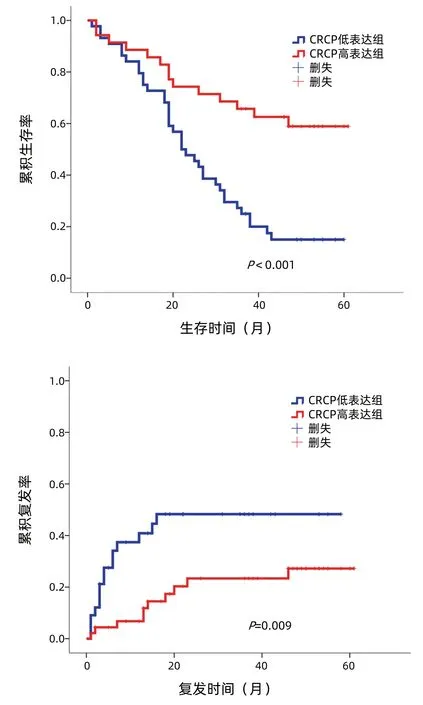
圖3 肝癌組織中CRCP表達水平與患者預后的關系
2.4 CRCP表達水平與肝癌臨床病理特征的關系 以上述癌組織中CRCP表達量對生存的影響進行ROC曲線分析,根據最佳截斷值(0.425)將CRCP表達分為低表達組和高表達組。 CRCP低表達組CK19陽性、腫瘤包膜不完整、合并門靜脈癌栓和腫瘤病理分級高的患者所占比例更高(χ2值分別為6.410、4.829、9.319、9.083,P值均<0.05),提示CRCP低表達的肝癌患者的惡性程度更高(表1)。
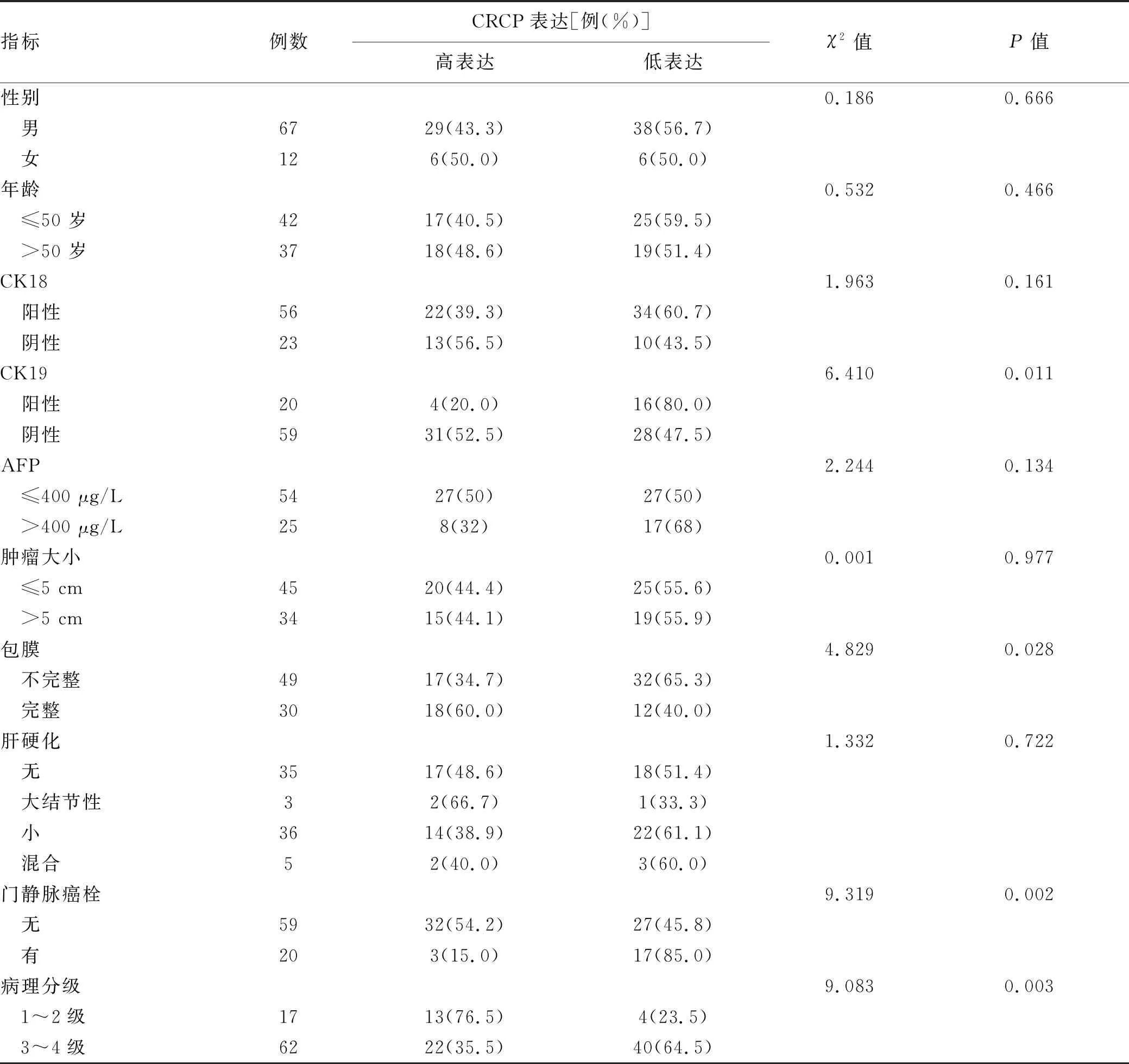
表1 CRCP分子表達與肝癌患者臨床病理特征的關系
3 討論
惡性腫瘤是全球第二大病死原因,僅次于心血管疾病。腫瘤的發生發展是一個長期的多因素共同影響的過程[7]。隨著醫療技術的不斷提高,部分腫瘤的診療手段也愈發精準、有效,但仍有很多肝癌患者因確診較晚、腫瘤發生轉移且暫無有效的治療方法等原因死亡[8]。外科治療是肝癌患者獲得根治和長期生存的最主要途徑[9],但肝癌術后復發和轉移率高,尤其復發率高達70%[10]。因此,探索更多肝癌轉移的治療靶點和預測轉移的分子標志物意義重大。
CRCP在細胞內通過參與降鈣素受體成分蛋白和RNA聚合酶Ⅲ的形成,在CGRP信號轉導和RNA合成中發揮關鍵作用。CGRP是由37個氨基酸殘基組成的神經肽,由中樞和外周神經系統分泌[11],在心血管系統和心臟所有部位均能夠被檢測到[12],是最有效的血管舒張藥之一[13-14]。CGRP還參與體內多種重要生理功能,例如強心作用和代謝、促炎等過程[15]。CRCP由148個氨基酸殘基組成[16],作為CGRP受體的輔助蛋白存在,能夠耦聯CGRP受體參與下游信號轉導通路[16]。研究[17]發現,CRCP的表達受炎癥、神經性疼痛的影響。此外,有研究[18]發現,在斑馬魚中,CRCP通過調節P53信號調節造血干/祖細胞維持。但CRCP是否參與調控腫瘤發生發展過程尚不明確。
本研究結果顯示,CRCP在肝癌組織中的表達顯著低于癌旁組織。目前,關于CRCP表達的調控機制相關報道極少。Gao等[19]研究發現,在胰腺導管癌中,CGRP啟動子甲基化修飾導致CGRP表達下調。劉彥梅等[20]研究發現,在血管平滑肌細胞中,CGRP可調控CRCP的表達。筆者團隊推測,CRCP在肝癌中低表達機制可能與上述研究類似:CGRP高甲基化導致CGRP表達降低,最終引起CRCP表達減少。此外,微小RNA(miRNA)可通過降解靶基因mRNA或抑制靶基因mRNA翻譯,下調靶基因蛋白表達水平[21]。筆者團隊猜測,肝癌中CRCP分子低表達可能與相關miRNA表達上調有關。Lou等[22]研究發現miR-494-3p、miR-1207-5p和miR-1225-5p等在肝癌患者轉移腫瘤組織中表達高于原位腫瘤組織,過表達miR-494-3p可促進肝癌細胞的遷移和侵襲能力。筆者團隊進一步通過TargetScan 7.0數據庫查詢發現,miR-494-3p 、miR-1207-5p和miR-1225-5p可直接結合CRCP mRNA的3′UTR區域,據此猜測肝癌患者腫瘤組織可能通過上調上述miRNA,進而下調CRCP的蛋白表達水平。
預后分析顯示,CRCP低表達的肝癌患者生存期更短,復發率更高,預后更差。同時,CRCP低表達與CK19陽性、腫瘤包膜不完整、伴有門靜脈癌栓及更高的病理分級呈正相關。有研究[23]發現,CK19和GPC3聯合可作為肝癌轉移的參考分子,CK19+/GPC3+肝癌患者發生肝內轉移、微脈管入侵、局部淋巴結入侵和遠距離轉移的風險更高;也有研究[24-27]顯示,原發性肝癌中CK19高表達與預后差相關,CK19是原發性肝癌發生淋巴結轉移的有效風險因子。有研究[28]報道,血清CK19水平高提示癌細胞低分化,惡性程度高,轉移能力高。本研究的CK19陽性患者中,CRCP低表達患者占比(80%)遠高于高表達患者(20%)。腫瘤包膜破損及門靜脈癌栓的形成也是影響肝癌患者預后的重要因素。有研究[29]發現,與有腫瘤包膜的肝癌相比,無腫瘤包膜的肝癌血管侵犯的比例更高、分化程度更差。本研究結果顯示,腫瘤外無包膜或包膜不完整的患者腫瘤組織中CRCP低表達更多。此外,合并門靜脈癌栓的患者中,CRCP低表達患者占比遠高于高表達患者,且腫瘤病理分級越高的患者,其CRCP低表達患者所占比例越高。據此,筆者團隊提出假設:CRCP低表達患者的腫瘤可能更易發生轉移,惡性程度更高。
綜上所述,肝癌組織中CRCP低表達的患者預后更差,CRCP可能參與肝癌的發生發展與轉移過程,該分子或可作為肝癌患者預后判定的生物標志物。但由于肝癌具有高度異質性,且本研究樣本量較小,為獲得更準確、詳實的研究數據和結論,還需擴大樣本數量開展進一步探究。
倫理學聲明:本研究于2020年6月15日經由海軍軍醫大學附屬東方肝膽外科醫院醫學研究倫理委員會批準,所納入患者均簽署知情同意書。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:孫冠群和周思蕾負責文章撰寫及相關實驗數據的獲取;曾榃倫、劉君宇負責數據分析;梁喜俊負責文章撰寫、修改指導;程卓負責關鍵性實驗設計、文章撰寫、修改指導及審定。

