胰高血糖素樣肽1系統與非酒精性脂肪性肝病防治的關系
崔泓亮, 徐 立, 魯 彤
陜西中醫藥大學 a.醫學技術學院, b.醫學科研實驗中心, 陜西 咸陽 712046
非酒精性脂肪性肝病(NAFLD)是當今社會常見的代謝綜合征之一,現已成為嚴重影響全球成人甚至兒童健康最普遍的慢性肝病。全球NAFLD的綜合患病率為25.24%,其中南美和中東的患病率最高,非洲患病率最低[1],而我國有29.2%的人口正遭受NAFLD的折磨[2]。NAFLD發病初期并無典型癥狀,如不加以控制使得病情持續惡化,最終發展為肝硬化并導致肝衰竭[3],極大增加了肝病的致死率。目前尚無針對NAFLD的特異性藥物,治療NAFLD的方法主要以改變生活方式和調整飲食結構為主[4],對NAFLD癥狀的改善效果十分有限。近年來有研究[5]發現胰高血糖素樣肽1(glucagon-like peptide-1, GLP-1)能通過不同的作用機制來改善肝臟脂肪變性,并有減弱肝細胞氧化應激和肝纖維化的作用。本文通過介紹GLP-1的產生、分解、效應系統和NAFLD的作用關系,總結其防治NAFLD的機制,為深入研究GLP-1系統中的因子作為治療NAFLD的靶標提供理論參考。
1 GLP-1系統
1.1 GLP-1的產生與分泌 GLP-1是一種含有31個氨基酸的胃腸道肽類激素,主要由腸道L細胞產生和分泌,并且L細胞的密度從十二指腸到結腸逐漸增加。腸道L細胞內的胰高血糖素原基因翻譯后,經前蛋白轉化酶枯草溶菌素1或3加工產生甘氨酸延伸型GLP-1和酰胺化型GLP-1兩種GLP-1的生物活性形式[6]。GLP-1的分泌受營養、神經和內分泌因子的刺激,富含脂肪、蛋白質和碳水化合物食物的攝入是促GLP-1分泌的主要生理刺激因素[7]。
1.2 GLP-1的分解 GLP-1分泌后大多數會被細胞中廣泛存在的二肽基肽酶-4(DPP-4)迅速降解。DPP-4又被稱為CD26,是一種絲氨酸氨基肽酶,既能以膜結合的形式存在,也能以游離形式存在于血液中[8],在腎臟、肝臟、胰腺、血管、腸道和大腦等器官中均有表達[9]。餐后的GLP-1在分泌后通過血液循環或者局部彌散的方式作用于靶細胞。然而,由于DPP-4的降解作用,能到達肝門靜脈的活性GLP-1不足25%,血漿中循環的GLP-1大多是降解后的GLP-1[10]。
1.3 GLP-1受體及其效應 GLP-1通過與其靶細胞上的受體(GLP-1R)結合而發揮生物學作用,GLP-1R大量存在于腸道、中樞神經系統、胰島α和β細胞中,在肺、心臟、腎臟、血管和外周神經系統也有GLP-1R的表達[11]。GLP-1R是由463個氨基酸構成的G蛋白偶聯受體,有7個跨膜螺旋,具有一個C端細胞內結構域和一個N端細胞外結構域[12]。GLP-1通過其α螺旋和C-末端序列與GLP-1R的N端細胞外結構域結合,然后通過GLP-1的N端殘基與受體的跨膜螺旋和胞外環結合[13]。當GLP-1與細胞表面的受體結合后,GLP-1R通過激活G蛋白并產生環磷酸腺苷(cAMP)[13]將細胞外信號轉導到細胞內部。GLP-1R至少可以與4種不同形式的內源性和外源性GLP-1類似物結合,是開發治療NAFLD藥物的重要靶點。
2 GLP-1系統與NAFLD的防治
2.1 GLP-1對NAFLD的防治 GLP-1可以增加肝細胞對胰島素的敏感性,并通過氧化作用增強脂質的代謝,減少脂肪酸流入肝細胞[14],抑制了NAFLD的形成和發展。同時,GLP-1能提高肝細胞中cAMP的水平,進而促進腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化,通過刺激脂肪酸氧化來逆轉肝臟脂肪變性[15]。GLP-1在改善肝臟脂肪變性的同時也可以減弱肝內炎癥反應,GLP-1通過線粒體的自噬作用抑制NOD樣受體蛋白3炎癥小體誘導的肝細胞凋亡,從而抑制單純性脂肪肝向非酒精性脂肪性肝炎(NASH)的轉變,阻止NAFLD的惡化[16]。
2.2 DPP-4與NAFLD的防治
GLP-1在腸道產生后會迅速被DPP-4分解從而失去生物學活性,因此控制DPP-4對GLP-1的降解速度就成為調節GLP-1效應時長的關鍵。DPP-4抑制劑可以使DPP-4失活,減緩對GLP-1的降解作用,從而提高內源性GLP-1的水平[17]。臨床研究[18]發現,DPP-4抑制劑替格列汀能降低NAFLD患者的體質量并改善NAFLD。除替格列汀之外,DPP-4抑制劑類藥物如西格列汀和利格列汀等,也能改善患者的脂質代謝和肝炎癥反應,但DPP-4抑制劑對NAFLD的防治機理尚未被闡明。
2.2.1 DPP-4抑制劑調節脂質代謝的機制 脂質代謝紊亂導致肝細胞內脂肪過度蓄積是形成NAFLD的前提,而固醇調節元件結合蛋白(sterol regulatory element binding proteins,SREBP)是調節肝細胞內脂質蓄積的重要因子,脂肪酸合酶(fatty acid synthase,FAS)是脂肪酸合成的關鍵酶。研究[19]表明,DPP-4抑制劑可減少肝臟中SREBP-1c的mRNA表達,進而降低硬脂酰CoA去飽和酶-1(stearoyl-CoA desaturase-1,SCD-1)和FAS等基因的表達,阻止了脂肪酸和甘油三脂(TG)的生成,緩解肝臟脂質代謝紊亂。動物實驗[20]證實,DPP-4抑制劑也可以通過激活由高脂飲食所抑制的AMPK/SIRT1(沉默信息調節因子)通路,下調其下游靶基因乙酰輔酶A羧化酶和肉毒堿-棕櫚酰轉移酶1的轉錄水平,降低游離脂肪酸的合成。最近的研究[21-22]發現,DPP-4抑制劑能通過調控圍脂滴蛋白2(perilipinin-2,PLIN2)的翻譯、蛋白穩定性或蛋白降解速率,抑制由脂毒性介導的內質網應激導致的肝細胞凋亡,進而減輕肝臟脂肪變性。
2.2.2 DPP-4抑制劑對肝臟炎癥和纖維化的防治機理 DPP-4抑制劑類藥物顯示出了對NASH治療的巨大潛力[23-24]。替格列汀可顯著抑制TGFβ1和單核細胞趨化蛋白1等促炎因子標志物mRNA的表達,減少TNF相關凋亡誘導配體受體2介導的細胞凋亡,起到保護肝細胞,減輕肝臟炎癥的作用[25]。動物實驗[26]證實,DPP-4抑制劑通過下調M1型巨噬細胞標志物和上調M2型巨噬細胞標志物mRNA的表達,減少肝臟中浸潤巨噬細胞的數量,顯著緩解了小鼠肝臟炎癥反應。
肝星狀細胞(HSC)活化會產生α-平滑肌肌動蛋白(α-SMA),α-SMA的過量表達會加重肝纖維化程度,是肝纖維化的標志物。TNFα、TGFβ和血小板源性生長因子(PDGF-BB)等細胞因子是活化HSC的關鍵因子,活化后的HSC合成過多的細胞外基質導致肝纖維化[27]。DPP-4抑制劑可通過減弱MAPK/ERK1/2/Smad2/3信號通路并抑制核因子-κB (NF-κB)的核轉位,減少細胞外基質的過多堆積以及肝內結締組織的產生,與此同時下調促纖維化因子TNFα、TGFβ和PDGF-BB,并降低了纖維化標志物α-SMA表達,進而緩解了肝纖維化[28]。
2.3 GLP-1受體與NAFLD的治療
由于GLP-1受體激動劑(GLP-1RA)既保有GLP-1的生物學效應又能抵抗DPP-4的降解,所以在NAFLD藥物的開發中備受青睞。臨床研究[29-30]已經提供了大量GLP-1RA改善肝臟脂質代謝,緩解NASH和肝纖維化作用的證據。目前,已上市的GLP-1RA類藥物中被證實對于治療NAFLD有作用的包括艾塞那肽、利拉魯肽、杜拉魯肽、利西拉肽和索馬魯肽[31]。
2.3.1 GLP-1RA與脂質代謝 首先,GLP-1RA可以通過多種信號通路直接或間接調節脂肪的合成與分解。GLP-1RA改善脂質代謝的機制可能與過氧化物酶體增殖物激活受體(PPAR)α的激活有關,PPARα活化后抑制叉頭狀轉錄因子O1蛋白的磷酸化,降低了載脂蛋白CⅢ的合成和分泌,增強脂蛋白脂肪酶對TG的水解[32]。GLP-1RA還可通過增加PLIN和激素敏感性脂肪酶(HSL)的磷酸化來加速分解脂肪分子,當PLIN被磷酸化時,HSL可以進入脂滴內加速脂肪降解[33]。SIRT1是肝臟調節脂質代謝穩態的關鍵因子,GLP-1RA可以下調microRNA-124a水平,使甘油三酯脂肪酶和SIRT1的表達升高[34],水解TG,降低肝臟中脂肪的合成量。除此之外,GLP-1RA還能誘導轉錄因子EB核易位并增加其下游靶蛋白組織蛋白酶B和溶酶體相關膜蛋白1的表達來激活溶酶體自噬,清除肝細胞內的脂滴,減輕肝脂肪變性[35]。
其次,GLP-1RA可以通過減少氧化應激和抑制肝細胞的凋亡來抑制肝脂肪變性。血管緊張素(angiotensin,Ang)Ⅱ可以激活由氧化應激介導的線粒體功能障礙誘發NAFLD。GLP-1RA能激活Ang1~7并通過其受體拮抗由AngⅡ介導的線粒體障礙,促進脂肪酸代謝,抑制肝細胞脂肪變性[36]。動物實驗研究[14]發現GLP-1RA通過3-磷脂酰肌醇激酶激活蛋白激酶B(p-Akt),隨后p-Akt通過抑制脂肪酸氧化基因的表達,促進肝細胞再生,抑制了NAFLD的發展。
2.3.2 GLP-1RA與肝臟炎癥和肝纖維化 GLP-1RA類藥物對NASH的抑制作用在臨床試驗中得到了證明,NAFLD合并糖尿病的患者在服用GLP-1RA類藥物后血清中GGT和AST水平顯著降低[37-38],索馬魯肽還能顯著降低肥胖導致NAFLD患者血清ALT和超敏C-反應蛋白的水平,改善肝臟炎癥反應[39-40]。動物研究[41]證實,GLP-1RA在降低大鼠血清中丙二醛、AST和ALT水平的同時有效降低了肝臟中Toll樣受體4和NF-κB的水平,提示GLP-1RA通過抑制Toll樣受體4/NF-κB信號通路改善NAFLD誘導的肝臟炎癥反應。GLP-1RA通過上調IκB(NF-κB抑制蛋白)家族mRNA的表達并抑制NF-κB從細胞質到細胞核的易位,減少TNFα、IL-1β和IL-6等促炎因子的釋放,逆轉由炎癥造成的肝細胞損傷[42]。進一步研究[43]發現,GLP-1RA通過抑制NOD樣受體蛋白3炎癥小體的激活,增強細胞自噬/線粒體自噬,使IL-1β水平降低,減輕氧化應激損傷,延緩肝臟炎癥的進展。
臨床研究[44]發現,GLP-1RA類藥物在降低促炎細胞因子水平的同時還伴隨著NAFLD患者體內肝纖維化標志物水平的降低。GLP-1RA能促進參與細胞凋亡的主要因子c-Jun氨基末端激酶(JNK)的磷酸化,激活JNK信號通路,通過抑制ERK磷酸化來阻斷ERK信號通路,進而促進活化的HSC凋亡[45],阻止肝纖維化的發生和發展。還有研究[46]發現,GLP-1RA通過上調由Sestrin2介導的Nrf2/HO-1通路中相關因子的mRNA水平,降低丙二醛和TNFα含量,改善NAFLD導致的肝纖維化。此外,GLP-1RA還可以通過癌胚抗原相關細胞黏附分子1依賴途徑,有效抑制小鼠在飲食誘導下TGFβ-Smad2/Smad3促纖維化途徑的激活,抑制肝纖維化的進一步發展[47]。
綜上所述,GLP-1系統能通過調節脂肪合成通路上相關基因及蛋白的表達減少肝臟脂肪堆積,減輕肝組織的脂肪變性,從而改善NAFLD癥狀。與此同時,GLP-1系統作用于多種信號通路降低肝臟中的炎癥反應并抑制HSC的活化,阻止NAFLD向NASH和肝纖維化發展(圖1)。
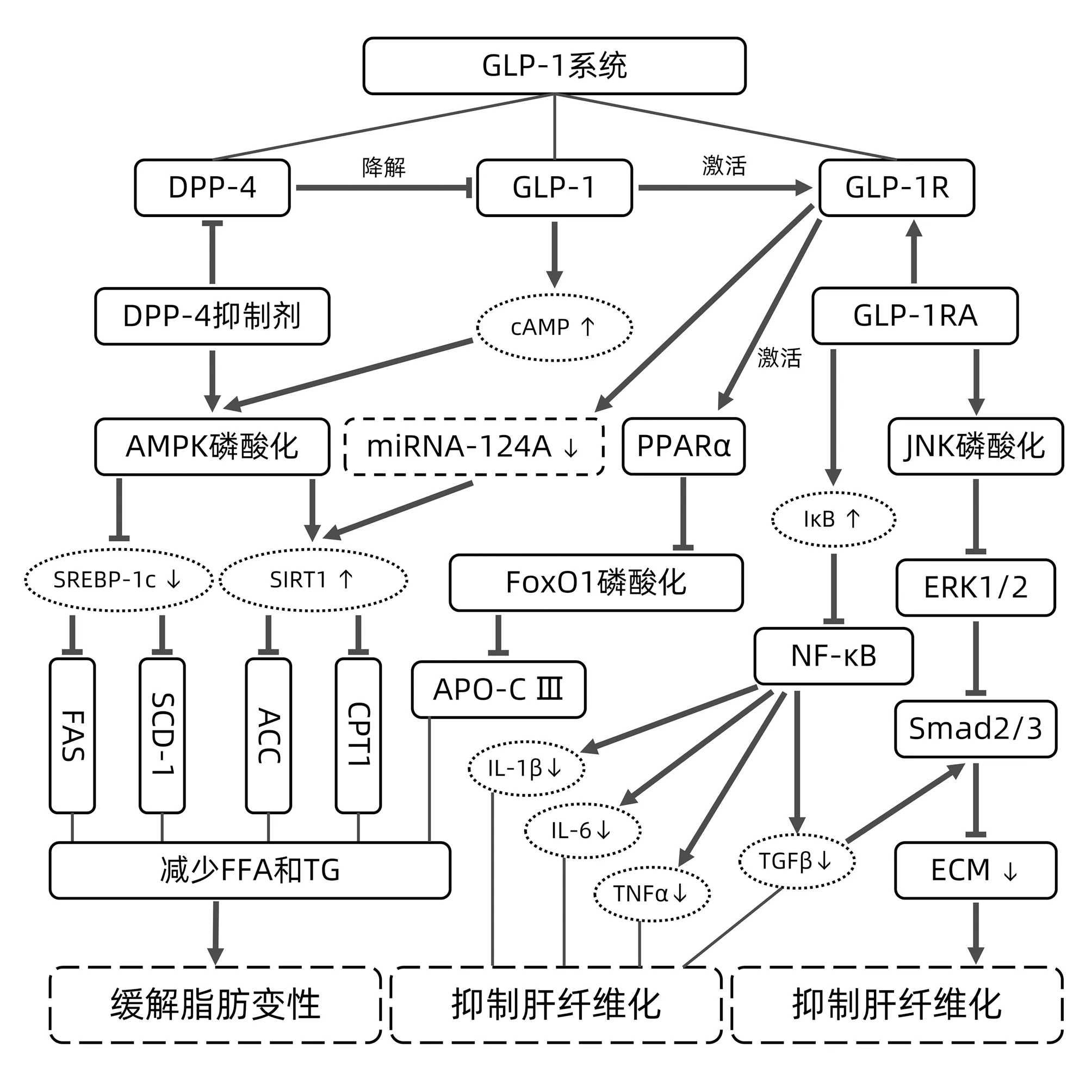
注:ACC,乙酰輔酶A羧化酶;CPT1,肉毒堿-棕櫚酰轉移酶1;APO-CⅢ,載脂蛋白CⅢ;ECM,細胞外基質;FoxO1,叉頭狀轉錄因子O1;FFA,游離脂肪酸。
3 GLP-1系統治療NAFLD的問題與展望
首先,由于GLP-1在體內的降解速度極快,大部分GLP-1在到達目標組織前就已失去活性,導致體內能發揮生物學作用的GLP-1只占其總量的少部分。最近有證據表明,GLP-1(9-36)和GLP-1(9-37)等GLP-1的非活性形式對肝臟有類似胰島素的作用。GLP-1的“非活性形式”實際上并非無活性,而是通過與不同于GLP-1R的其他細胞表面受體結合,以一種新的信號通路發揮作用[48]。今后的研究應關注其他活性形式GLP-1的發現及其與靶點的相互作用,通過研究不同形式GLP-1對細胞的作用機理,為利用GLP-1系統治療NAFLD提供更多的可能。
其次,目前對肝細胞中是否表達GLP-1R存在一定的爭議,雖然一些研究稱已經在肝細胞中發現了對胰島素敏感性有影響的GLP-1R,但也有研究的結論是肝臟中沒有GLP-1R的表達[49]。有研究[50]表明,GLP -1R在肝門附近的門靜脈壁上表達,由于GLP-1在肝門靜脈循環中被釋放,所以GLP -1R可能定位于門靜脈神經末梢。盡管從未在肝臟中發現GLP-1R大量表達的現象,但是與其同源的胰高血糖素受體在人肝細胞中大量表達,胰高血糖素受體可能會介導GLP-1在肝臟中的效應,肝臟中也可能存在潛在的GLP-1替代受體[51]。關于GLP-1R在肝臟中是否表達的問題仍需大量的實驗研究來證實,這樣才能為深入研究GLP-1R激動劑作為治療NAFLD的藥物提供確切靶點。GLP-1替代受體和GLP-1之間的作用關系是闡明GLP-1系統對NAFLD調節作用的一個全新的研究方向,可能為開發治療NAFLD藥物提供全新的思路。
最后,近年來發現的對防治NAFLD有效的藥物以往大都用于治療其他代謝類疾病,至今沒有專門用于治療NAFLD的靶向藥物。GLP-1RA因具有良好的安全性而有望成為治療NAFLD的潛在藥物,但是也會導致如惡心和腹瀉等副作用。同時,對于GLP-1RA治療NAFLD的臨床研究大多是小樣本,且觀測人群大多為2型糖尿病合并NAFLD的患者[52],現在急需挑選潛在藥物針對NAFLD患者進行更大規模的長期、隨機、對照試驗,提供更準確的研究數據,加快NAFLD藥物的研發。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:魯彤收集文獻,撰寫初稿;崔泓亮收集文獻,撰寫并修改論文;徐立負責課題設計,資料分析,擬定寫作思路,指導撰寫和修改文章并最后定稿。

