血小板在肝細胞癌發生發展中的作用
于 瀟, 武國兵, 張愛斌, 程曉龍, 劉 敏,胡澤楠, 鄭 亞, 王玉平, 陳兆峰
1 蘭州大學 第一臨床醫學院, 蘭州 730000; 2 蘭州大學第一醫院 消化科, 甘肅省胃腸病重點實驗室, 蘭州 730000
肝細胞癌(HCC)是指起源于肝細胞的惡性腫瘤,已經成為全世界癌癥相關死亡的第三大原因[1]。近年研究[2]表明,血小板在肝再生及肝纖維化、HCC的進展中發揮著重要的作用。血小板不僅參與止血,活化的血小板還能產生細胞因子以及通過復雜的信號通路與肝細胞及腫瘤微環境相互作用,促進腫瘤的發生與進展。研究發現,抗血小板治療能減弱肝臟的炎癥并改善HCC患者的預后[3],阿司匹林等抗血小板藥物也具有抗癌活性,能通過抑制血小板相關通路延緩腫瘤的進展[4],此外,針對血小板與腫瘤微環境相關通路的靶向治療對HCC的防治具有潛在的臨床意義。
1 血小板與HCC的關系
近年越來越多的研究[5]證據表明,血小板在HCC發生發展中扮演著重要的角色。HCC主要發生在慢性炎癥和肝臟慢性損傷的情況下,血小板及其衍生物與肝臟微環境相互作用促進HCC的發生發展。當肝臟發生器官損傷或炎癥等病理改變時,血小板聚集在肝臟中并被激活,釋放大量細胞因子并與肝臟微環境相互作用,通過增強炎癥反應、免疫抑制、免疫逃逸、誘導新生血管的形成等方式刺激癌細胞的增殖及轉移。另一方面,癌細胞也能募集和激活血小板,幫助其增殖和轉移[5](圖1)。
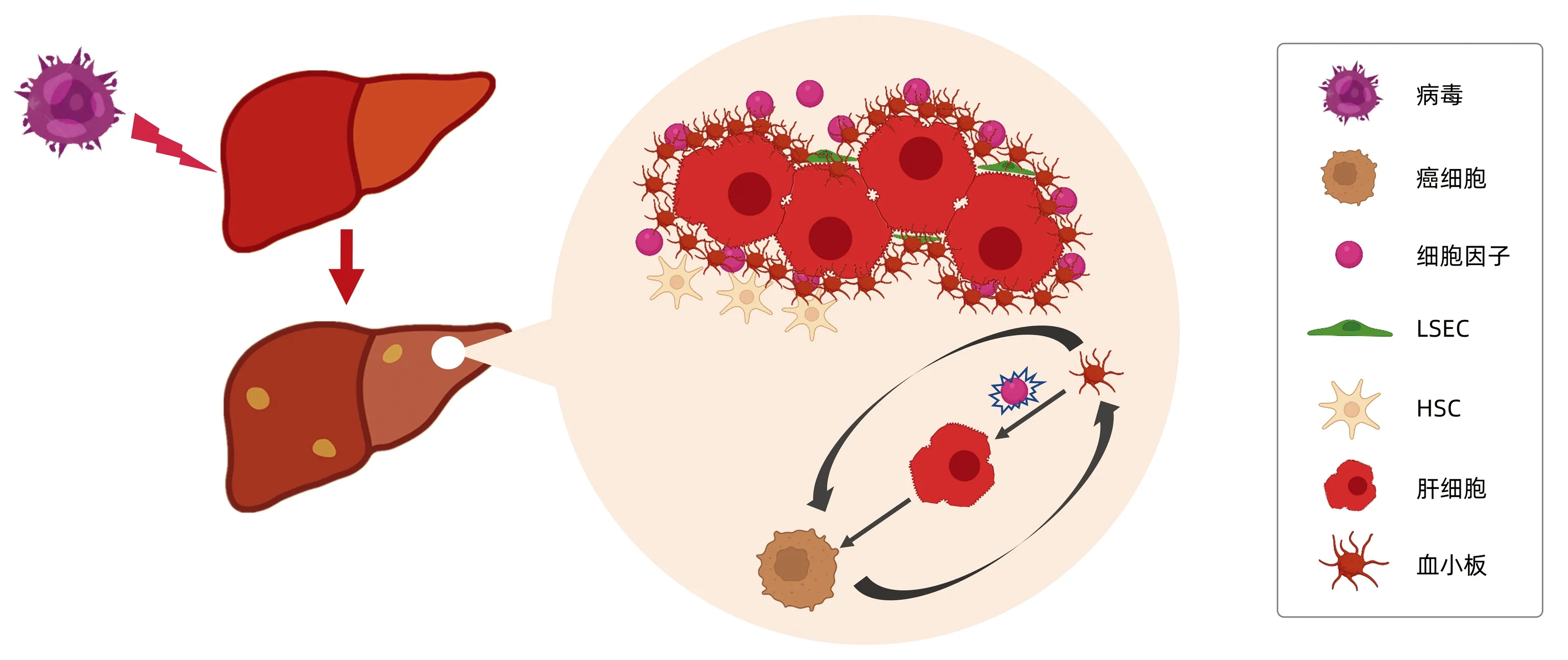
注:LSEC,肝竇內皮細胞;HSC,肝星狀細胞。
2 血小板促進HCC發生發展的可能機制
2.1 血小板作用于腫瘤微環境中的多種細胞成分促進腫瘤進展 腫瘤微環境由周圍血管、細胞外基質、成纖維細胞、淋巴細胞、信號分子、免疫細胞和炎癥細胞等組成,它是腫瘤生存的細胞環境。腫瘤微環境中的各種細胞通過釋放細胞因子、促進腫瘤血管生成、誘導免疫耐受等方式加速腫瘤微環境的形成。同時,腫瘤微環境能夠影響癌細胞的生長和分化[6]。血小板及其分泌的細胞因子與腫瘤微環境中的各種成分相互作用,促進腫瘤的進展(圖2)。

注:TAF,腫瘤相關成纖維細胞。
血小板與LSEC相互作用促進HCC的進展。在生理條件下,LSEC調節肝臟血管張力并維持HSC靜止,從而抑制肝內血管收縮和纖維化。血小板能夠分泌多種生長因子如肝細胞生長因子(HGF)及IL-6,刺激肝細胞及LSEC再生。在肝損傷的早期階段,血小板被招募至肝臟并且黏附于LSEC上并被活化,活化的血小板導致LSEC窗孔消失并發生 “毛細血管化”, 失去其生理作用,促進血管生成和血管收縮,導致HCC的進展。在免疫調節方面,LSEC通過上調胞間黏附分子1(ICAM-1)和血管黏附蛋白1(VAP-1)的表達導致白細胞跨膜遷移,并誘導T淋巴細胞分化,降低其毒性,從而增加肝細胞的炎癥反應。現有的臨床證據和基礎研究[7-9]均證實血小板及其衍生物可促進肝再生,而肝再生的異常可導致肝纖維化和HCC的發生。血小板與腫瘤微環境相互作用,成為HCC進展的積極參與者。然而,肝纖維化及HCC患者血小板功能的改變目前仍是一個爭議點,需要更多的研究來解決此爭議。
血小板和HSC及肝臟Kupffer細胞相互作用促進HCC的發生。腫瘤相關巨噬細胞能夠分泌IL-6并通過STAT3信號通路促進腫瘤細胞增殖[10]。近年研究[11]發現,血小板能夠產生直接影響HSC活化的細胞因子和趨化因子,包括血小板源性生長因子(platelet-derived growth factor, PDGF)、TGFβ、TNF、IL-1β、單核細胞趨化因子1等,并通過NF-κB等通路影響HSC的活化。當各種因素造成肝損傷時,HSC在這些細胞因子的刺激下被激活成可收縮的肌成纖維細胞,產生大量的細胞外基質,促進Ⅰ、Ⅲ型膠原的轉錄[12],導致纖維形成、收縮、基質降解和促炎信號傳導,最終使得細胞外基質重構和纖維化,進而導致HCC的進展。目前關于HSC活化的調節因子信號分子及相關調節通路的研究層出不窮,及時更新有關HSC活化的新靶點、新通路的信息對于臨床藥物的研發有重要意義。
血小板產生的外泌體是腫瘤微環境各成分間相互作用的關鍵載體。近年研究[13]表明,外泌體在腫瘤微環境中作為各類生長因子、細胞因子、酶類及遺傳物質的載體,廣泛參與了腫瘤細胞和腫瘤微環境間的雙向交流。研究[14]發現,血小板可釋放直徑40~100 nm的外泌體,其內容物包括各類胞質、胞膜蛋白和小分子RNA等。血小板產生的外泌體通過刺激巨噬細胞增加IL-6、IL-1β、IL-10、TNFα等細胞因子的分泌,激活STAT3通路,增加程序性死亡配體(programmed death ligand-1, PD-L1)蛋白表達,從而抑制免疫細胞的激活,導致免疫逃避進而促進HCC的進展[15]。外泌體還能誘導血管內皮生長因子(vascular endothelial growth factor, VEGF)的產生從而增加血管生成,以利于腫瘤細胞的遷移[16]。另有研究[17]發現,外泌體可通過TGFβ通路激活HSC,促進肝炎和肝纖維化的發生。此外,外泌體能夠將HSC轉化成TAF,促進腫瘤的進展[18]。由此可知,血小板主要通過外泌體的形式分泌多種細胞因子,與腫瘤微環境中的各種成分相互作用,誘導癌細胞免疫抑制,免疫逃避,并促進腫瘤新生血管的形成,最終導致HCC的進展。外泌體通過調節腫瘤微環境的耐受度來調節免疫反應和腫瘤抑制,說明其在治療HCC中具有作為藥物靶點和載體的潛在可能性,有望在未來為HCC的診斷及治療提供新的依據。
2.2 血小板通過促進腫瘤微環境中新生血管的生成促進HCC進展(圖3) 缺氧誘導的新生血管的形成是導致HCC進展及轉移的重要因素之一[19]。Chen等[20]研究發現,腫瘤的血管異常是導致腫瘤灌注受限、腫瘤微環境缺氧、免疫抑制的重要原因,用抗腫瘤藥物如厄洛替尼使腫瘤血管正常化,能夠增加免疫治療的療效。在腫瘤微環境中,血小板通過直接黏附于血管受損處或以外泌體的形式分泌5-羥色胺(5-HT)、血小板第四因子(PF-4)、TGFβ等顆粒內容物維持腫瘤血管內皮的完整,阻止腫瘤內出血,防止腫瘤組織的缺血壞死[21]。研究[22]顯示,在HCC患者中,VEGF和HGF的水平顯著升高,腫瘤組織能夠分泌VEGF激活鄰近血管內皮細胞上表達的血管內皮生長因子受體-2,并通過信號分子δ樣蛋白配體-4和血管生成素2等細胞因子的參與啟動腫瘤血管生成[23]。
炎癥反應及中性粒細胞的過度活化可刺激血管的生成,并通過分泌HGF-2刺激腫瘤的生長[24]。當炎癥導致內皮下膠原暴露時,血小板通過一系列信號通路被激活并釋放一系列細胞因子,其中包括P-選擇素,P-選擇素被激活后暴露在血小板表面,與內皮細胞表達的P-選擇素糖蛋白配體-1相結合,從而使血小板與內皮細胞相結合,與此同時分泌細胞因子如PF-4和血小板堿性蛋白,使得中性粒細胞趨化并黏附在內皮細胞表面以及單核細胞上,刺激血管的生成[25]。
血小板通過釋放PDGF促進HSC的活化,刺激新生血管的生成。研究[26]顯示,血小板產生的PDGFβ是HSC活化的主要驅動因素,并且是體內合成細胞外基質和肝硬化的關鍵啟動因子。在低氧條件下,PDGF可刺激HSC在腫瘤微環境中聚集和增殖,從而造成HSC VEGF-A表達增強,使得HCC組織中新生血管的形成,促進腫瘤的增殖和轉移[27]。綜合目前研究結果,可以得知血小板可分泌多種細胞因子通過復雜的信號通路促進新生血管的生成,血小板及其衍生物還能與中性粒細胞及HSC相互作用,共同促進腫瘤新生血管的生成促進腫瘤進展。
2.3 血小板活化后通過 “免疫逃逸”介導HCC進展及轉移 有相關研究[28]結果顯示,血小板分泌的TGFβ作為一種免疫抑制因子使得腫瘤微環境維持充分的免疫抑制狀態,如果用化療藥物如NO或紫杉醇特異性阻斷血小板與腫瘤細胞的相互作用,能夠抑制腫瘤上皮-間質轉化的過程,防止血小板黏附于腫瘤組織周圍,并抑制血小板和腫瘤組織分泌TGFβ,從而逆轉腫瘤微環境中免疫抑制狀態。由此可知,以保護癌細胞免受免疫系統攻擊的方式改變了微環境,是導致免疫治療藥物失敗的主要原因。因此,有效抑制TGFβ的成熟或功能將為癌癥治療開辟新的途徑。
血小板來源的主要組織相容性復合物I存在自身抗原,不會誘導免疫細胞對轉移腫瘤細胞的反應,而血小板來源的人類白細胞抗原A變異株-2(human leukocyte antigen-A*02, HLA-A*02)能夠從血小板轉移到腫瘤細胞表面,通過表達主要組織相容性復合物Ⅰ類分子介導腫瘤細胞的“免疫逃逸”,從而抑制自然殺傷細胞驅動的抗腫瘤免疫[29]。其次,血小板細胞膜上表達多種蛋白質,如P-選擇素、血小板糖蛋白等,這些蛋白質能使血小板與癌細胞凝聚在一起并形成轉移位點,使得癌細胞黏附于血管壁。被癌細胞激活的血小板釋放ATP,并通過Gq/GⅡ信號通路提高細胞內的鈣離子水平,再激活蛋白激酶C提高血管內皮屏障的通透性使得癌細胞透過血管壁在血管外遷移[30]。綜上可知,血小板表面的糖蛋白及其分泌的細胞因子能通過抑制免疫、增強趨化、提高血管內皮通透性等途徑促進癌細胞的遷移,促進HCC的進展。

圖3 血小板與腫瘤微環境相互作用促進HCC進展
3 抗血小板治療在HCC靶向治療方面的可能性
抑制血小板相關受體及通路可抑制腫瘤進展[3]。在腫瘤早期階段,血小板來源的RNA可以檢測包括HCC在內的多種癌細胞,因此血小板可以作為潛在的生物標志物來預測癌癥[31]。德國科學家研究[32]發現,血小板膜糖蛋白Ⅳ是腫瘤血管完整性的關鍵調節劑,抑制該靶點可增大腫瘤血管的通透性使其發生大出血,并且還可以提升腫瘤血管內的化療藥物濃度達到治療效果。因此基于對血小板功能的開發可作為抗腫瘤策略的基礎。哈佛大學某團隊研究[33]顯示,去除外部脂質膜和內部成分的血小板能夠完全阻止癌細胞侵入的過程,這表明血小板可以阻止新腫瘤的形成。此外,血小板糖蛋白Ⅰbα(glycoprotein Ib-α, GpⅠbα)抗體也是HCC治療的潛在靶點。GpⅠbα是HCC發生的一種介質,主要通過與Kupffer細胞的相互作用參與HCC的發生。小鼠實驗[34]發現GpⅠbα抗體治療HCC自發性出血率較低,抑制血小板GpⅠbα受體治療HCC的潛力值得關注。綜上可知,這些發現在分子和臨床水平均驗證了抗血小板治療抗腫瘤的可行性,開啟了腫瘤治療的新時代,同時抗血小板藥物也成為了治療腫瘤的重要手段,但其臨床有效性和安全性仍值得進一步探索和研究。在血小板作為標志物預測癌癥方面,由于血小板活化會影響分析結果,因此建立穩定的純化血小板方法有助于使得血小板成為可信的癌癥生物標志物。
腫瘤微環境已成為抗癌治療的重要靶點[35]。TAF作為主要靶點之一用于HCC的治療,可通過干擾促腫瘤信號抑制腫瘤的進展[36]。成纖維細胞活化蛋白作為TAF的特異性標志物,其介導的信號成纖維細胞活化蛋白-CCl2有可能成為腫瘤治療的靶點[37]。此外,在腫瘤生長過程中產生的細胞外基質分子的某些水解片段,也具有強大的信號特性,可作為治療靶點調節腫瘤的生長和轉移[38]。與此同時,使用抗VEGF分子靶向藥物改善腫瘤血管狀態和抗PD-1/PD-L1免疫抑制劑在理論上具有協同抗癌作用[39]。目前針對腫瘤微環境的靶向治療已取得了重大進展,但尚無改善臨床結局的治療方案,因此更好的結合基質耗竭和免疫調節機制研究多種靶向治療方法來延長癌癥患者生存期是非常有必要的。
LSEC衍生的“血管分泌因子”及HSC是HCC治療的潛在靶點。Winkler等[40]研究發現,LSEC GATA4的缺失會通過下調Wnt通路導致肝再生受損,并通過復雜的信號通路激活HSC,導致LSEC的 “血管化”。因此,可通過阻止血管分泌信號如PDGFB來控制肝纖維化和再生,以GATA4/MYC/PDGFB/PDGFRβ軸為靶點的治療為肝纖維化和HCC的預防提供了一種可能的策略。此外,LSEC毛細血管化是觸發HSC激活、肝纖維化和炎癥的早期病理事件[41]。骨形態發生蛋白(bone morphogenetic protein, BMP)9是一種由HSC產生的旁分泌因子[42],BMP9基因敲除小鼠中LSEC特異性轉錄因子GATA4表達下降,同時發生炎癥和纖維化,這表明BMP9可控制肝纖維化和HCC的進展[43]。BMP9基因缺失導致肝纖維化的相關模型可以測試創新抗纖維化及HCC的藥物[44]。然而,在人類肝硬化、HCC的肝臟中,BMP9表達降低[45],由此可知,BMP9在人類肝纖維化、HCC中的作用仍需要進一步研究。目前,大量的基礎實驗結果及分子理論均表明抗血小板也有抗癌的效果,在臨床上早期使用抗血小板藥物治療有可能阻止HCC的進展,然而現實中大多數由肝硬化導致的HCC患者出血風險較高,在保證抗血小板藥物抗癌作用的前提下如何避免出血風險,還需要更深入的研究來進一步探討。
4 小結
作為凝血反應的激活物,血小板不僅參與止血,還能分泌多種細胞因子通過復雜的信號通路與腫瘤微環境相互作用,通過免疫逃逸、免疫抑制、新生血管的形成促進HCC的進展。在治療方面,靶向治療目前已經成為HCC重要的治療手段。在分子水平及小鼠實驗中發現,與血小板相關的多個信號分子都可以作為HCC治療的靶點。在臨床上,血小板在HCC治療中的作用需要進一步研究及探討。此外,作為一種廉價、容易測得的指標,通過監測血小板計數預測肝癌患者的預后也具有很重要的臨床意義。因此,在未來靶向治療中,血小板的作用值得進一步研究和探討。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:于瀟、張愛斌、武國兵、程曉龍負責文獻查找、閱讀及文章撰寫;劉敏、胡澤楠、鄭亞、王玉平、陳兆峰負責文章修改。

