生防細菌MS82中GGDEF結構域基因對生物被膜形成及運動性的影響
陳先意 曲紹軒 駱昕 李輝平 林金盛 蔣寧 侯立娟 馬林 劉慧芹




摘要:為探究熒光假單胞菌MS82中GGDEF結構域基因對c-di-GMP調控細菌生物被膜形成及運動能力的影響,通過抑菌圈法、小試管法、96微孔板法以及運動性平板分別檢測GGDEF缺失突變體MT5092、MT0189、MT19和MS82野生型菌株之間的相關生命活動能力的差異。結果顯示,GGDEF缺失突變型菌株MT5092、MT0189、MT19的抑菌活性、生物被膜形成能力、運動能力(游泳運動、集群運動及抽搐運動)皆低于突變前的MS82野生型菌株,且突變株與野生株的抑菌活性存在極顯著差異(P<0.01);36 h的生物被膜形成能力存在極顯著差異;運動行為存在不一致的顯著(P<0.05)或極顯著差異。最終得出結論:缺失GGDEF結構域基因會降低胞內c-di-GMP濃度水平,進而影響MS82菌株的生物膜及運動行為。
關鍵詞:生防細菌MS82;GGDEF結構域基因;生物被膜;運動性
中圖分類號:S942.3;S182 文獻標志碼:A
文章編號:1002-1302(2022)11-0104-04
收稿日期:2021-09-09
基金項目:國家自然科學基金青年科學基金(編號:31901933);天津市科技計劃(編號:20YDTPJC01330);天津農學院研究生科研創新項目(編號:2020XY005);天津市高校中青年骨干創新人才培養計劃(編號:J01009030709)。
作者簡介:陳先意(1997—),女,上海人,碩士研究生,從事植物病理學研究。E-mail:1156561293@qq.com。
通信作者:劉慧芹,博士,教授,從事植物病害生防研究及生防菌劑研發,E-mail:wjxlhq@126.com;馬 林,博士,研究員,從事食用菌栽培和病蟲防控研究,E-mail:malin1590@sina.com。
環二鳥苷酸(c-di-GMP)是一種廣泛存在于細菌中的保守第二信使,作為關鍵因素調控著菌落形態、細胞周期、細胞分化、生物被膜的形成與擴散、鞭毛與菌毛介導的細胞運動行為、細胞毒力、抗性分泌等重要生命活動。大量試驗證明,假單胞菌屬菌株胞內c-di-GMP的濃度水平,受到DGCs(二鳥苷酸環化酶)的催化核心,同時也是DGCs與2分子GTP結合形成c-di-GMP的重要結合位點——GGDEF結構域的調控。對c-di-GMP調控生物膜的研究中發現,高濃度的c-di-GMP會促進胞外多糖產生和生物膜形成量的增加,同時抑制細菌運動行為;而低水平的c-di-GMP有利于鞭毛介導的細菌運動卻不利于生物被膜的形成。在探索熒光假單胞菌(Pseudomonas fluorescens)是否符合此結論時,選取的試驗對象 Pf0-1 菌株相關數據顯示,缺失了含有GGDEF結構域的RapA基因后,細胞內 c-di-GMP 水平降低并對生物膜形成具有抑制作用,卻沒有發現影響胞外多糖產生或鞭毛介導的運動性的證據。
MS82菌株是一株從土壤中發現的熒光假單胞菌,對引起食用菌菌種菌料污染、繼而引發寄生性病害的綠色木霉(Trichoderma viride)具有良好的抑菌作用。突變體MT19是通過隨機突變方式獲得的一株GGDEF結構域基因破壞菌株,并導致其抑菌活性完全喪失。然而,該基因的突變是否對生物被膜形成能力和運動性方面的具體調控造成影響尚不清楚。
為探索GGDEF結構域基因在MS82菌株中對 c-di-GMP 調控生物被膜及運動行為的影響,本研究對熒光假單胞菌MS82菌株中3個與c-di-GMP代謝相關的GGDEF結構域基因進行研究,檢測MS82野生株與3株不同GGDEF結構域突變株(MT5092、MT0189:基因重組菌株、MT19:隨機突變菌株)之間的抑菌活性、生物被膜形成量、運動行為等表型差異,進一步探究熒光假單胞菌中c-di-GMP調控生物被膜及運動性之間的關聯。
1 材料與方法
1.1 材料
1.1.1 菌株和供試菌株
生防菌:MS82野生型菌株(P. fluorescens),突變型菌株MT5092、MT0189、MT19;病原菌:綠色木霉。所有菌株均由江蘇省農業科學院蔬菜研究所提供。試驗于2020年10月至2021年8月在江蘇省農業科學院蔬菜研究所食用菌研究課題組研究室內開展。
1.1.2 相關培養基制備
LB培養基(1 L):10 g胰蛋白胨、5 g酵母提取物、10 g NaCl;
LB固體培養基(1 L):10 g胰蛋白胨、5 g酵母提取物、10 g NaCl、15 g瓊脂;
氨芐液體培養基:在LB培養基成分中加入0.1% 50 μg/mL 氨芐青霉素(Amp);
氨芐固體培養基:在LB固體培養基成分中加入0.1% 50 μg/mL Amp;
游泳運動(swimming motility)培養基:在LB培養基成分中加入0.3 %瓊脂粉;
集群運動(swaming motility)培養基:在LB培養基成分中加入0.7%瓊脂粉、0.5%葡萄糖;
抽搐運動(twitching motility)培養基:在LB培養基成分中加入3%瓊脂粉。
1.2 方法
1.2.1 菌液制備
MS82、MT5092、MT0189、MT19菌株在氨芐固體培養基上活化,28℃倒置培養 16 h。選擇單菌落重新劃線,28℃倒置培養16 h。將各菌株單菌落接入5 mL LB培養基中,28℃、220 r/min 振蕩培養16 h,4℃、4 000 r/min離心 3 min,棄上清,用無菌水將菌體重懸并稀釋至吸光度D=0.05,備用。
1.2.2 突變體抑菌能力測定
采用抑菌圈法測定:分別取10 μL制備好的菌液置于LB固體培養基中心,待菌液晾干后,用小噴壺噴適量用無菌水稀釋的綠色木霉孢子懸浮液(孢子濃度2億CFU/mL),28℃倒置培養2 d,測量各菌株抑菌圈直徑。
1.2.3 c-di-GMP相關基因生物膜形成測定
采用小試管法與96微孔板法測定c-di-GMP對生物膜形成的影響。
(1)小試管法:分別在含有 5 mL LB培養基的滅菌試管中加入5 μL各菌株菌液,28℃、100 r/min振蕩培養16 h后,靜置36 h。1%結晶紫染色后,觀察管內形成染色環狀物的顏色深淺。
(2)96微孔板法:96孔板中每孔加入100 μL的LB培養基及各菌株備用菌液10 μL,28℃靜置孵育,分別于12、24、36 h取出。1%結晶紫染色后,加入 100 μL 33%乙酸溶解30 min。以LB培養基為參比,用紫外分光光度計在熒光假單胞菌最大吸光波長590 nm處測定菌液吸光度D。
1.2.4 c-di-GMP相關基因運動能力測定
本研究運動能力檢測方法對謝杰鵬等的方法進行改進。
(1)游泳運動能力測定:各菌株分別取10.0、2.5 μL 菌液,接種在泳動培養基表面正中間,28℃培養 24 h 后,觀察以接種中心蔓延的云霧狀區域,測量該區域的直徑。
(2)集群運動能力測定:分別吸取10.0、2.5 μL 菌液接種在集群運動培養基表面中心,28℃恒溫培養 24 h 后,觀察以接種中心生長蔓延的區域,測量該區域的直徑。
(3)抽搐運動能力測定:用無菌牙簽蘸取各菌株菌液,接種在抽搐運動培養基底部,28℃恒溫培養 48 h 后,輕輕揭去培養基,用0.9%生理鹽水沖洗培養皿底部未黏附的細菌,1%結晶紫溶液染色后,觀察以細菌接種點為中心形成的區域,測量該區域的直徑。
1.2.5 統計學方法
每組處理設置3個重復,測量數據采用SPSS 17.0統軟件進行單因素方差分析計(ANOVA),采用LSD-Tamhane's T2 進行兩兩比較。數據結果用“平均數±標準差(x±s)”表示。
2 結果與分析
2.1 抑菌能力分析
抑菌圈法產生的透明抑菌圈直徑越大,則表明該菌株的抑菌活性越強,反之越弱。MS82野生型菌株和3個GGDEF結構域基因突變體菌株對綠色木霉的抑菌活性如圖1所示,可以看出,3個突變體菌株的抑菌活性均有不同程度的降低。其中MT19完全喪失抑菌能力,無抑菌圈產生;MT5092與M0189產生的抑菌圈均極顯著小于MS82野生型(P<0.01)。4個菌株的抑菌活性依次為MS82>MT0189>MT5092>MT19。
2.2 生物被膜形成能力差異分析
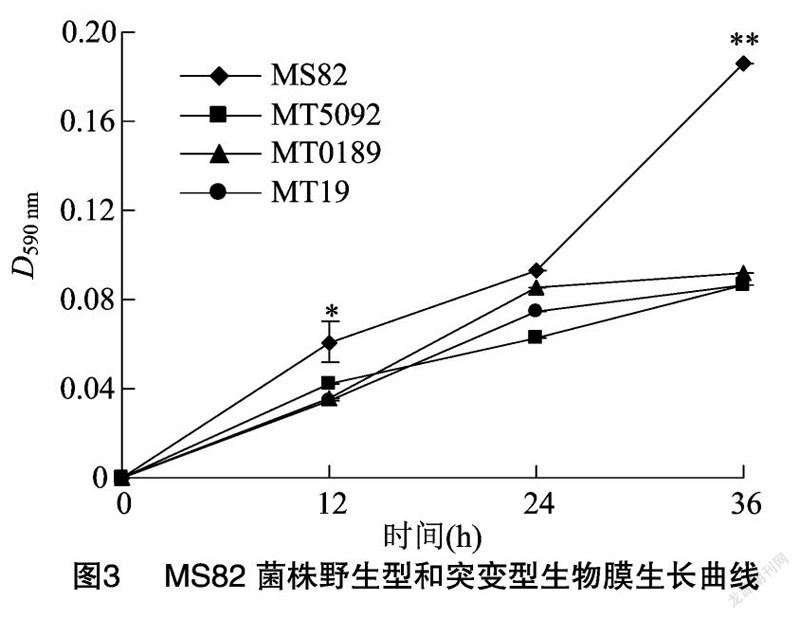
MS82菌株中3個含有GGDEF結構域的基因分別被突變后,生物被膜的形成能力表現出了明顯的變化。從小試管法的試驗結果(圖2)可以看出,MS82菌株的菌體生物膜經過染色后顏色比3個突變菌株深,且環狀完整,表明生成的細菌數量多,生物被膜形成量多,生物被膜形成能力強。96微孔板法試驗結果(圖3)與圖2一致,即3個基因突變后的生物被膜形成能力明顯變弱,且隨著時間的延長,差異逐漸增大;同時3個突變菌株的生物被膜形成能力隨時間延長,逐漸趨于一致。
2.3 運動性能力差異分析
2.3.1 游泳運動
具有鞭毛的細菌在液體中借助鞭毛的旋轉,使菌體能定向泳動,在培養基表面表現為類圓形云霧狀擴散。圖4試驗結果表明,點樣10.0 μL時各菌株的游泳圈直徑大于點樣2.5 μL時,3株缺失GGDEF結構域基因的突變型菌株擴散直徑小于野生型,表現出游泳運動缺陷。不同點樣量下,MS82野生型菌株與3株突變型菌株之間均表現為極顯著差異。MS82、MT5092、MT0189、MT19 這4個菌株的泳動能力強弱呈現依次下降的趨勢。
2.3.2 集群運動
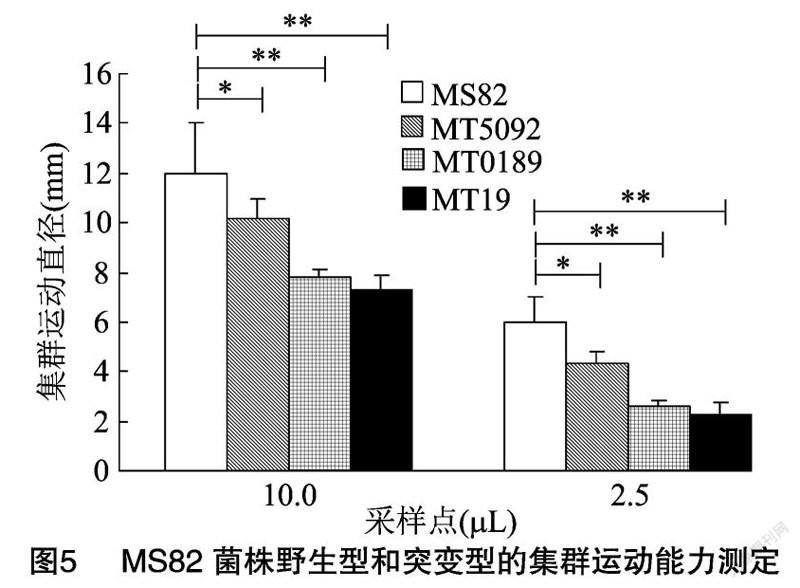
細菌在高密度下會發生集群運動,在相應培養基上出現以接種點為中心向外蔓延的生長區域,生長區域直徑越大,表明細菌的集群運動能力越強。對比數據(圖5)發現,點樣10.0、2.5 μL 時各菌株之間的差異性一致。野生型MS82菌株的生長區域直徑顯著或極顯著大于基因突變后的3個突變菌株。說明含有GGDEF結構域基因的缺失影響了MS82菌株的集群運動能力。
2.3.3 抽搐運動
通過刺傷試驗檢測細菌的抽搐運動能力時,會在培養基與底部培養皿之間形成淺白色的位移區域。觀察試驗結果發現,相較于突變型菌株,野生型菌株MS82向四周發生的位移距離更大,且位移邊緣不平整,表明有繼續向外發生位移的趨勢,而突變型菌株發生的位移距離小,邊緣光滑呈類圓形。進一步分析數據(圖6)可知,突變株MT0189位移距離雖然變小但與野生株之間無顯著性差異;突變株MT5092位移區域顯著減小,約為野生株的1/2;突變株MT19位移區域極顯著減小,幾乎不發生位移。
3 討論
c-di-GMP作為細菌內調節多細胞行為的調節因子,胞內濃度水平由該系統的上下游信號分別調節,并影響細菌不同的生命活動。濃度低時,上游合成信號DGCs與2分子GTP在GGDEF結構域的活性部位結合形成c-di-GMP,提高胞內c-di-GMP濃度水平,促進生物被膜的形成;濃度高時,多余的c-di-GMP會與GGDEF結構域的抑制位點相結合,或被特異性磷酸二酯酶(PDEs)感知并分解,抑制生物被膜的形成。同時,細胞的運動行為的表達在生物被膜形成過程中是相互聯系、共同參與的。c-di-GMP在高水平下限制細胞的運動行為,進而有利于形成生物被膜;相反c-di-GMP在低水平下,有利于鞭毛介導的運動行為,不利于生物被膜的形成。
c-di-GMP信號系統接收到環境信號會使熒光假單胞菌產生包括2,4-二乙酰基間苯三酚、藤黃綠膿菌素、硝吡咯菌素、氫氰酸等多種能夠防治病原微生物的抑菌物質。此前在對熒光假單胞菌喪失GGDEF結構域的突變體MT19進行抑菌活性測定時,MT19表現出明顯的抑菌活性缺陷。本試驗在此基礎上進一步探究對比同源重組突變株MT5092、MT0189的抑菌活性,試驗結果顯示,抑菌活性同樣有所降低,符合此前得到的結論,說明缺失GGDEF結構域會降低c-di-GMP濃度,進而抑制抑菌活性物質的產生。與此同時,發現2株同源重組菌株的抑菌活性比MT19強,推測可能是不同突變方式及位點導致的基因型存在內在差異,因此在抑菌活性表型上也存在一定的差異。
另外,通過誘變熒光假單胞菌F113獲得缺失GGDEF結構域的WspR蛋白突變體,該突變體的運動能力強于野生型菌株,生物膜形成能力受到抑制。但在本次試驗中,同源重組突變菌株MT5092、MT0189以及隨機突變株MT19的游泳運動、集群運動、抽搐運動等運動行為及生物被膜形成能力都有所下降,與其他菌株如鮑曼不動桿菌(Acinetobacter baumannii)ATCC17978、嗜酸乳桿菌(Lactobacillus acidophilus)ATCC4356、普城沙雷氏菌(Serratia puccinia)G3、天藍色鏈霉菌(Streptomyces coelicolor)等菌株相關試驗中所得到的結果相符,卻與F113菌株的試驗結論略有不同。同時,發現2株同源重組菌株的運動能力比隨機突變株MT19強,且兩者同源重組菌株MT5092與MT0189之間也存在一定差異,推測同樣可能是基因位點不同導致的表達存在差異。
本試驗主要通過對比3個缺失GGDEF結構域基因的突變株MT5092、MT0189、MT19與MS82野生型菌株對綠色木霉的抑菌能力、生物被膜形成能力、運動行為能力,發現缺失GGDEF結構域對c-di-GMP信號系統調控細菌抑菌物質合成、生物被膜形成及運動能力存在抑制作用。為更深入地探索GGDEF結構域對c-di-GMP調控生物被膜與運動性能力之間的關系,下一步將通過基因互補試驗驗證突變菌株的抑菌活性、生物被膜形成及運動能力的變化驗證其基因功能。
參考文獻:
[1]艾連中,范藝周,熊智強. 第二信使分子調控細菌胞外多糖生物合成研究進展[J]. 中國食品學報,2021,21(4):1-8.
[2]全 旭,王鶴齡,張慧彥,等. c-di-GMP及其對細菌生物膜調控作用的研究進展[J]. 現代口腔醫學雜志,2018,32(6):352-356.
[3]秦文韜,王守現,榮成博,等. 我國食用菌病害發生與防控概況[J]. 中國食用菌,2020,39(12):1-7.
[4]楊 毅,李 治,高玲霞,等. 熒光假單胞菌抗生性代謝產物合成相關基因的研究現狀[J]. 中國生物工程雜志,2012,32(8):100-106.
[5]詹學良,姚嚴翔,蘆曉紅,等. 銅綠假單胞菌PAO1中c-di-GMP代謝相關基因PA0575對表型的影響[J]. 微生物學通報,2020,47(6):1927-1934.
[6]肖玉杰. 惡臭假單胞菌KT2440中c-di-GMP及其代謝酶BifA,GcbA在調控生物被膜形成和游動性中的作用[D]. 武漢:華中農業大學,2017.
[7]盧佳思. 固氮施氏假單胞菌環二鳥苷酸(c-di-GMP)代謝相關基因的功能鑒定[D]. 合肥:安徽農業大學,2016:3-6.
[8]Simm R,Morr M,Kader A,et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility[J]. Molecular Microbiology,2004,53(4):1123-1134.
[9]Monds R D,Newell P D,Gross R H,et al. Phosphate-dependent modulationOf c-di-GMP levels regulates Pseudomonas fluorescens Pf0-1 biofilm formation by controlling secretionOf the adhesin LapA[J]. Molecular Microbiology,2007,63(3):656-679.
[10]Nie H L,Xiao Y J,He J Z,et al. Phenotypic-genotypic analysisOf GGDEF/EAL/HD-GYP domain-encoding genes in Pseudomonas putida[J]. Environmental Microbiology Reports,2020,12(1):38-48.
[11]劉正慧,李 丹,Leo S Frederick,等. 食用菌主要病原真菌和細菌[J]. 菌物研究,2018,16(3):158-163.
[12]馬 林,曲紹軒,王曉強,等. 食用菌木霉的生防細菌鑒定及相關基因功能預測[J]. 江蘇農業學報,2016,32(3):528-533.
[13]薩姆布魯克 D J,拉塞爾 D W. 分子克隆實驗指南[M]. 黃培堂,譯. 3版. 北京:科學出版社,2016:1595.
[14]譚才鄧,朱美娟,杜淑霞,等. 抑菌試驗中抑菌圈法的比較研究[J]. 食品工業,2016,37(11):122-125.
[15]陳朝喜. 細菌生物被膜定性和定量研究方法[J]. 湖北農業科學,2016,55(9):2177-2180.
[16]Gu G Y,Smith L,Liu A X,et al. Genetic and biochemical map for the biosynthesisOfOccidiofungin,an antifungal produced by Burkholderia contaminans strain MS14[J]. Applied and Environmental Microbiology,2011,77(17):6189-6198.
[17]謝杰鵬,孔晉亮,陳一強,等. 美羅培南對胞內不同c-di-GMP濃度表型銅綠假單胞菌生物被膜形成的影響[J]. 廣西醫科大學學報,2020,37(6):1001-1006.
[18]鄭賢惠,汪鈺鴻,張玥濤,等. 生物被膜與環二鳥苷酸信號系統[J]. 生命的化學,2020,40(12):2162-2169.
[19]谷維璇. c-di-GMP對銅綠假單胞菌生物被膜調控的研究進展[J]. 中國細胞生物學學報,2020,42(12):2289-2296.
[20]Berendsen R L,Kalkhove S I C,Lugones L G,et al. GerminationOf Lecanicillium fungicola in the mycosphereOf Agaricus bisporus[J]. Environmental Microbiology Reports,2012,4(2):227-233.
[21]Navazo A,Barahona E,Redondo-Nieto M,et al. Three independent signalling pathways repress motility in Pseudomonas fluorescens F113[J]. Microbial Biotechnology,2009,2(4):489-498.
[22]喬 霞,蘇雅靜,魏 軍,等. 鮑曼不動桿菌ATCC17978中第二信使c-di-GMP相關代謝蛋白的生物信息學分析[J]. 中國病原生物學雜志,2020,15(9):1005-1009,1014.
[23]何嘉輝,孫潔麗,閆文娟,等. 嗜酸乳桿菌GGDEF和EAL結構域相關蛋白的表達結構域相關蛋白的表達、純化及活性分分析[J]. 南方醫科大學學報,2017,37(5):633-639.
[24]吳 巖. 普城沙雷氏菌G3菌株GGDEF/EAL結構域蛋白PigX的功能研究[D]. 鎮江:江蘇大學,2016:41-42.
[25]Liu X C,Zheng G S,Wang G,et al.OverexpressionOf the diguanylate cyclase CdgD blocks developmental transitions and antibiotic biosynthesis in Streptomyces coelicolor[J]. Science China(Life Sciences),2019,62(11):1492-1505.

