血漿IL-6及降鈣素原對肝硬化合并顯性肝性腦病抗感染治療的預后評估價值
倪艷, 張千, 吳剛
(西南醫科大學附屬醫院感染病科感染與免疫實驗室,四川省瀘州市 646000)
肝性腦病(hepatic encephalopathy,HE)是以代謝與神經功能紊亂為特征的綜合性疾病,其中半數以上的患者合并有肝硬化[1]。在明確無腦部基礎疾病前提下,隨著HE病情進展,患者仍可能發生中樞神經及認知功能退化。West-Haven分級系統結合肝硬化與神經認知功能變化情況將該病分為4級,其中0~1級定義為隱匿性肝性腦病,2~4級定義為顯性肝性腦病(overt hepatic encephalopathy,OHE)[2]。臨床研究顯示,肝硬化合并OHE患者可表現出全腦神經功能損傷,并具有并發癥發生率高、預后生存率低的特點[3]。由于該病的發生常與某一誘發因素相關,臨床治療以明確誘因為前提,通過糾正或去除誘因而改善患者病情。本文觀察血漿白細胞介素-6(interleukin-6,IL-6)及降鈣素原(procalcitonin,PCT)對肝硬化合并OHE患者抗感染治療的預后評估價值,報道如下。
1 資料和方法
1.1 一般資料
選取本院2019年8月—2021年6月收治的肝硬化合并OHE患者106例為研究對象,根據預后評定標準[4](治療后或隨訪中無明顯神經及精神癥狀,或癥狀好轉則視為預后良好;治療后或隨訪中神經及精神癥狀明顯加重,或中途放棄治療出院,或出現死亡則視為預后不良)分為預后良好組(41例)及預后不良組(65例)。兩組患者一般資料比較,差異無顯著性(P>0.05;表1)。
1.2 病例入選標準
納入標準:①符合《肝硬化肝性腦病診療指南(2018年版)》[5]中的相關診斷標準;②OHE發生誘因為感染;③符合West-Haven標準[2]診斷2~4級的HE患者;④患者及家屬均知情并同意。排除標準:①合并顱內出血、顱內感染及顱內占位性病變所致的精神及神經異常者;②合并中毒性腦病、代謝性腦病等非肝性腦病的肝硬化者;③合并帕金森、阿茨海默癥等明顯的精神類疾病者;④合并門-體靜脈分流術史;⑤合并嚴重的電解質紊亂史;⑥合并系統性紅斑狼瘡、甲狀腺功能亢進、類風濕性關節炎等自身免疫性疾病者;⑦近半年內有糖皮質激素等免疫調節類藥物治療者;⑧臨床資料不全或依從性差者。

表1 兩組患者一般資料比較
1.3 治療方法
所有患者均接受常規治療。控制蛋白攝入,以碳水飲食為主,根據患者蛋白耐受反應每日增加30 g蛋白質,最大劑量為每天1 g/kg;并根據患者情況給予能量合劑、血漿、白蛋白等支持治療,維持水電解質及酸堿平衡。降血氨藥物治療:乳果糖口服溶液(Abbott Healthcare,批準文號H10100065)口服15~30 mL/次,3次/天;注射用門冬氨酸鳥氨酸(武漢啟瑞藥業有限公司)靜滴10~20 g/天。補充支鏈氨基酸:支鏈氨基酸注射液250 mL/天。感染治療:根據感染診治標準,結合患者感染部位及并發癥,有針對性抗感染治療。連續治療15天,治療結束后隨訪15天,詳細記錄患者預后情況。
1.4 凝血功能檢測
采集患者入院時空腹外周靜脈血3 mL,乙二胺四乙酸(EDTA)抗凝。采用凝血分析儀(Sysmex-CA7000)檢測國際標準化值(international normalized ratio,INR)及凝血酶原活動度(prothrombin time activity,PTA)。
1.5 血常規檢測
采用血細胞計數儀(Sysmex-XE5000)檢測血常規指標中性粒細胞、血小板及淋巴細胞數量,并計算中性粒細胞數/淋巴細胞計數(NLR)和血小板計數/淋巴細胞計數(PLR)。
1.6 血氨、血鈉、肝腎功能及炎性指標檢測
采用全自動生化分析儀(西門子ADVIA)及相關試劑盒檢測血氨、血鈉、天門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、γ谷氨酰轉肽酶(γ-glutamyl transpeptidase,GGT)、總膽紅素(total bilirubin,TBIL)、肌酐(creatinine,Cr)、白蛋白(albumin,ALB)、IL-6及PCT水平。根據肝、腎、凝血功能的檢測結果計算終末期肝病模型(model for end-stage liver disease,MELD)評分。MELD=9.6×ln(Cr mg/dL)+3.8×ln(TBIL mg/dL)+11.2×ln(INR)+6.4[6]。
1.7 統計學方法
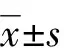
2 結 果
2.1 兩組患者入院時血檢結果比較
預后不良組入院時AST、ALT、TBIL、Cr、INR、MELD評分、NLR及血漿IL-6、PCT水平均顯著高于預后良好組,PTA及PLR顯著低于預后良好組(P<0.05;表2)。
2.2 多因素Logistic回歸分析結果
將臨床資料存在差異的指標納入多因素Logistic回歸分析,血漿IL-6、PCT是影響肝硬化合并OHE患者預后的獨立危險因素(P<0.05);PLR是影響肝硬化合并OHE患者預后的保護因素(表3)。

表2 兩組患者入院時血檢結果比較

表3 影響肝硬化合并OHE患者預后的多因素Logistic回歸分析
2.3 血漿IL-6、PCT水平與肝硬化合并OHE患者預后生存分析
ROC結果顯示血漿IL-6、PCT的曲線下面積(AUC)分別為0.831、0.842(表4)。根據cut-off分別分組進行Kaplan-Meier法分析發現,血漿IL-6>65.50 ng/L患者生存率為9.30%,≤65.50 ng/L患者為62.71%;血漿PCT>0.21 ng/L患者生存率為12.13%,≤0.21 ng/L患者為86.67%(圖1)。

表4 血漿IL-6、PCT水平影響肝硬化合并OHE患者預后的ROC分析

圖1 血漿IL-6、PCT對OHE預后生存的影響
3 討 論
肝性腦病是肝硬化患者最常見的并發癥之一,具有發病隱秘,誘因廣泛及高死亡率等特點。OHE的誘因較多,其中以感染誘發為主[7]。
研究發現,血漿IL-6水平與肝硬化患者HE發展密切相關[8]。肝硬化合并OHE患者因肝硬化致肝功能缺失而使血氨升高,大量血氨進入大腦,引發腦水腫;腦水腫加重機體炎性反應,促進IL-6的分泌,進而加重肝損傷,使氨進一步堆積,促進OHE的發生發展[12]。本文結果顯示,預后不良組AST、ALT、TBIL、肌酐、INR、MELD評分、NLR及血漿IL-6、PCT水平均顯著高于預后良好組,PTA及PLR顯著低于預后良好組(P<0.05)。將差異指標納入多因素Logistic回歸分析模型發現,血漿IL-6水平是影響肝硬化合并OHE患者預后的獨立危險因素,當血漿IL-6>65.50 ng/L時,患者的生存率僅為9.30%。
文獻顯示,PCT可能具有次級炎癥介質的生理功能,并與感染程度呈正相關[9]。當機體發生感染,PCT在IL-6等細胞因子的作用下,促使多器官實質性細胞大量釋放PCT,并與IL-6等炎癥因子共同參與炎癥反應[10]。有文獻顯示,PCT與促炎細胞存在正反饋機制,PCT的大量釋放可能加重肝臟等重要器官的功能損傷[11]。本文結果顯示,肝硬化合并OHE患者PCT>0.21 ng/L預后生存率僅為12.13%,而PCT≤0.21 ng/L生存率可達86.67%。提示血漿PCT水平可作為肝硬化合并OHE患者臨床治療及預后的指導因子,對降低患者病死率有積極意義。然而在查閱文獻的過程中發現,不同年齡人群及患者感染部位以及疾病的進程均會影響血漿IL-6及PCT診斷的敏感值。本文尚存在不足,在不同感染部位及不同感染病原菌對患者血漿水平造成的影響未做細化研究,需要后續進一步擴大樣本量,深入探討。
綜上所述,血漿IL-6及PCT可作為肝硬化合并顯性肝性腦病患者抗感染治療的生物學指標,對降低肝硬化合并OHE患者病死率具有積極的臨床意義。

