扁塑藤素對LPS誘導的HUVEC細胞功能損傷和焦亡的作用
吳明月, 黃紫霞, 許 鋒, 龔 俊, 熊 韜, 王睎之, 王德明
(1.南華大學衡陽醫學院附屬第二醫院麻醉科,湖南省衡陽市421001;2.南華大學船山學院,湖南省衡陽市421001)
內皮細胞的功能障礙和形態學損傷可導致白細胞黏附、血小板活化、氧化應激和炎癥,進而促進動脈粥樣硬化(atherosclerosis,As)的形成[1-2]。預防血管內皮細胞損傷對于防治As性疾病具有重大意義。扁塑藤素(pristimerin,Pri)是一種天然三萜系化合物,扁塑藤素及其相關化合物表現出抗炎、抗氧化和抗瘧疾的活性,以及對不同類型癌癥的抗腫瘤作用[3-5]。本實驗擬建立脂多糖(lipopolysaccharide,LPS)誘導的人臍靜脈內皮細胞(human umbilical vein endothelial cell,HUVEC)損傷模型,探究扁塑藤素對LPS誘導內皮細胞損傷的保護作用機制,從而為扁塑藤素的應用提供理論依據。
1 材料和方法
1.1 材料
HUVEC(中國科學院上海細胞庫);LPS(Sigma-Aldrich 公司,美國);扁塑藤素(Santa cruz公司,美國); CCK-8試劑盒(GLPBIO公司,美國);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、乳酸脫氫酶(lactate dehydrogenase,LDH)檢測試劑盒(南京建成生物工程研究所);人白細胞介素-1β(interleukin-1β, IL-1β) 、IL-18酶聯免疫吸附測定(enzyme-linked immuno sorbent assay, ELISA)試劑盒(R&D Systems,美國);GAPDH抗體(Proteintech公司,美國);Anti-pro Caspase-1+p10+p12抗體(Abcam,ab179515);GSDMD抗體(Santa cruz,sc-393656);NLRP3抗體(Novusbio,NBP2-12446SS);RNA快速提取試劑盒(奕杉生物科技有限公司);反轉錄試劑盒、熒光定量試劑盒(Takara,日本)。
1.2 HUVEC培養及分組
HUVEC用含10%FBS、1%青鏈霉素雙抗DMEM高糖完全培養基,在37 ℃、5%CO2、95%空氣的飽和濕度培養箱中培養。HUVEC細胞分為對照組、LPS組(10 mg/L)、低、中、高劑量(0.1、0.2、0.4 μmol/L)扁塑藤素組。根據分組分別加入培養基、含終質量濃度為10 mg/L LPS的培養基或含LPS+低、中、高劑量扁塑藤素的培養基。各給藥組的扁塑藤素均在LPS刺激前2 h加入,置于37 ℃、5%CO2培養箱中培養24 h,用于后續檢測分析。
1.3 CCK-8法檢測HUVEC細胞活力
在96孔板中加入100 μL HUVEC細胞懸液(6×102個/L),培養箱中孵育12 h,預實驗確定LPS質量濃度。給藥 24 h后,每孔加入10 μL CCK-8試劑后繼續培養2 h。酶標儀450 nm處測定各組光密度,計算細胞增殖活力。HUVEC增殖活力(%)=(OD給藥-OD空白)/(OD對照-OD空白)×100%。
1.4 乳酸脫氫酶釋放實驗
收集細胞培養上清液,使用乳酸脫氫酶細胞毒性檢測試劑盒,按照說明書測定乳酸脫氫酶水平。酶標儀490 nm處測定各組樣品光密度。
1.5 ELISA檢測IL-18、IL-1β蛋白
收集細胞培養上清液,使用ELISA試劑盒,按照說明書檢測IL-18、IL-1β含量。
1.6 MDA和SOD水平的測定
收集細胞培養上清液,使用MDA和SOD檢測試劑盒,按照說明書檢測MDA和SOD含量。
1.7 Western blotting法檢測焦亡相關分子蛋白
提取總蛋白,加入RIPA裂解液裂解細胞,采用BCA法進行蛋白含量測定,提取的蛋白變性上樣后進行電泳,電泳后電轉移至 PVDF膜,5%脫脂牛奶室溫下作用2 h,4 ℃孵育一抗過夜,洗膜30 min后室溫孵育二抗1 h,再次洗膜30 min,ECL化學發光法得到條帶,并計算蛋白相對表達水平。
1.8 qPCR檢測焦亡相關分子mRNA
用RNA快速提取試劑盒提取細胞總RNA,Nano Drop2000分光光度計測定RNA水平,使用逆轉錄試劑盒將RNA逆轉錄成cDNA。采用SYBR Premix Ex Taq II 試劑盒進行定量PCR檢測。通過2-ΔΔct對結果進行分析,使用GAPDH作為內參基因,各基因引物序列及擴增片段長度見表1,計算目的基因的相對表達量。

表1 引物序列和擴增片段長度
1.9 統計學方法
2 結 果
2.1 扁塑藤素對細胞活力的影響
隨著LPS質量濃度增加,HUVEC細胞活力逐漸下降, 20 mg/L LPS處理24 h時細胞死亡數較多,因此選擇了細胞活力50%時的10 mg/L LPS。使用低、中、高劑量扁塑藤素對細胞進行預處理后,扁塑藤素可以改善 LPS對HUVEC的損傷,并呈劑量依賴性,0.4 μmol/L時效果最佳(P<0.05;圖1)。

圖1 扁塑藤素對LPS誘導的HUVEC細胞活力的影響(n=3)
2.2 扁塑藤素對LDH含量的影響
與對照組比較,LPS組LDH含量顯著升高(P<0.05);扁塑藤素組LDH含量均顯著降低,高劑量扁塑藤素組降低最顯著(P<0.05;圖2)。

圖2 扁塑藤素對LPS誘導的HUVEC細胞上清液中LDH含量的影響(n=3)
2.3 扁塑藤素對MDA、SOD含量的影響
與對照組比較,LPS組MDA顯著增加,SOD顯著降低(P<0.05)。與LPS組比較,中、高劑量扁塑藤素組MDA降低,SOD升高 (P<0.05;圖3),提示扁塑藤素以劑量依賴的方式逆轉LPS作用。
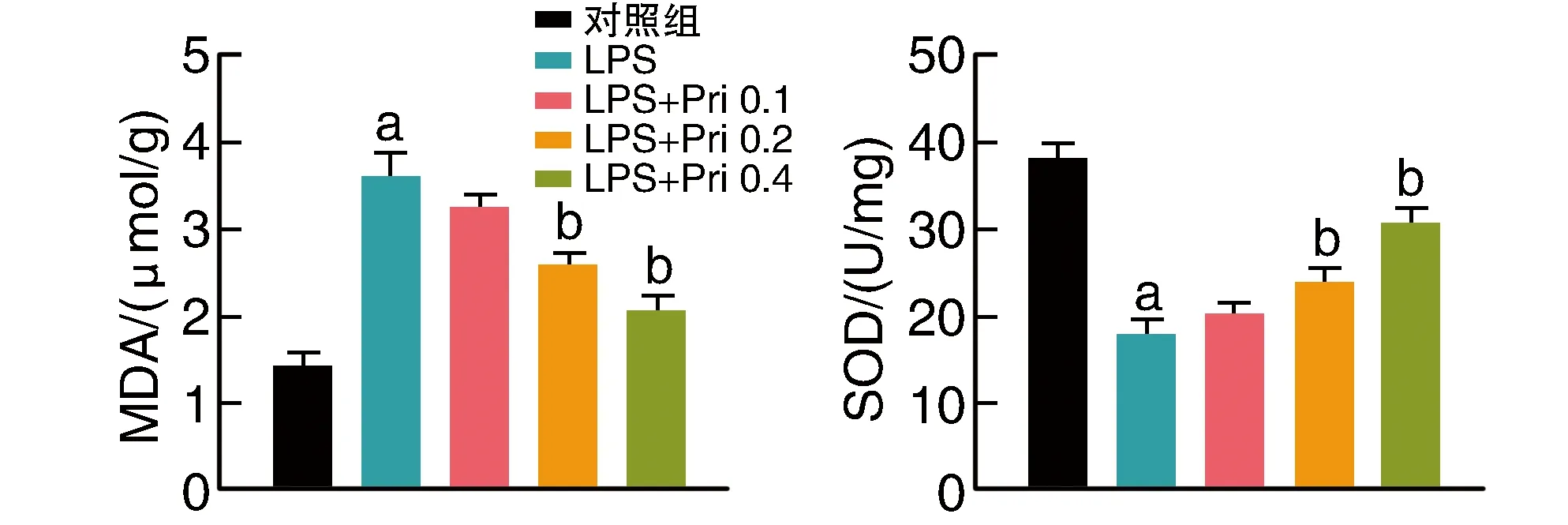
圖3 扁塑藤素對LPS誘導的HUVEC細胞上清液中MDA、SOD含量的影響(n=3)
2.4 扁塑藤素對細胞焦亡的影響
與對照組比較,LPS顯著提高HUVEC細胞上清液中IL-18和IL-1β蛋白水平,且該效應能被扁塑藤素組以劑量依賴的方式逆轉(P<0.05;圖4A和B)。與對照組比較,LPS顯著提高 HUVEC 中焦亡相關分子NLRP3、GSDMD和Caspase-1的蛋白和mRNA表達水平,且該效應能被扁塑藤素組以劑量依賴的方式逆轉(P<0.05;圖4C、D和E)。

圖4 扁塑藤素對LPS誘導HUVEC細胞焦亡的影響(n=3)
3 討 論
血管內皮細胞在組織內環境穩定、維持體液平衡、炎癥細胞浸潤等方面起著重要作用,動脈粥樣硬化的形成與血管炎癥密切相關,而內皮功能障礙是動脈粥樣硬化形成的第一階段。LPS誘導炎癥反應的主要原因是其對內皮細胞的毒性作用[6]。本研究探索了扁塑藤素在炎癥誘導的HUVEC細胞毒性中的作用,發現LPS處理抑制了HUVEC的增殖,同時增加了LDH的釋放,這表明LPS可誘導細胞功能損傷,而扁塑藤素預處理可呈劑量依賴性抑制LPS誘導的細胞功能損傷。
氧化應激是由氧化和抗氧化系統之間的不平衡引起的。LPS誘導的氧化應激是血管內皮細胞損傷的主要始發者。LPS誘導的內皮功能障礙與ROS的產生有關[7]。MDA是活性氧(reactive oxygen species,ROS)攻擊細胞膜多不飽和脂肪酸形成的,是氧化應激的一個常用的生物標志物。SOD作為細胞抗氧化酶,是抵抗ROS毒性作用的第一道防線,在抗氧化防御系統中起著關鍵作用。研究表明,扁塑藤素通過核因子E2相關因子和MAPK/核因子-κB通路發揮抗氧化應激和抗炎作用[8]。為了了解扁塑藤素在LPS誘導的氧化應激中的影響,本研究測定了MDA及SOD含量,結果顯示, LPS處理后HUVEC中MDA增加,SOD降低;然而,中、高劑量的扁塑藤素均可抑制上述反應。以上提示,抑制LPS誘導的氧化應激是扁塑藤素對內皮功能障礙起保護作用的機制。
Cheng等[9]研究表明,脂多糖引起的細胞內損傷會引發內皮細胞焦亡和血管完整性的喪失。同時文獻[10-11]報道,內皮細胞死亡是動脈粥樣硬化形成過程中的一個關鍵的初始階段,而焦亡是動脈粥樣硬化相關的內皮細胞死亡的主要類型。焦亡是一種新發現的促炎性、程序性細胞死亡類型,與包括動脈粥樣硬化在內的幾種心血管疾病有關[12-13]。焦亡的特征是Gasdermin家族介導膜孔的形成、細胞腫脹和質膜破裂,以及促炎性細胞內容物的釋放,包括白細胞介素-1β、白細胞介素-18和高遷移率族蛋白B1(high mobility group protein 1,HMGB1)[14]。GSDMD被激活的Caspase-1裂解,通過形成膜孔引發細胞焦亡[15]。研究表明,扁塑藤素通過直接阻斷NEK7-NLRP3的相互作用來干擾NLRP3炎癥體以及Caspase-1的激活和IL-1β的釋放[16],這可能有助于解釋其抑制細胞焦亡作用。本研究假設扁塑藤素可能通過調節內皮細胞的焦亡在炎癥中發揮作用,并進行了這項研究來證明這一點。
本研究表明,LPS介導內皮細胞焦亡,引起焦亡相關指標NLRP3、GSDMD、Caspase-1的蛋白及mRNA表達量升高,增加了細胞上清液中IL-1β、IL-18的蛋白含量,提示發生了細胞焦亡,而扁塑藤素能以劑量依賴的方式逆轉上述反應,緩解了LPS誘導的內皮細胞焦亡,并調節焦亡相關蛋白,以抑制LPS引起的內皮細胞損傷。
綜上所述,扁塑藤素對LPS誘導的內皮細胞損傷呈劑量依賴性保護,可能是通過抑制細胞焦亡和減輕氧化應激從而改善內皮細胞功能實現的。

