氯胍通過下調FASN/SREBP-1c通路抑制肝癌細胞增殖、集落形成及遷移
岳壯壯, 黃玲俐, 吳添雨, 伍燕, 顏新建, 李高峰
(中南大學湘雅醫學院附屬株洲醫院腫瘤科,湖南省株洲市 412000)
原發性肝癌是中國常見的惡性腫瘤之一,其治療原則是以手術為主的綜合治療[1-2]。研究表明,雙胍類藥物氯胍在腫瘤細胞系中抗增殖作用最強[3]。代謝重編程在癌癥的發生發展中起著至關重要的作用[4],在肝癌患者中調節元件結合蛋白(sterol regulatory element-binding protein-1c,SREBP-1c)被上調,從而導致脂肪酸合成酶(fatty acid synthase,FASN)轉錄激活[5-6]。目前氯胍對肝癌細胞的作用機制暫無相關報道,本研究檢測不同濃度的氯胍對Hep-G2及SMMC-7721兩種肝癌細胞增殖、集落形成及遷移能力的影響,初步探討其作用機制。
1 材料和方法
1.1 材料
肝癌細胞株Hep-G2(中南大學湘雅醫學院基礎醫學院)和SMMC-7721(湖南師范大學醫學院);氯胍(中國上海阿拉丁試劑公司);DMEM基礎培養基、南美胎牛血清(fetal bovine serum,FBS)(美國Gibco公司);胰蛋白酶(trypsin 0.25% EDTA)、PBS磷酸鹽緩沖液、青鏈霉素(美國Hyclone公司);FASN、SREBP-1c、β-actin抗體(美國CST公司);Transwell小室(3422)(美國康寧公司);倒置熒光顯微鏡-DMI3000B(德國Leica公司);全自動化學發光圖像分析系統-4600(上海天能科技有限公司);多功能酶標儀-Synergy HTX(美國BioTeK公司)。
1.2 細胞培養
將肝癌細胞株Hep-G2及SMMC-7721培養于含10%FBS、1%青鏈霉素的DMEM基礎培養基中,于37 ℃、5%CO2培養箱中培養,待細胞生長達70%~80%時進行傳代,取對數期細胞進行實驗。所有實驗重復3次。
1.3 藥物配置
用PBS將氯胍配制成40 mmol/L的母液,分裝后置于-20 ℃保存。用培養基將母液稀釋成相應濃度后進行實驗,現配現用。
1.4 MTT法檢測細胞增殖
收集對數期的Hep-G2及SMMC-7721細胞,重懸后以5×103個/孔接種于96孔板中,每組設置3個復孔,每孔加入200 μL完全培養基,培養24 h后,吸出培養液,PBS洗滌2次,加入不同濃度的氯胍(0、2、4、8、16、32、64、128 μmol/L)處理48 h,每孔加入50 μL 2 g/L MTT溶液,繼續培養5 h,吸出培養液,每孔加入150 μL二甲亞砜,置于搖床上避光震蕩15 min,使用多功能酶標儀檢測490 nm波長處的光密度(OD值),使用Graphprism繪制MTT曲線,計算IC50。細胞相對活力=實驗組OD值/對照組OD組。
1.5 克隆形成實驗檢測細胞集落形成能力
收集對數期的Hep-G2及SMMC-7721細胞,重懸后以8×103個/孔接種于24孔板中,每組設置3個復孔,每孔加入1 mL完全培養基,培養24 h后,棄上清液,PBS洗滌2次,加入不同濃度的氯胍(0、10、20、40 μmol/L)處理5~7天,待對照組細胞生長至70%左右,棄上清液,PBS洗滌2次,加入4%多聚甲醛固定15~20 min,PBS沖洗2次,每孔加入0.5 mL結晶紫染色30 min,流動水沖洗,烘干,多功能酶標儀檢測550 nm波長處的OD值。
1.6 Western blotting檢測蛋白表達情況
收集對數期的Hep-G2及SMMC-7721細胞,重懸后以6×105個/孔接種于6孔板中,每孔加入2 mL完全培養基,培養24 h后,棄上清液,PBS洗滌2次,加入不同濃度的氯胍(0、10、20、40 μmol/L)處理12 h,加入細胞裂解液后煮沸10 min,置于4 ℃冰箱保存備用,使用時進行SDS-PAGE凝膠電泳、轉膜、剪膜、5%脫脂牛奶封閉1 h、一抗4 ℃孵育過夜、TBST洗滌5~6次、二抗室溫孵育2 h、TBST洗滌條帶3~4次、加入ECL化學發光液后使用TANON機器進行曝光,使用Image J軟件對目標條帶進行分析。
1.7 Transwell檢測細胞遷移能力
收集對數期的Hep-G2及SMMC-7721細胞,加入無血清DMEM基礎培養基重懸,配制成無血清細胞混懸液,取200 μL含4×104個細胞的混懸液接種于小室上層,加入不同濃度的氯胍(0、10、20、40 μmol/L),小室下層加入600 μL含10%FBS的DMEM培養基,24 h后取出小室,4%多聚甲醛固定30 min,PBS沖洗2次,每孔加入0.5 mL結晶紫染色2 h,流動水沖洗后拭去小室上層細胞,待小室烘干后在顯微鏡下拍照,使用Image J進行細胞計數。
1.8 統計學分析
2 結 果
2.1 不同濃度氯胍對SMMC-7721及Hep-G2細胞增殖的影響
MTT結果顯示,與氯胍0 μmol/L比較,SMMC-7721、Hep-G2細胞活力隨氯胍濃度升高而降低(P<0.05;圖1)。SMMC-7721及Hep-G2兩種細胞株的IC50分別為50 μmol/L及40 μmol/L。當氯胍濃度為40 μmol/L時,對兩種細胞株的抑制效果已經很明顯,最終實驗選擇0~40 μmol/L的氯胍。
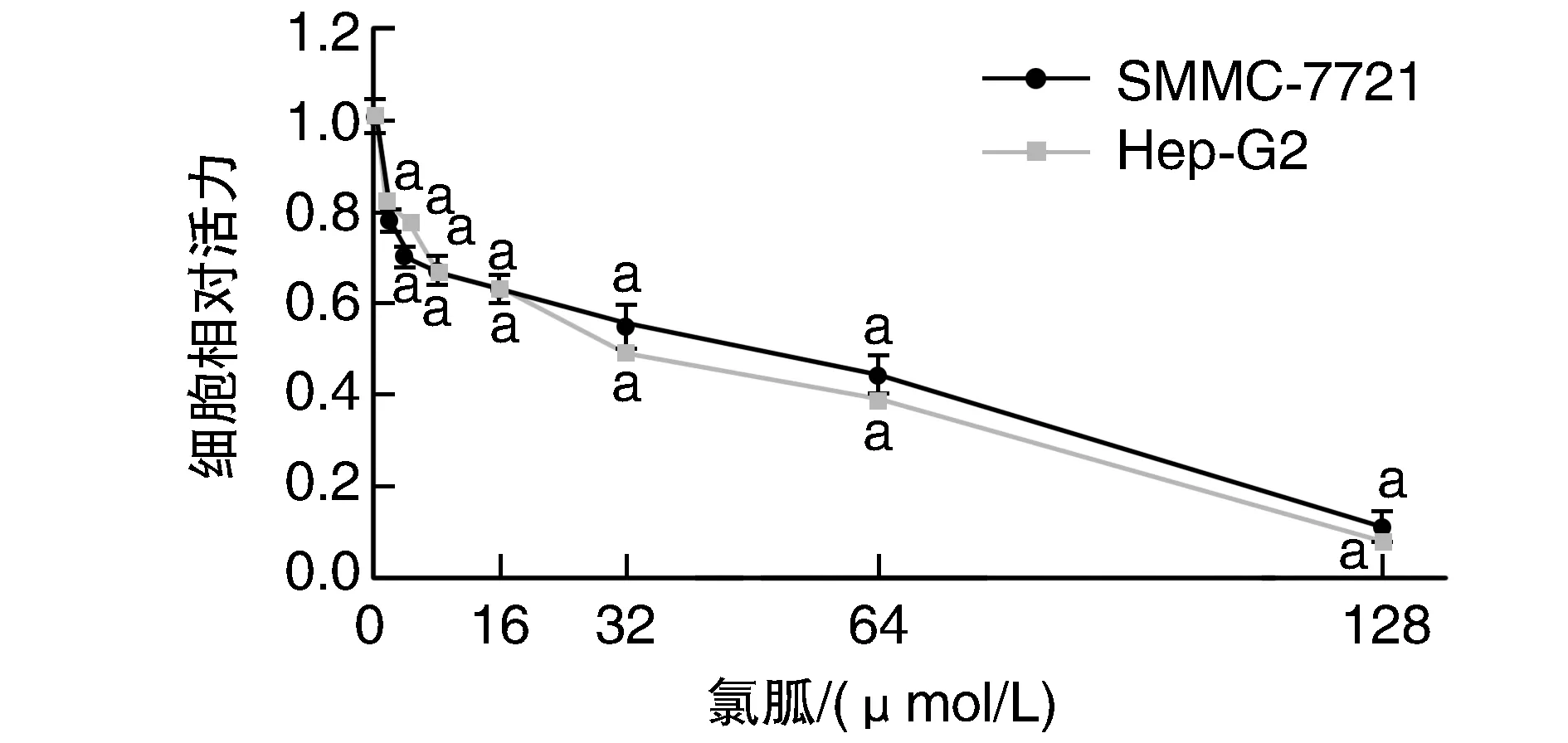
圖1 不同濃度氯胍對細胞增殖的影響a為P<0.05,與同細胞氯胍0 μmol/L比較。
2.2 不同濃度氯胍抑制Hep-G2及SMMC-7721細胞集落形成能力
與氯胍0 μmol/L組比較,其他氯胍濃度組Hep-G2及SMMC-7721的集落形成能力降低(P<0.05;圖2)。
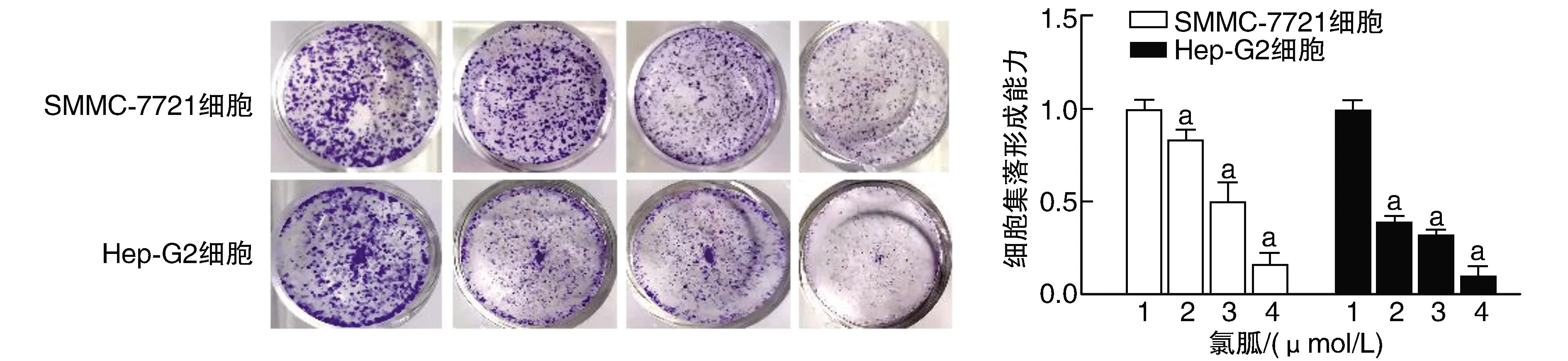
圖2 不同濃度氯胍抑制Hep-G2及SMMC-7721細胞集落形成能力1、2、3、4分別為0、10、20、40 μmol/L氯胍組。a為P<0.05,與同細胞氯胍0 μmol/L比較。
2.3 不同濃度氯胍抑制Hep-G2及SMMC-7721細胞遷移
Transwell結果顯示,與氯胍0 μmol/L組比較,其他氯胍濃度組對細胞遷移的抑制作用增強(P<0.05;圖3)。
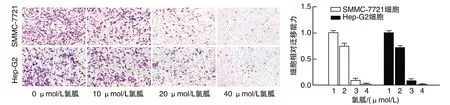
圖3 不同濃度氯胍抑制Hep-G2及SMMC-7721細胞遷移(結晶紫染色,100×)1、2、3、4分別為0、10、20、40 μmol/L氯胍組。a為P<0.05,與同細胞氯胍0 μmol/L比較。
2.4 不同濃度氯胍抑制FASN、SREBP-1c在Hep-G2及SMMC-7721中的表達
Western blotting結果顯示,與氯胍0 μmol/L組比較,氯胍其他濃度組FASN、SREBP-1c在兩種肝癌細胞中的表達均降低(P<0.05;圖4)。
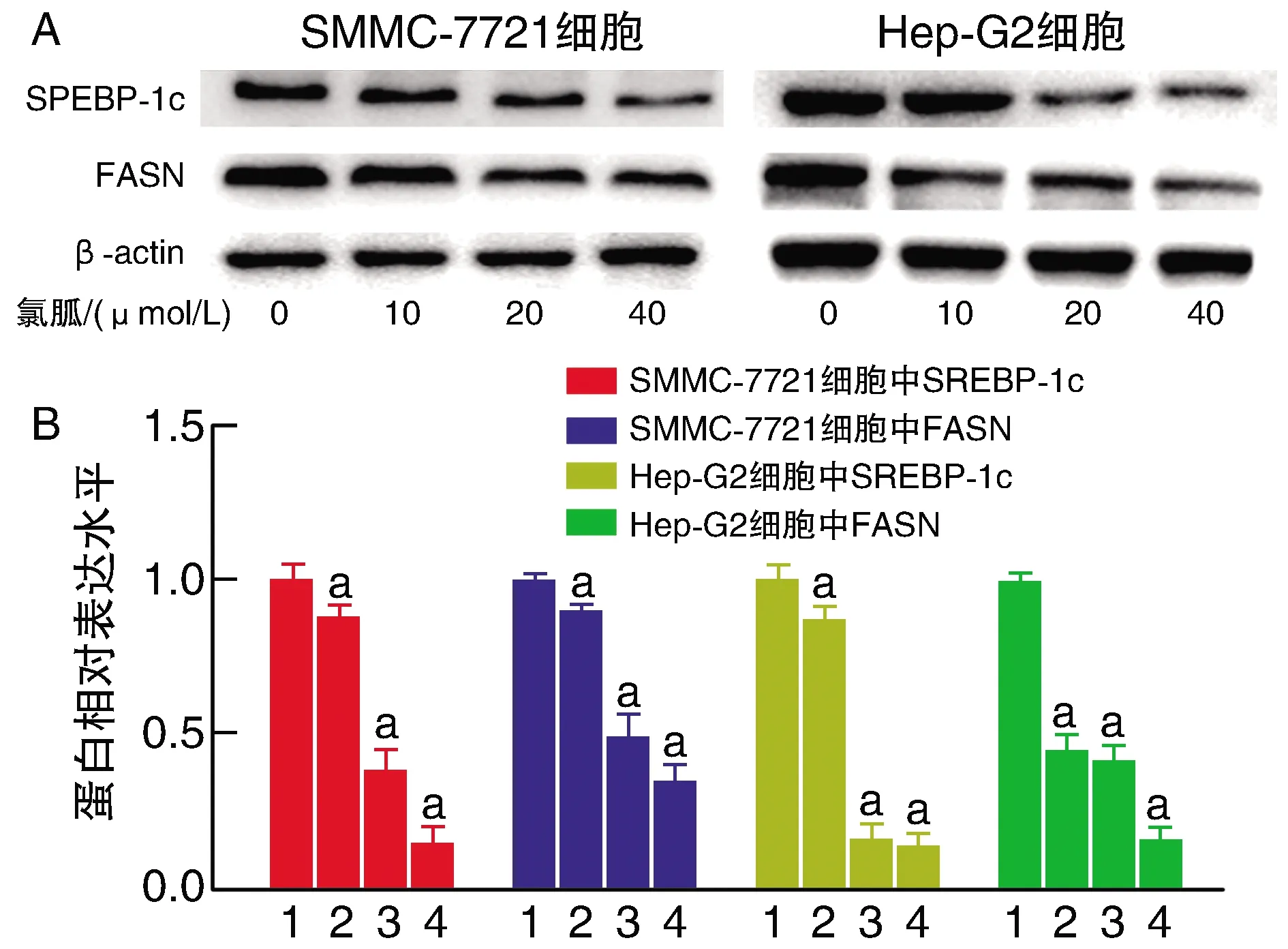
圖4 不同濃度氯胍抑制FASN、SREBP-1c在Hep-G2及SMMC-7721中的表達A為Western blotting實驗結果;B為蛋白表達柱狀圖。1、2、3、4分別為0、10、20、40 μmol/L氯胍組。a為P<0.05,與同細胞氯胍0 μmol/L比較。
3 討 論
肝細胞癌(hepatocellular carcinoma,HCC)是全球常見的癌癥。雖然近年來肝癌在治療上取得了顯著進展,但肝癌患者的預后仍然相對較差,特別是那些無法接受手術治療的晚期肝癌患者。目前對肝癌細胞增殖影響因素已有報道[7-8],但國內外尚無氯胍對肝癌細胞增殖影響的報道。氯胍是一種雙胍類藥物,課題組前期研究發現氯胍對膀胱癌細胞增殖具有抑制作用[9]。本研究40 μmol/L的氯胍對Hep-G2、SMMC-7721細胞株的抑制效果明顯,所以選擇最高濃度40 μmol/L用于實驗。通過MTT、克隆形成及遷移實驗證實了氯胍對兩種肝癌細胞系Hep-G2及SMMC-7721增殖及遷移具有抑制作用,并深入探索其對脂代謝相關蛋白的影響,提示氯胍是一種潛在的抗肝癌藥物。
脂質代謝的改變是癌癥進展的標志之一。在癌細胞中,脂肪酸的合成主要受轉錄調控因子SREBP-1的調節[10]。SREBP-1c是SREBP-1的同工型,通過增加其靶基因的轉錄來激活脂肪酸生物合成途徑[11]。從而提供用于膜和信號分子的生物合成的原料。FASN是脂肪酸生物合成途徑的關鍵酶,并在多種癌癥中過表達,例如乳腺癌、前列腺癌、結直腸癌、卵巢癌、肺癌和肝癌,但其在癌旁組織中的表達較低,在許多情況下與不良預后密切相關[12]。大多數癌細胞依賴于FASN介導的合成途徑,因此FASN是一個良好的治療靶標。研究表明,FASN的過表達與肝癌的發展密切相關,與腫瘤細胞的生存和遷移密切相關[13-14]。Zhang等[15]研究表明,沉默FASN能夠抑制肝癌細胞株Hep-G2增殖。Yu等[16]研究發現,ZHX2通過抑制SREBP-1c介導的新生脂肪生成進而抑制肝癌細胞增殖。因此,抑制FASN/SREBP-1c通路可能是肝癌潛在的治療靶點,本研究結果顯示,氯胍抑制FASN、SREBP-1c的表達。
綜上所述,氯胍具有良好的抗腫瘤活性,能抑制肝癌細胞系Hep-G2及SMMC-7721的增殖及遷移。其機制可能是氯胍通過抑制FASN/SREBP-1c通路,從而抑制肝癌細胞增殖。

