乙型肝炎肝硬化患者內皮祖細胞數量、功能變化及與Child-Pugh評分的相關性
劉漢雄, 楊小安, 熊潭瑋
(1.郴州市第一人民醫院消化內科,湖南省郴州市 423001;2.中山大學附屬第三醫院感染科,廣東省廣州市 510630)
內皮祖細胞(endothelial progenitor cell,EPC)主要來源于骨髓,并存在于肝臟、脾臟、心肌等多個組織器官中,可直接分化為血管內皮細胞促進血管再生[1]。肝損傷時,骨髓來源的EPC能順利歸巢到受損肝組織[2],而體外擴增的EPC[3]經肝門靜脈或外周靜脈輸入,也能到達受損肝組織。EPC到達受損肝組織后可分泌多種細胞因子促進肝細胞增殖和肝臟修復[4]。EPC還可以通過血管生成作用修復受損肝組織。Child-Pugh分級為目前臨床使用最廣泛的肝硬化及肝功能評分標準。但肝硬化患者循環EPC功能及與Child-Pugh評分關系的報道少見,本文對此進行了研究,現報道如下。
1 資料和方法
1.1 研究對象
選擇中山大學附屬第三醫院2019年1月—2020年1月住院或門診確診乙型肝炎肝硬化患者60例為肝硬化組,其中Child-Pugh A、B、C級[5]各20例;另選同期20例健康體檢者為對照組。乙型肝炎病毒感染診斷標準:HBsAg陽性或HBV-DNA陽性。對照組研究對象排除乙型肝炎病毒感染(HBsAg陰性且HBV-DNA陰性)。兩組基線資料見表1。本研究由本院倫理委員會批準,研究對象均知情同意。
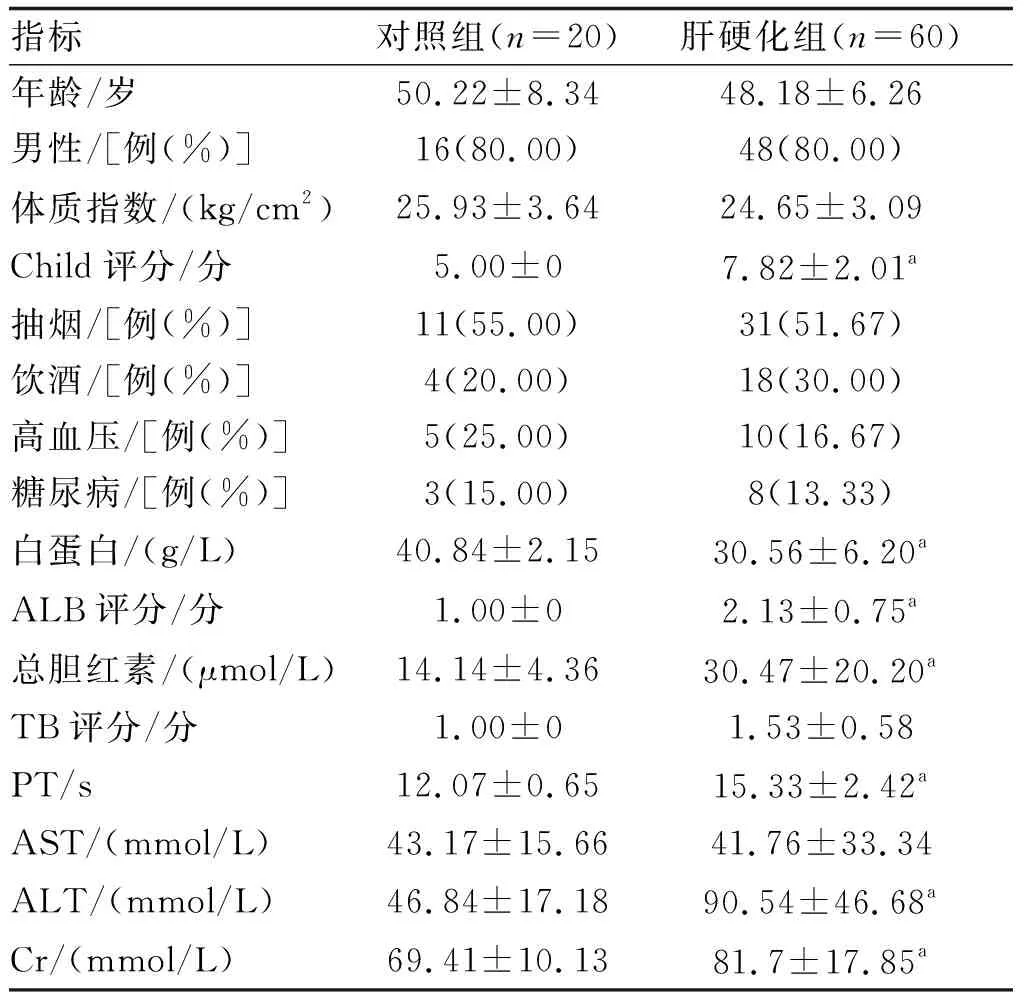
表1 各組臨床資料的比較
1.2 循環EPC的分離、培養和計數
抽取靜脈外周血加入含Ficoll-Paque人淋巴細胞分離液的離心管上層,4 ℃ 2 200 r/min離心25 min,吸取第二層云霧狀單核細胞層,將分離所得單個核細胞重懸于含有20%胎牛血清、50 μg/L血管內皮生長因子的EGM-2培養基中,接種至預先包被好人纖維連接蛋白(1 ng/L)的6孔板中,置于5% CO2、飽和濕度、37 ℃培養箱中培養,每3天換液除去未貼壁細胞,培養至7天后的貼壁細胞即為實驗所用EPC。本研究使用DiI標記的乙酰化低密度脂蛋白(Dil-ac-LDL)和FITC標記的荊豆凝集素-l(FITC-BS-l)雙重染色免疫熒光鑒定EPC,Dil-ac-LDL(紅色)和FITC-BS-Lectin(綠色)雙染色陽性細胞數量即為EPC,計數EPC。
1.3 EPC增殖、遷移能力的測定
原代內皮祖細胞培養7天后,用0.25%胰酶消化貼壁細胞,重懸于DMEM培養液中。將相同數量內皮祖細胞接種到包被有人纖維連接蛋白的96孔培養板,每孔加入10 μL MTT(5 g/L),培養4 h后棄去上清液,在酶標儀下于波長490 nm處測OD值。調整細胞至2×105個/mL;置入Transwell小室,24 h后取出小室,棄去上層液體,刮去濾膜上的未遷移細胞,4%多聚甲醇溶液固定10 min,以DAPI染色,置于熒光顯微鏡下觀察,選擇3個隨機視野計數遷移入下室的細胞。
1.4 統計分析
2 結 果
2.1 乙型肝炎肝硬化患者EPC數量的變化
內皮祖細胞的熒光染色鑒定見圖1。循環EPC數量乙型肝炎肝硬化早期患者(Child-Pugh A、B級)較對照組增加,且高于Child-Pugh C級患者(P<0.05);Child-Pugh C級患者較對照組高但差異無顯著性(P>0.05;圖1)。
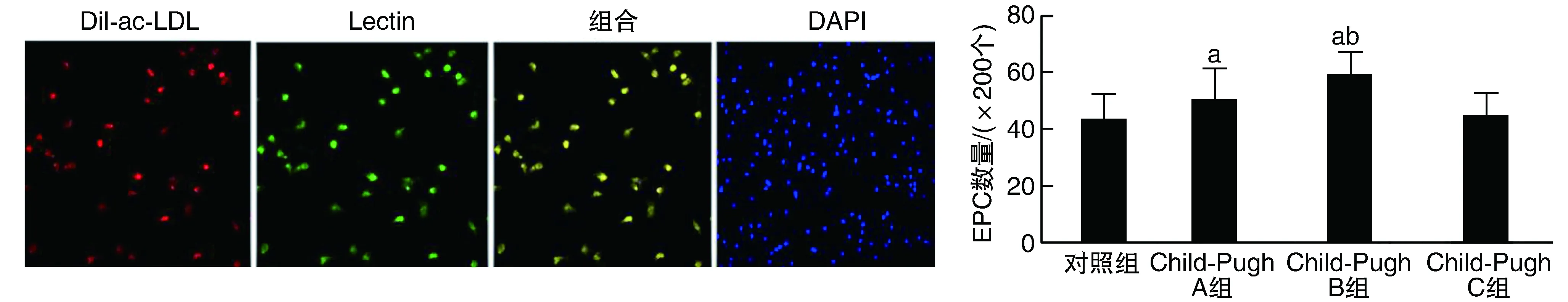
圖1 乙型肝炎肝硬化患者EPC鑒定和數量的變化熒光染色鑒定Dil-ac-LDL為紅色,Lectin為綠色,雙染色細胞即為EPC(200×)。a為P<0.05,與對照組和Child-Pugh C組比較;b為P<0.05,與Child-Pugh A組比較。
2.2 乙型肝炎肝硬化患者內皮祖細胞功能變化
Child-Pugh A級、B級、C級患者循環EPC的體外遷移、增殖能力隨Child-Pugh分級升高而降低(P<0.05;表2)。

表2 乙型肝炎肝硬化患者內皮祖細胞功能的變化
2.3 循環EPC功能與Chhild評分的相關性
Spearman相關分析發現,循環EPC遷移和增殖能力與Child-Pugh評分均呈明顯負相關(P<0.05;圖2)。
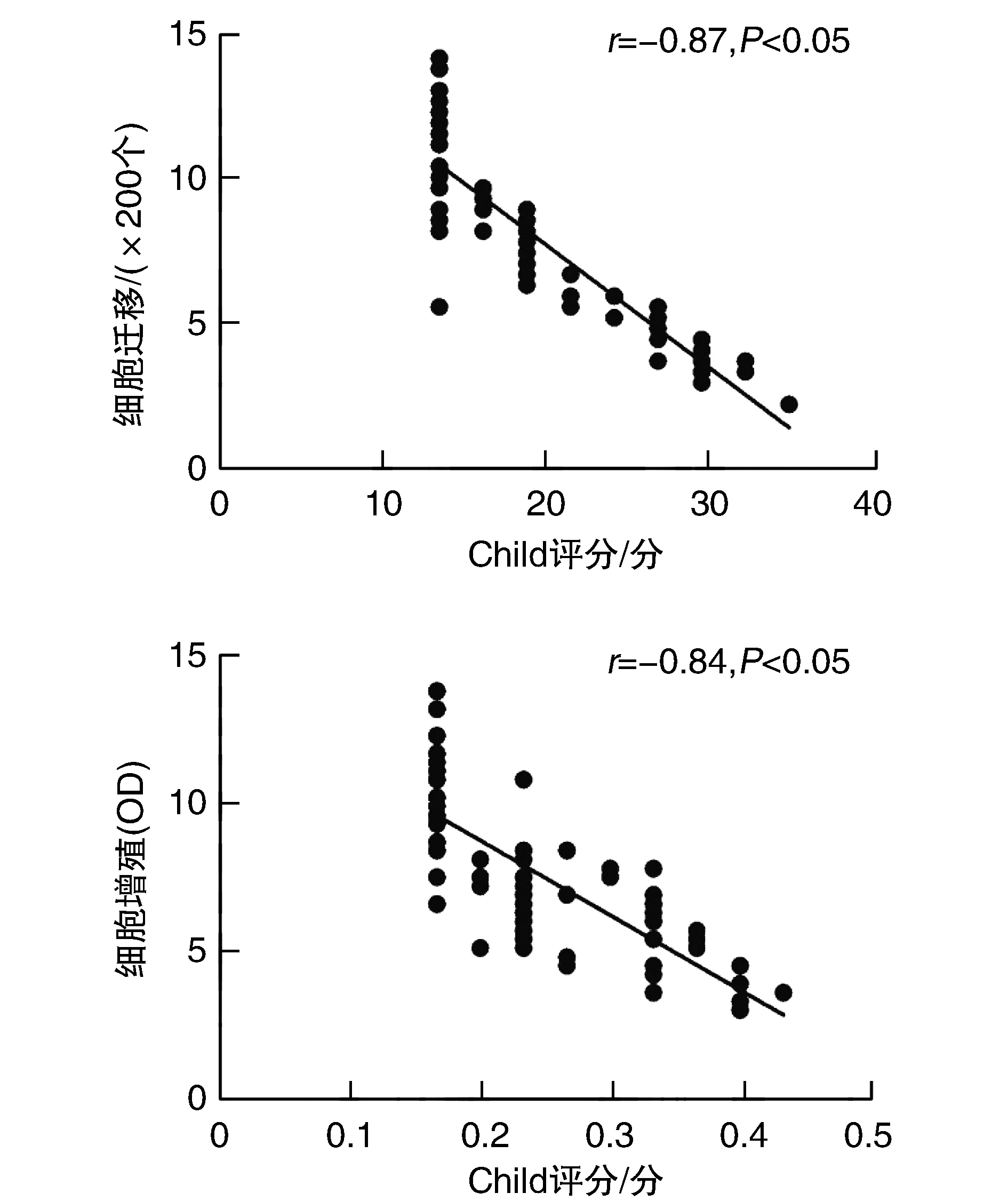
圖2 乙型肝炎肝硬化患者循環EPC功能與Child-Pugh評分的相關性
3 討 論
本研究發現,乙型肝炎肝硬化早期(Child-Pugh A、B級)患者循環EPC數量較對照組上升,而晚期(Child-Pugh C級)患者EPC數量較對照組輕微上升,較早期卻下降;EPC數量與Child-Pugh評分之間沒有相關性,而EPC遷移、增殖能力與Child-Pugh評分呈負相關。因此推論,在肝硬化形成以后,隨著肝硬化結節的產生,肝小葉正常結構破壞,肝臟微循環系統也受到損傷。這些變化都可能導致門脈高壓產生,引起血管內皮損傷和微循環障礙。機體為修復受損的血管內皮,加強從骨髓募集、動員EPC,從而使循環EPC數量增加。該過程可能是機體修復肝損傷及肝纖維化的一種代償機制。而乙型肝炎肝硬化晚期患者已處于嚴重耗竭狀態,并發腹水、黃疸、肝性腦病等多種并發癥,骨髓功能亦受到影響,無法動員足夠EPC修復肝臟,導致EPC水平較早期出現下降。這種下降趨勢,可能導致微循環障礙難以修復,與肝硬化的進展相互促進。
本結果還顯示,乙型肝炎肝硬化患者循環EPC功能呈下降趨勢,且隨著Child-Pugh評分上升EPC功能下降更為明顯。乙型肝炎肝硬化發生后,肝臟功能受到損傷,肝臟代謝功能和合成功能紊亂,導致膽紅素升高,脂質代謝異常及各種有毒物質蓄積,導致EPC功能出現障礙。同時,也可能是乙型肝炎肝硬化晚期EPC數量減少,EPC功能障礙,對肝臟血管內皮修復及血管新生造成影響,從而進一步促進了肝硬化的進展。
有研究與本研究結果一致,認為肝硬化患者循環EPC功能降低[6],EPC數量上升[7]。然而,也有研究認為,肝硬化患者循環EPC數量下降[8-9],EPC功能增強[10]。本研究認為,不同結果可能與入組病例肝硬化的病因不一致,或者其他研究未對肝硬化嚴重程度進行分級有關。不同原因肝硬化有不同發病機制,不同肝硬化嚴重程度患者的肝功能水平不同,并發癥不同,導致EPC募集、動員能力及功能必定也會出現改變。本研究入組患者均為乙型肝炎肝硬化患者,且按照國際公認的Child-Pugh分級進行研究,從而減少了研究偏倚。
總之,本研究發現,肝硬化患者循環EPC數量上升,EPC功能降低。以EPC為治療靶點,提高其數量及功能,有可能達到修復肝損傷及阻止肝硬化惡化的目的。以EPC為靶點的乙型肝炎肝硬化治療策略,如EPC移植,應該得到重視及進一步的研究。

