SNHG1在泌尿男生殖系統(tǒng)腫瘤中的研究進展
鄧世棟, 劉凌志, 郭大勇, 王超, 張暉輝
(南華大學衡陽醫(yī)學院附屬第一醫(yī)院泌尿外科,湖南省衡陽市 421001)
長鏈非編碼RNAs(long non-coding RNAs,lncRNAs)是非編碼RNA家族的重要成員,由于沒有明顯的開放閱讀框架而不具備編碼蛋白質的功能,但可以通過轉錄和轉錄后調節(jié)基因的表達。近年來,由于lncRNAs表達水平的變化與腫瘤的發(fā)生發(fā)展密切相關,對lncRNA的探索已成為臨床研究的熱點。其中長鏈非編碼核仁小分子RNA宿主基因1(lnc small nucleolar RNA host gene1,SNHG1)是一種新發(fā)現的lncRNA,位于染色體11q12.3上,在多種腫瘤中具有異常高表達和致癌特性,參與腫瘤細胞增殖、凋亡和轉移等[1-2]。SNHG1在胃癌中低表達且具有抑癌作用提示SNHG1在不同的腫瘤中可能發(fā)揮不同的功能[3]。SNHG1在泌尿男生殖系統(tǒng)腫瘤中表達上調,并參與腫瘤的生物學行為[4]。本文綜述了SNHG1基因在泌尿男生殖系統(tǒng)腫瘤中的最新研究進展。
1 腎細胞癌
腎細胞癌(renal cell carcinoma,RCC)是泌尿男生殖系統(tǒng)最具侵襲性的癌癥之一,盡管近年來在手術、分子靶向治療、化療和放療等綜合治療方面取得了進展,但轉移性腎癌患者的5年總生存率仍低至10%~20%[5]。
Yang等[6]發(fā)現,與癌旁正常組織相比,腎癌組織中SNHG1表達顯著上調。Zhao等[7]對GEO數據庫的分析也表明SNHG1在腎癌細胞系中過表達,而且與腎癌患者預后不良相關。SNHG1基因敲除降低了腎癌細胞的增殖和侵襲能力,并抑制了腎癌的上皮-間充質轉化(epithelial-mesenchymal transition,EMT)過程。作為癌基因,SNHG1通過負性調控miR-137促使癌細胞的增殖、轉移和侵襲。SNHG1基因敲除后,癌細胞中磷酸化信號轉導與轉錄激活因子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)、STAT3和細胞程序性死亡-配體1(programmed cell death 1 ligand 1,PD-L1)的表達水平顯著降低,miR-129-3p的表達水平則升高[8]。雙熒光素酶報告分析表明miR-129-3p與SNHG1或STAT3之間存在調控相互作用,提示在腎癌細胞系中SNHG1可能通過海綿吸附miR-129-3p促進STAT3的表達,而STAT3可以通過激活PD-1/PD-L1信號通路來促進腫瘤的增殖和發(fā)展,從而促進腎癌的免疫逃逸[9]。miR-129-3p通過靶向STAT3促進CD8+T細胞的增殖和細胞因子的分泌,從而抑制腎癌細胞的增殖。SNHG1通過抑制miR-129-3p來上調STAT3和PD-L1的表達,促進腎癌細胞的增殖、侵襲和免疫逃逸。
SNHG1通過負性調控miR-137發(fā)揮癌基因的作用,也可促進STAT3和PD-L1介導腎癌細胞的免疫逃逸(圖1)。
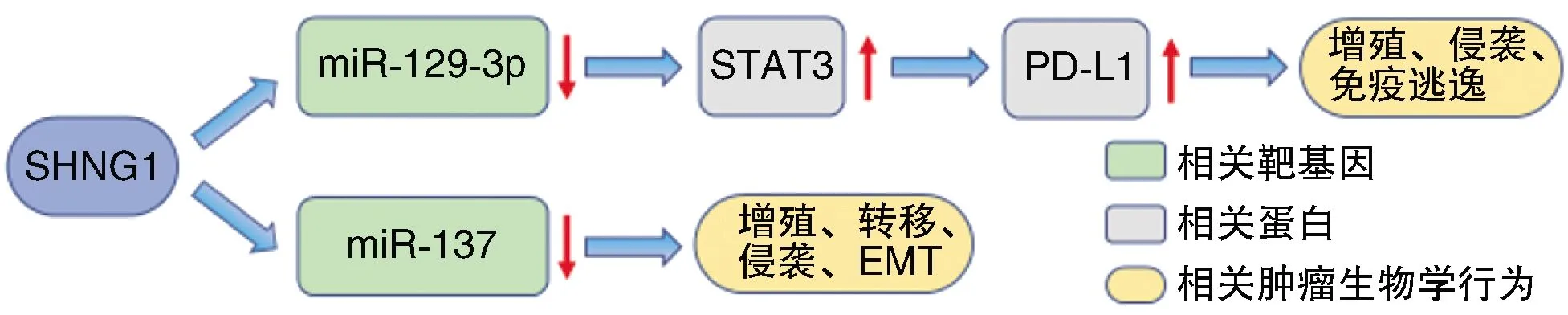
圖1 SNHG1在腎癌中的生物學作用途徑
2 前列腺癌
前列腺癌(prostate cancer,PCa)是老年男性常見的惡性腫瘤性疾病。對于早期前列腺癌,目前其手術治療的療效較為理想,但術后復發(fā)是導致前列腺癌患者總生存率下降的主要原因之一[10]。非編碼RNA可能與前列腺癌的發(fā)病機制有關。
Tang等[11]研究發(fā)現,SNHG1的表達與前列腺癌的TNM分期、Gleason評分、淋巴結侵犯和遠期轉移死亡率明顯相關。Xie等[12]發(fā)現,SNHG1在前列腺癌組織中過度表達,且與預后差有關。然而,miR-377-3p在癌組織中的表達低于癌旁組織,與SNHG1的表達呈負相關。miR-377-3p可部分抑制Akt2基因促進PCa細胞生長和抑制細胞凋亡的作用,而SNHG1過表達則能在一定程度上抑制這一作用。Meng等[13]發(fā)現,SNHG1和miR-195-5p具有結合靶點,且兩者成負相關,而miR-195-5p在前列腺癌中具有抗癌作用,下調miR-195-5p可以促進腫瘤細胞的增殖、侵襲和EMT。Huang等[14]通過生物信息學分析、雙熒光素酶報告基因分析、RNA免疫沉淀和RNA Pull-Down實驗,確定miR-383-5p是SNHG1的靶點,SNHG1可以下調miR-383-5p的表達。而miR-383-5p能通過調節(jié)細胞周期、細胞凋亡、活性、克隆形成和轉移抑制前列腺癌進展[15]。因此,SNHG1通過負調控miR-383-5p的表達促進前列腺癌的增殖、遷移和侵襲。SNHG1通過負性調控miR-199a-3p,上調細胞周期蛋白依賴性激酶7(cyclin-dependent kinase 7,CDK7)表達,從而促進細胞的增殖和細胞周期進程[16]。Chen等[17]發(fā)現,SNHG1和EZH2(enhancer of zeste homolog 2,EZH2)基因在前列腺癌組織中高表達,且兩者表達呈正相關。SNHG1結合EZH2能激活前列腺癌細胞磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白質絲氨酸蘇氨酸激酶(protein serine threonine kinase,Akt)/哺乳動物雷帕霉素靶蛋白(the mammalian target of Rapamycin,mTOR)信號通路和Wnt/β-catenin信號通路,最終抑制腫瘤細胞的自噬和凋亡。SNHG1的表達與PCa患者的預后呈正相關,而EZH2的表達與PCa患者的預后呈負相關。提示SNHG1/EZH2可作為PCa的預后指標。Tan等[18]還發(fā)現,SNHG1與異質性胞核核糖核蛋白L(heterogeneous nuclear ribonucleoprotein L,hnRNP L)相互作用導致鈣黏蛋白E(E-cadherin)表達下調,激活EMT通路,促進PCa的惡性進展。EMT是一個動態(tài)過程,導致上皮細胞獲得間質特性,從而增加遷移和侵襲能力,使早期癌癥向侵襲性癌癥過渡,而E-cadherin的丟失是啟動EMT的關鍵步驟,最終導致PCa的腫瘤轉移。
SMHG1通過一系列潛在機制(圖2)影響著前列腺癌細胞的增殖、凋亡、自噬、EMT等過程,最終促進前列腺癌的增殖與遷移。
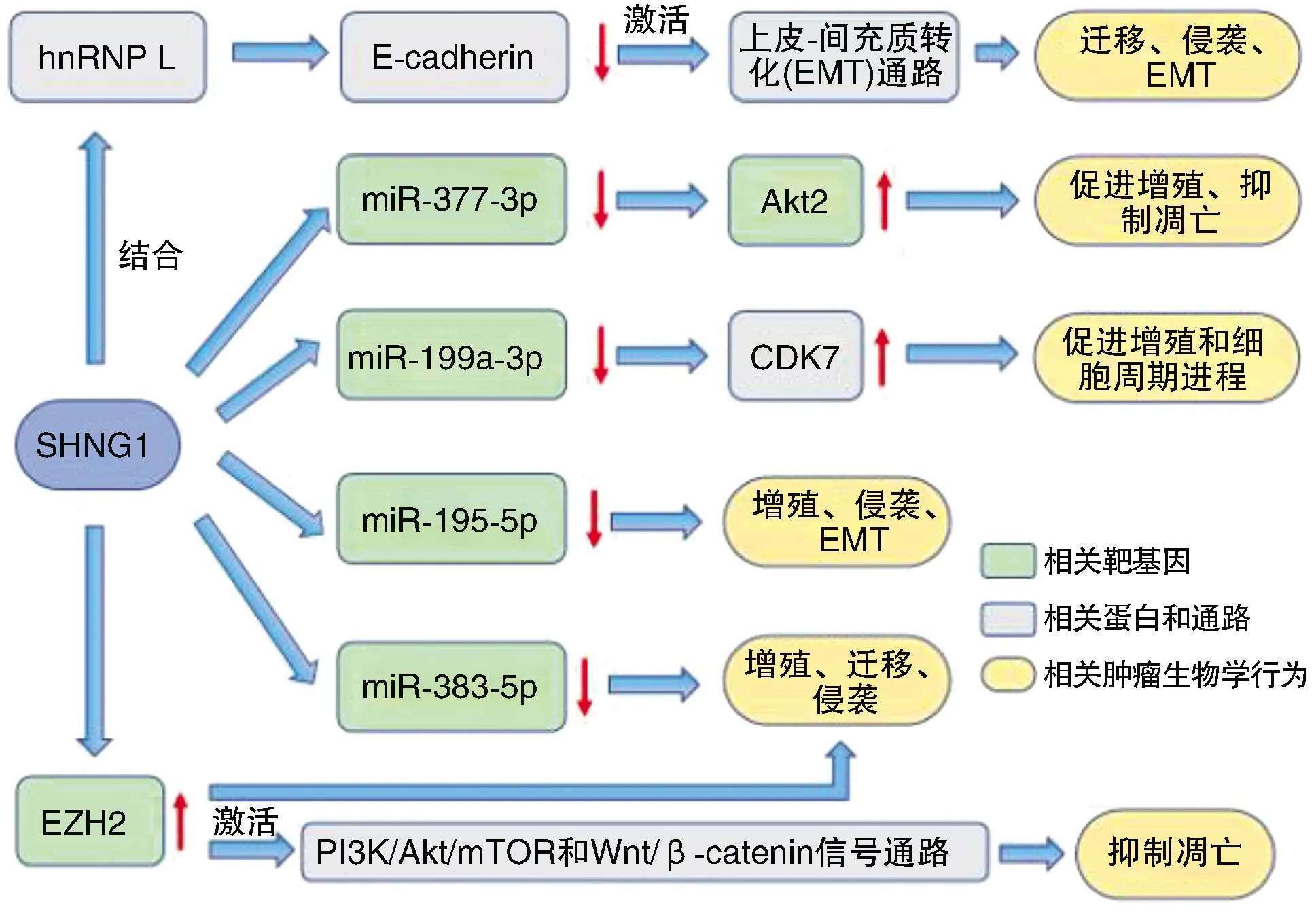
圖2 SNHG1在前列腺癌中的生物學作用途徑
3 膀胱癌
膀胱癌(bladder cancer,BC)包括非肌層浸潤性膀胱癌(non-muscle invasive bladder cancer,NMIBC)和肌層浸潤性膀胱癌(muscle invasive bladder cancer,MIBC)。MIBC的標準治療方法是根治性膀胱切除術,其5年生存率僅為50%[19]。
Xu等[4]發(fā)現,SNHG1在人類BC侵襲過程中起著重要作用。SNHG1基因敲除可顯著抑制MIBC癌細胞的侵襲。相反,SNHG1的過表達導致癌細胞侵襲力顯著增加。SNHG1可通過提高基質金屬蛋白酶2(Matrix metalloproteinase 2,MMP2)的轉錄和MMP2 mRNA穩(wěn)定性而特異性地誘導MMP2的表達。MMP2是一種蛋白酶,在癌細胞分解細胞外基質的過程中是必不可少的,能促進癌細胞的侵襲[20]。SNHG1誘導MMP2表達可能存在兩種機制。①SNHG1直接與蛋白磷酸酶2A(protein phosphatase 2A,PP2A)催化亞基(PP2A-c)結合,抑制PP2A-c與c-jun基因的相互作用,進而促進c-jun磷酸化,介導MMP2轉錄。②SNHG1通過誘導自噬,導致miR-34a降解,降低了miR-34a與MMP2 mRNA的3′UTR的總結合,從而促進了MMP2 mRNA的穩(wěn)定。Xiang等[21]研究發(fā)現,SNHG1在BC組織和細胞中顯著上調,并與BC患者的TNM分期、淋巴浸潤、轉移和無復發(fā)生存密切相關。SNHG1表達下調可顯著抑制BC細胞的增殖、遷移、侵襲和EMT。在細胞質中,SNHG1通過內源性競爭調節(jié)miR-143-3p的表達來增強HK2基因的表達,從而促進BC細胞的增殖。在細胞核內,SNHG1可以與EZH2相互作用,抑制CDH1基因的表達,從而促進BC細胞的遷移、侵襲和轉移。Guo等[22]發(fā)現,SNGH1高表達與膀胱癌細胞的自噬、侵襲和增殖成正相關,自噬抑制劑3-甲基腺嘌呤(3-MA)可部分或全部抑制SNHG1誘導的細胞侵襲和增殖,表明SNHG1通過自噬促進膀胱癌細胞的侵襲和增殖。SNHG1在膀胱癌中通過海綿吸附miR-493-5p來抑制其與ATG14mRNA的3′-UTR結合,從而促進自噬相關蛋白ATG14的表達。SNHG1過表達能通過miR-493-5p/ATG14/自噬途徑促進膀胱癌細胞的自噬、增殖和侵襲。但與Chen等[17]研究的SNHG1促進腫瘤發(fā)生發(fā)展的結論相反。以往研究報告,自噬在腫瘤抑制和腫瘤促進中有著矛盾的作用,其相關分子機制與腫瘤的發(fā)展階段、外部環(huán)境等多種因素有關[23-25]。此外,Du等[26]研究表明,SNHG1的過表達還可通過激活PI3K/Akt信號通路促進膀胱癌細胞的增殖、遷移和侵襲。
SNHG1與膀胱癌的發(fā)病機制密切相關,參與一系列腫瘤生物學行為的調控(圖3)。SNHG1在不同亞細胞位置的不同調控機制為抑制BC進展提供了治療選擇。
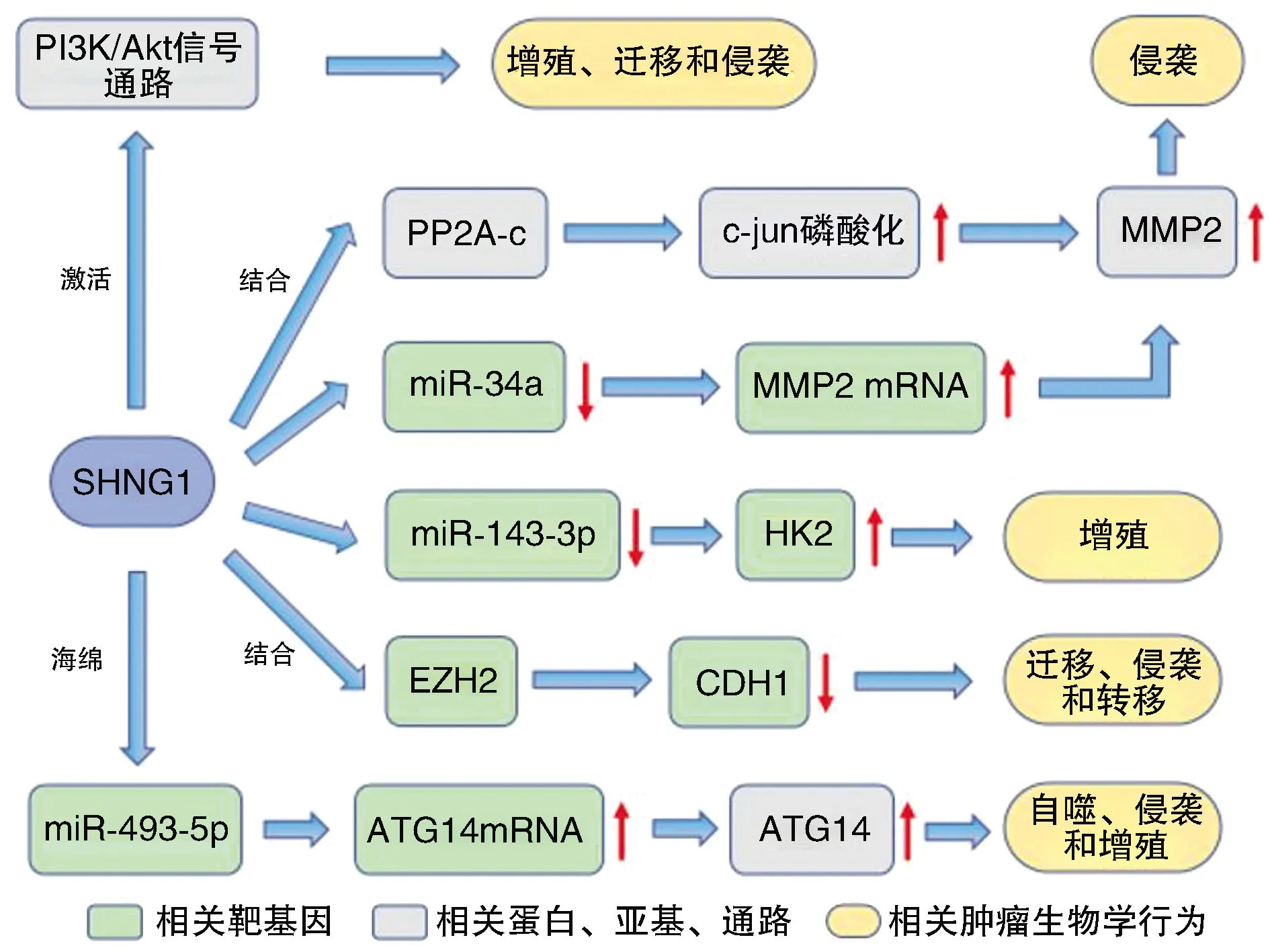
圖3 SNHG1在膀胱癌中的生物學作用途徑
4 總結與展望
lncRNAs是腫瘤的形成和發(fā)展過程中重要的調節(jié)因子,并在惡性腫瘤中扮演著不同的角色。隨著lncRNAs在腫瘤中的研究不斷深入,其在泌尿男生殖系統(tǒng)腫瘤發(fā)生發(fā)展中的作用值得不斷探討和總結。其中SNHG1是一個新發(fā)現的癌基因,在多種人類腫瘤中表達異常。此外,SNHG1還參與細胞的增殖、遷移、侵襲、轉移、凋亡、EMT和自噬等過程。在腎癌、前列腺癌、膀胱癌中,SNHG1介導其作用的分子功能和細胞機制是復雜的,涉及多個因素。這些分子機制對泌尿男生殖系統(tǒng)腫瘤的臨床診斷、治療、預后和疾病進展有重要意義。然而,SNHG1參與癌癥發(fā)展涉及許多復雜機制,其詳細的下游分子機制以及網絡調控機制仍有待闡明,SNHG1的臨床應用及相關途徑尚需進一步研究。

