LOXL2與心血管疾病關系的研究進展
孫陳琛, 邵晨, 杜榮增
(江蘇大學附屬醫院心內科,江蘇省鎮江市 212001)
心血管疾病(cardiovascular disease,CVD)嚴重威脅人類的健康,是導致中國人口死亡的首要原因[1]。賴氨酰氧化酶樣蛋白2(lysyl oxidase-like 2,LOXL2)是賴氨酰氧化酶家族的一員,LOXL2功能失調與許多心血管疾病有關[2],LOXL2或許可以成為治療CVD的新靶點。本文就LOXL2在心血管疾病中的研究進展進行綜述,以期為治療心血管疾病提供新的思路。
1 LOXL2的結構和功能
LOXL2基因定位于人染色體8p21.3,編碼區由14個外顯子和13個內含子組成[3]。LOXL2的C-末端保守性較高,包含銅結合位點、賴氨酸酪氨酰醌殘基(lysine tyrosylquinone,LTQ)和細胞因子受體結構域(cytokine receptor-like domain,CRL),而保守性較低的N-末端則含有4個富含半胱氨酸的清道夫受體結構域(scavenger receptor cysteine-rich domains,SRCR)[4]。Zhang等[5]在2018年首次揭示了人賴氨酰氧化酶樣蛋白2(human lysyl oxidase-like 2,hLOXL2)前體狀態的晶體結構,發現hLOXL2的整體結構呈三角形,SRCR3、SRCR4和催化結構域分別占據三角形的一角,銅結合序列和LTQ位于由3個α螺旋和14個β折疊結構組成的催化結構域中,當銅結合位點被鋅占據后hLOXL2的酶活性明顯下降,而銅進入后則能穩定地激發hLOXL2的活性。
細胞外基質(extracellular matrix,ECM)由細胞表面或細胞之間的多糖和蛋白質等大分子物質構成,在維持正常組織結構的完整性和穩定性方面起著重要作用。膠原蛋白和彈性蛋白是ECM的重要組成部分,LOXL2通過催化上述兩種蛋白上的賴氨酸殘基,將其交聯成韌性更強的膠原纖維和彈性纖維,從而維持ECM的結構和功能[6]。Martin等[7]發現,敲除小鼠LOXL2基因后,約1/3小鼠在圍生期因嚴重的心臟缺陷而死亡。LOXL2的基礎表達水平對于心臟正常的ECM組成至關重要。LOXL2也廣泛分布于小動脈和主動脈的血管壁中,不僅能催化彈性蛋白交聯促進血管發育[8],還能直接調節IV型膠原和纖連蛋白的沉積,促進血管生成[9]。Neumann等[10]通過沉默內皮細胞中LOXL2基因的表達抑制血管的萌芽。然而當LOXL2基因過表達后可能會使膠原等ECM成分過度沉積,造成心臟、血管等器官的纖維化,最終引起各種心血管疾病。研究發現,LOXL2參與腫瘤細胞的生長、黏附、侵襲和轉移[11]。
2 LOXL2與心血管疾病
LOXL2與心力衰竭、心房顫動、高血壓等心血管疾病之間存在復雜而密切的聯系(圖1)。
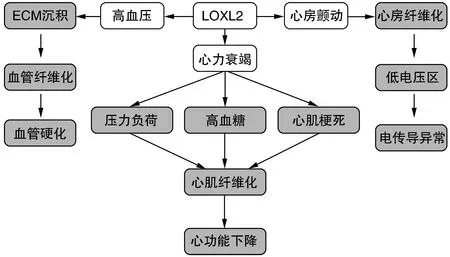
圖1 LOXL2與心血管疾病的關系
2.1 LOXL2與心力衰竭
主動脈弓縮窄(transverse aortic constriction,TAC)常被用來誘導小鼠產生壓力負荷性心力衰竭。Nishimura等[12]在TAC和異丙腎上腺素刺激共同構建的心力衰竭小鼠模型中觀察到了左心室心肌的纖維化,并且發現LOXL2基因表達上調。Yang等[13]在動物實驗中發現,心臟在應激狀態下,間質中的成纖維細胞會大量分泌LOXL2,產生轉化生長因子-β2(transforming growth factor,TGF-β2),刺激成纖維細胞向肌成纖維細胞轉化。同時,LOXL2也可作用于TGF-β2下游,刺激肌成纖維細胞遷移。給予LOXL2抑制性單克隆抗體和敲除LOXL2基因均可減輕心臟纖維化。
糖尿病是CVD發病的危險因素,其通過氧化應激、炎癥和免疫調節功能失調等途徑來誘導心肌間質纖維化,使心臟收縮及舒張功能受限,誘發心力衰竭[14]。Johnson等[15]觀察到糖尿病小鼠血清和心臟組織中的LOXL2水平與左心室舒張功能之間存在明顯的負線性關系,LOXL2或許可以成為診斷糖尿病心肌病的潛在生物標志物。
心肌梗死后,肌成纖維細胞會參與心肌的修復,防止梗死范圍擴大,但同時心肌非損傷區域的成纖維細胞也會增殖,造成心室重構和心力衰竭的發生[16]。Gonzalez-Santamaria等[17]發現,C57BL/6小鼠發生心肌梗死時,LOXL2的表達明顯上升,梗塞區域出現膠原纖維積聚,而使用阻斷抗體對LOX亞型進行抑制后,心肌纖維化程度減輕,心臟重構改善。Schilter等[18]發現,LOXL2/LOXL3抑制劑可減少膠原含量,降低心肌梗死小鼠的心肌纖維化面積,改善射血分數,但不會對正常的膠原交聯產生影響。
綜上所述,心肌纖維化是心臟功能障礙的一個特征,纖維化會導致心室壁彈性下降,使心室收縮和舒張能力減弱,最終導致心力衰竭。當壓力負荷、高血糖等因素長期作用于心臟時,心臟成纖維細胞中的LOXL2基因表達上調,促進成纖維細胞向肌成纖維細胞轉化,肌成纖維細胞合成的大量膠原在心臟間質中沉積,心臟逐漸出現反應性纖維化,最終引起心力衰竭。心肌梗死后,肌成纖維細胞通過瘢痕形成參與心肌的修復,心臟出現替代性纖維化,若纖維化面積較大則容易導致心功能下降。給予LOXL2抑制劑或敲除LOXL2基因也許可以減輕心臟纖維化程度,改善心功能。目前LOXL2抑制劑種類較少,有研究發現,LOXL2抑制劑PAT-1251可顯著降低小鼠肺纖維化,抑制劑已進入健康志愿者I期試驗,成為最先進入臨床試驗的LOXL2抑制劑之一[19]。但PAT-1251是否具有改善心肌纖維化的功能仍未明確,未來還需要大量的動物實驗和多中心大樣本的臨床試驗來驗證。
2.2 LOXL2與心房顫動
心房顫動(atrial fibrillation,AF)是一種常見的心律失常類型,其患病率隨著年齡的增加而增長。心房纖維化與AF密切相關,極易造成心房內激動傳導方向和速度的不均一,從而參與AF的發生與維持[20]。Zhao等[21]發現,陣發性、持續性心房顫動患者血清中的LOXL2含量明顯升高,并且AF患者的平均左心房電壓與血清LOXL2含量呈負相關,而心房電壓標測系統識別到的低電壓區即認為是心房纖維化區域。Zhong等[22]發現,LOXL2在永久性心房顫動患者的心房組織中的表達顯著上調,同時伴隨膠原(I型和III型)的增加。Wu等[23]通過動物實驗發現LOXL2抑制劑可以抑制心房組織中轉化生長因子-β1和I型膠原的表達及Smad2/3的磷酸化,顯著減輕心房炎癥和纖維化,降低AF易感性。由此可見,LOXL2可能通過膠原沉積使心房產生大量纖維化區域,破壞心房正常的電傳導,最終促進AF的發生和維持,而使用LOXL2特異性抑制劑或許可以減慢甚至逆轉這一過程。
心房纖維化的評估包括心肌活檢、心房多極電壓標測、延遲增強磁共振成像(DE-MRI)等。心肌活檢是診斷心肌纖維化最可靠的方法,但因其對心臟有一定的損傷,臨床難于開展。心房電壓標測需將標測導管送入心腔,同樣屬于有創操作,實施較為困難。DE-MRI可操作性較高,但由于其高昂的費用,普遍性不強,臨床上應用較少。因此,尋找能夠快速、準確反映心房纖維化的生物學指標可能會成為未來的一項重大課題。
2.3 LOXL2與高血壓
高血壓的發生、發展與動脈硬化有關[24]。ECM是血管壁的重要組成部分,其過度沉積會導致血管僵硬度增加。Craighead等[25]發現,與同齡血壓正常受試者相比,LOXL2在中年高血壓患者微血管內皮細胞的外基質中表達更高。Steppan等[26]觀察到老年小鼠主動脈中的LOXL2含量較年輕小鼠升高,主動脈血管硬化程度也更高。LOXL2通過促進主動脈纖維化,增加血管僵硬度,進而引起血壓升高,而敲除LOXL2基因則可顯著延緩這一過程。
綜上所述,LOXL2可能通過ECM沉積促進微血管和大血管纖維化,造成血壓升高。LOXL2的表達水平與年齡相關,年齡越大,血管硬化越嚴重,高血壓患病風險越高。目前關于LOXL2與高血壓關系的研究尚少,LOXL2在未來可能成為預測高血壓發生與進展的一個潛在生物標志物。
3 總 結
LOXL2在心血管系統發育過程中起了重要作用,但其過表達會增加細胞外基質的過度沉積,引起心臟、血管纖維化,導致其功能障礙,進而引發一系列心血管疾病。LOXL2引起心血管系統纖維化過程中的信號通路及其分子調控機制尚不明確。特異性LOXL2抑制劑可以顯著減輕心血管系統的纖維化進程,但其具體療效仍需要大規模臨床試驗來支持。目前尚無有效治療心肌纖維化及血管硬化的方法,LOXL2或許可以成為切入點來幫助開發新的治療方案。

