免疫檢查點抑制劑治療同時性雙原發癌1例
和夢珂 郭繼紅 李 霞 孫 健 葛 洋*
(1.北京朝陽中西醫結合急診搶救中心腫瘤綜合治療科,北京100122;2.首都醫科大學附屬北京朝陽醫院腫瘤科,北京 100020)
多原發癌(multiple primary cancer,MPC)是指同一患者患兩個及以上、無相關性的惡性腫瘤,診斷標準多參考1932年Warren等[1]的論述,國內的發生率約為0.46%~4.1%[2]。惡性腫瘤的發生與免疫監察功能紊亂密切相關,免疫逃逸是腫瘤細胞的十大特征之一[3],而多原發癌更與機體免疫功能異常、免疫逃逸關系密切[4]。雙原發癌是最常見的多原發癌[5],其中間隔時間少于6個月的稱為同時性雙原發癌(synchronous carcinoma,SC),超過6個月的稱為異時性雙原發癌(metachronous carcinoma,MC)。免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)已成為癌癥治療領域最有前景的方法之一[6],其中程序性死亡受體-1(programmed cell death-1,PD-1)/程序性死亡受體配體1(programmed cell death-ligand 1,PD-L1)通路在抗腫瘤免疫調節通路上發揮重要作用[7]。
1 病例資料
李某,男性,出生于1954年1月。2019年6月無明顯誘因出現咳嗽、咳痰,痰中帶血,未予診療。2019-09-28行胸部電子計算機斷層掃描(computed tomography,CT)示:左肺門占位,2019-11-05于首都醫科大學附屬北京朝陽醫院行正電子發射計算機斷層顯像(positron emission tomography-CT,PET-CT)檢查示:左肺門不規則軟組織密度團片影及右肺上葉后段近縱隔旁結節影,均伴代謝增高,考慮惡性病變可能性大;左鎖骨下縱隔及雙肺門多發異常腫大淋巴結影,均伴代謝增高,不排除淋巴結轉移;右側股骨近端及右側第6后肋局部骨密度增高,伴代謝增高,不除外骨轉移。2019-11-13行無痛支氣管鏡取病理示:(4R)肺腺癌,ROS-1(-)、BML4-ALK融合基因(-)、EGFR(-),KRAS基因突變檢測結果示:2號外顯子C.34G>T(p.G12C)突變,BRAF基因突變檢測結果示:BRAF基因15號外顯子c.1799T>A(p.V600E)未檢測到突變。2019年11月患者行腸鏡檢查提示直腸癌?,2020-01-02行腹腔鏡下直腸癌根治術,術后病理提示:(直腸)中分化腺癌pT3N0,可見脈管癌栓及神經侵犯,免疫組織化學檢查示:-7:MSH6(+),MSH2(+),PMS2(+),MLH1(+)。2020-04-07復查胸部CT示:肺門區占位明顯增大,詳見圖1。2020-04-13、2020-05-09、2020-06-13、2020-07-08行替雷利珠單抗聯合培美曲塞、順鉑治療共4周期,出現Ⅱ度骨髓抑制白細胞減少、Ⅰ度消化道不良反應惡心伴納差。2020-06-08,2周期替雷利珠單抗聯合培美曲塞、順鉑后復查胸部CT提示:肺門占位明顯縮小。2020-07-25評估胸部CT提示肺門原發灶穩定,右下肺新發轉移灶,詳見圖2,未行穿刺無法評估肺來源抑或直腸來源。2020-07-31開始調整治療方案為替雷利珠單抗聯合貝伐珠單抗治療12周期,2020-09-24,2周期替雷利珠單抗聯合貝伐珠單抗后復查胸部CT:右下肺占位明顯縮小,2021-05-06復查腸鏡未見新發或腫瘤復發。患者因住院就醫困難,自行延長治療間歇期至35~42 d,治療期間患者僅出現G1免疫相關性皮膚不良反應,包括全身散在的皮疹、瘙癢,無水皰、脫屑、苔蘚化,不影響日常生活,皮膚感光敏感,耐受性良好。2021-08-25復查胸腹盆腔CT提示病情平穩,末次隨訪時間2021-10-03,患者生活質量良好。腫瘤診斷治療史簡述見圖3。

圖1 原發病灶變化情況
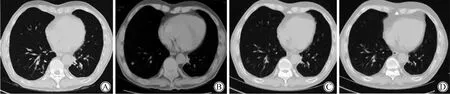
圖2 轉移灶變化情況
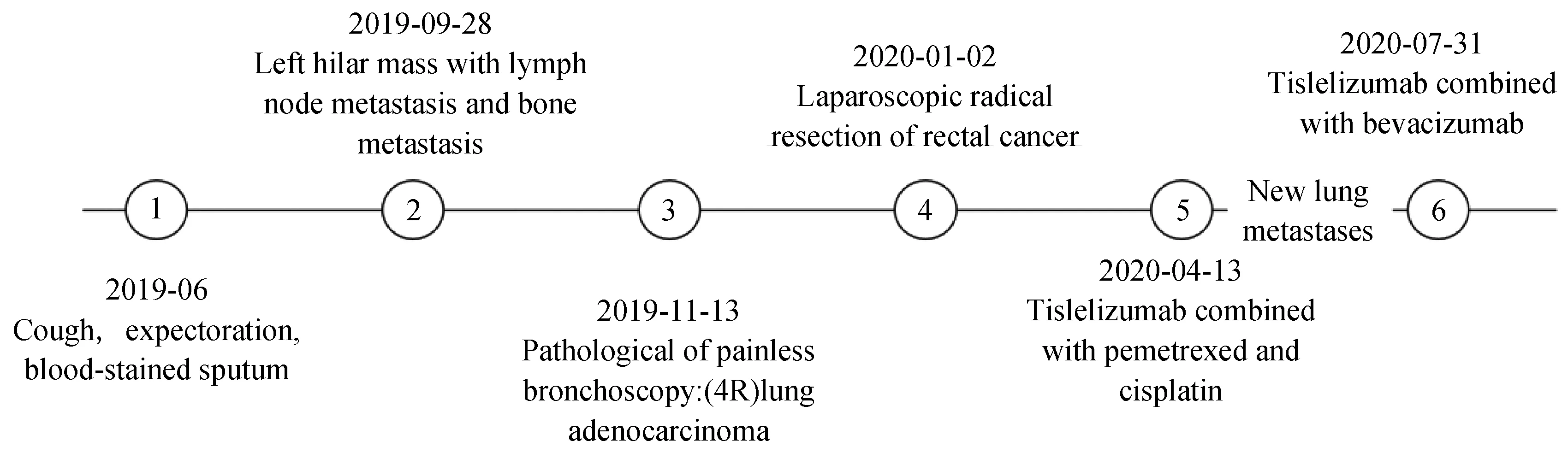
圖3 腫瘤診斷治療史
2 討論
隨著大家對體檢的重視及腫瘤治療領域的進步,多原發癌的檢出率逐年升高[8]。衰老引起的體細胞突變累積及DNA損傷、免疫功能缺陷是引起多原發癌的重要因素,尤其是同時性多原發癌可能攜帶相同基因突變、來源于相同的癌前病變[9],“區域性癌變”理論更是常被用來解釋MPC的發生原因,抑癌基因的種系突變被認為是MPC的潛在驅動因素[10]。
研究[11]顯示,70.87%第二原發癌發生在第一原發癌的2個月后。臨床研究顯示,涉及肺癌的MPC發生率為0.9%至26.3%[12],消化道是多原發癌的好發部位,第二原發癌為消化道腫瘤者約占44%,其中結直腸更是最好發部位[13],其中含肺癌的多原發癌患者中,合并消化道腫瘤者約占71%[14]。Song等[12]從SEER數據庫中提取5 253例涉及肺癌的MPC患者,發現大多數患者為65歲以上的男性,且腺癌的發生頻率最高。
組織胚胎學中指出肺、氣管、呼吸道腺體、消化管大多來源于內胚層,而呼吸道黏膜與腸道黏膜更是構成了公共黏膜免疫系統[15]。p53、KRAS的基因突變與肺癌、腸癌的發生密切相關。機體免疫系統可以識別自己,清除“異己”;對于癌變的細胞,機體通過免疫監視、免疫編輯殺滅腫瘤細胞。當免疫監察功能異常時,可誘導T細胞凋亡,降低對腫瘤細胞的殺傷。王俊等[16]對于前列腺癌并發多原發癌的外周淋巴細胞亞群分布檢測發現,外周CD4+CD25+、CD3-CD(16+56)+亞群淋巴細胞的升高可能是其并發多原發癌的獨立危險因素。
目前,多原發癌臨床沒有統一有效的治療方法,也沒有明確的指南推薦,早發現、早診斷、早治療是改善預后的關鍵[17-21];其中,SC的生存期較短[22]、預后較差,因此對于多原發癌尋求更為有效的治療尤為迫切。PD-1/PD-L1抑制劑是目前應用最廣泛的ICIs,可逆轉免疫逃逸,恢復抗腫瘤免疫[23]。Yasuda等[24]提及1例76歲患有多發性骨髓瘤、原發性胃癌、原發性肺癌的男性患者,使用納武利尤單抗后胃癌、肺癌分別被評估為疾病穩定和部分緩解。
本例患者為肺癌、直腸癌同時性雙原發癌患者,初始治療時期即選擇免疫檢查點抑制劑聯合治療模式;4周期免疫聯合化學藥物治療(以下簡稱化療)后肺原發病灶明顯縮小且穩定,然出現新發周圍型肺轉移灶,患者及家屬拒絕有創傷性穿刺,因此無法明確肺轉移灶來源。4周期化療誘導免疫治療開始起效,恐多次化療損傷患者免疫功能,另外肺部病灶無抗血管生成治療禁忌證,且抗血管生成藥物貝伐珠單抗可調節免疫微環境提高免疫治療療效,因此,二線選擇PD-1聯合貝伐珠單抗。不添加化療的免疫聯合靶向治療方案,減少化療帶來的骨髓抑制及消化道不良反應,使患者的骨髓功能得以修復,提高患者的耐受性。
在使用PD-1/PD-L1過程中會出現免疫相關不良反應(immune-related adverse events,irAEs),其中皮膚相關不良反應是發生率最高的irAEs,皮膚irAEs多數較輕[25],Berner等[26]研究發現,接受PD-1/PD-L1治療的晚期非小細胞肺癌患者出現皮膚irAEs預后相對較好,且差異具有統計學意義。本例患者即出現了輕度免疫相關皮膚不良反應。另外,患者因自身原因延長治療間歇期,治療效果較好且沒有出現嚴重irAEs。
研究[27]顯示,含胃癌的多原發癌不同腫瘤細胞表面PD-L1表達不存在相關性,PD-L1高表達是胃癌多原發癌的獨立危險因素。臨床治療中發現,延長免疫治療間隔時間可能減少免疫相關不良反應發生率。對多原發癌患者進行腫瘤突變負荷(tumor mutation burden,TMB)、PD-L1、微衛星不穩定性(microsatellite instability,MSI)等相關標志物檢測可進一步評估免疫治療對于多原發癌的普適性,有待更進一步的臨床及基礎實驗的證實。

