血液炎癥相關指標在晚期胰腺癌中的預后價值
孫 婧 史幼梧 賈 軍 楊 穎 孫志偉 杜 豐 余 靖 肖艷潔 張曉東
(北京大學腫瘤醫院暨北京市腫瘤防治研究所VIP-Ⅱ病區 惡性腫瘤發病機制及轉化研究教育部重點實驗室,北京 100142)
胰腺癌是惡性程度最高的腫瘤之一,超過50%的患者在初始診斷時已發生遠處轉移,5年生存率不足3%[1]。準確預測患者預后有助于制定合理的治療計劃,有效與患者及家屬溝通治療預期。既往基于臨床特征的預后指標客觀性不足,基于病理特征的預后指標受限于有創活檢組織量少及腫瘤異質性高。外周血炎癥相關指標具有客觀、簡便、無創的優勢,有望成為良好的預后指標。
炎癥應答影響腫瘤的發生、發展,在包括胰腺癌在內的多種實體瘤中,血液炎癥相關指標中性粒細胞-淋巴細胞比值(neutrophil-lymphocyte ratio,NLR),血小板-淋巴細胞比值(platelet-lymphocyte ratio,PLR),淋巴細胞-單核細胞比值(lymphocyte-monocyte ratio,LMR)被證明與預后有關[2-7];系統性炎癥狀態下血管通透性提高,同時肝臟合成白蛋白(albumin,ALB)抑制,導致低ALB血癥,既往研究[8-9]提示,低ALB為胰腺癌預后的危險因素。近年來,聯合炎癥指標建立的預后指標如預后營養指數(prognostic nutritional index,PNI)[10]、紀念斯隆-凱瑟琳癌癥中心首次提出的紀念斯隆-凱瑟琳預后評分(Memorial Sloan Kettering Prognostic Score,MPS)顯示出良好的預后價值[11],但目前尚缺乏公認的炎癥相關預后指標指導晚期胰腺癌的臨床實踐。本研究旨在評估血液炎癥相關指標,并探索聯合炎癥指標在晚期胰腺癌中的預后價值。
1 資料與方法
1.1 臨床資料
2012年7月至2020年10月北京大學腫瘤醫院消化道腫瘤VIP-Ⅱ病區收治的50例晚期胰腺癌患者入選本研究。其中男性34例,女性16例。患者年齡35~78歲,中位年齡60歲。通過電子病歷系統收集患者基線臨床、病理信息資料及外周血炎癥相關指標數值。
1.2 血液炎癥相關指標及計算
記錄病理或細胞學診斷晚期胰腺癌1個月以內,且在接受全身治療前的中性粒細胞絕對值(neutrophil,NEU)、淋巴細胞絕對值(lymphocyte,LYM)、單核細胞絕對值(monocyte,MON)、血小板絕對值(platelet,PLT)及ALB值。NLR=中性粒細胞絕對值/淋巴細胞絕對值,PLR=血小板絕對值/淋巴細胞絕對值,LMR=淋巴細胞絕對值/單核細胞絕對值,PNI=血白蛋白(g/L)+淋巴細胞絕對值(×109/L)×5[10]。
1.3 統計學方法
總生存時間(overall survival,OS)定義為病理診斷晚期胰腺癌至死亡或末次隨訪刪失時間。依據中位生存時間繪制受試者工作特征(receiver operating characteristic, ROC)曲線確定NLR、PLR、LMR、ALB、PNI界值,根據曲線下面積(area under curve, AUC)估計預后因素的準確性。采用Kaplan-Meier法繪制生存曲線,采用Log-rank檢驗進行生存分析。采用Cox比例風險模型進行多因素分析。以P<0.05為差異有統計學意義。使用SPSS 21.0軟件包進行統計分析,使用GraphPad 7.00繪圖。
2 結果
2.1 臨床特征及生存分析
截至末次隨訪時間2021年9月30日,50例患者中48例出現腫瘤相關死亡,2例失訪,中位OS為7.2個月(95%CI:3.568~10.699)。
高齡患者(年齡≥65歲)與其他年齡的患者預后比較差異無統計學意義。患者平均體質量指數(body mass index,BMI)為(21.11±6.46)kg/m2。近半數患者(24例,48%)為胰頭癌,其中一半患者(12例)診斷時伴有黃疸癥狀;肝轉移常見,達70%。性別、原發灶部位、黃疸情況、肝轉移對預后影響無統計學意義。絕大多數患者(42例,84%)在診斷時體力狀態較好,東部腫瘤協作組體力狀況評分(Eastern Cooperative Oncology Group Performance Status,ECOG-PS)0~1分較ECOG-PS≥2分的患者中位OS顯著延長(8.5個月vs1.4個月,P<0.001)。病理信息顯示,5例患者為組織學高分化,23例為中分化,15例為低分化,7例為分化情況不明,中位生存時間分別為13.0、9.5、3.1 和 4.1個月(P=0.003)。絕大多數(42例,84%)患者CA19-9高于正常值上限,CA19-9高于正常值上限者與在正常范圍內患者的預后差異無統計學意義。詳見表1。

表1 患者基線臨床特征及生存分析
2.2 血液炎癥相關指標及臨界值確定
診斷晚期胰腺癌時患者平均NEU、LYM、MON、PLT均在正常范圍內:NEU(5.39±3.28)×109/L[(2~8)×109/L],LYM(1.51±0.77)×109/L[(1~5)×109/L],MON(0.49±0.27)×109/L[(0.2~0.8)×109/L],PLT(240.08±122.14)×109/L[(100~350)×109/L]。絕大多數(46例,92%)晚期胰腺癌患者診斷時ALB尚在正常范圍。
依據中位生存時間繪制ROC曲線(圖1),選取約登指數最高值獲得NLR、PLR、LMR、ALB、PNI臨界值,分別為:NLR=4.5(AUC=0.840,95%CI:0.732~0.948,P<0.001),PLR=138(AUC=0.671,95%CI:0.517~0.826,P=0.038),LMR=4.0(AUC=0.873,95%CI:0.770~0.975,P<0.001),ALB=41.5(AUC=0.726,95%CI:0.582~0.870,P=0.006),PNI=51.0(AUC=0.764,95%CI:0.626~0.903,P=0.001)。

圖1 血液炎癥相關指標ROC曲線
2.3 血液炎癥相關指標生存分析及多因素分析
血液炎癥相關指標中,NLR≥4.5(P<0.001)、PLR≥138(P=0.009)、LMR<4(P<0.001)、ALB<41.5 g/L(P=0.037)提示預后不良。PNI<51顯示出預后不良趨勢,但結果差異無統計學意義(P=0.076)。NLR≥4.5、PLR≥138、LMR<4、ALB<41.5 g/L各計1分,聯合炎癥指標NLR_ALB、PLR_ALB、LMR_ALB評分越高,提示預后越差(P≤0.01)。詳見表2。
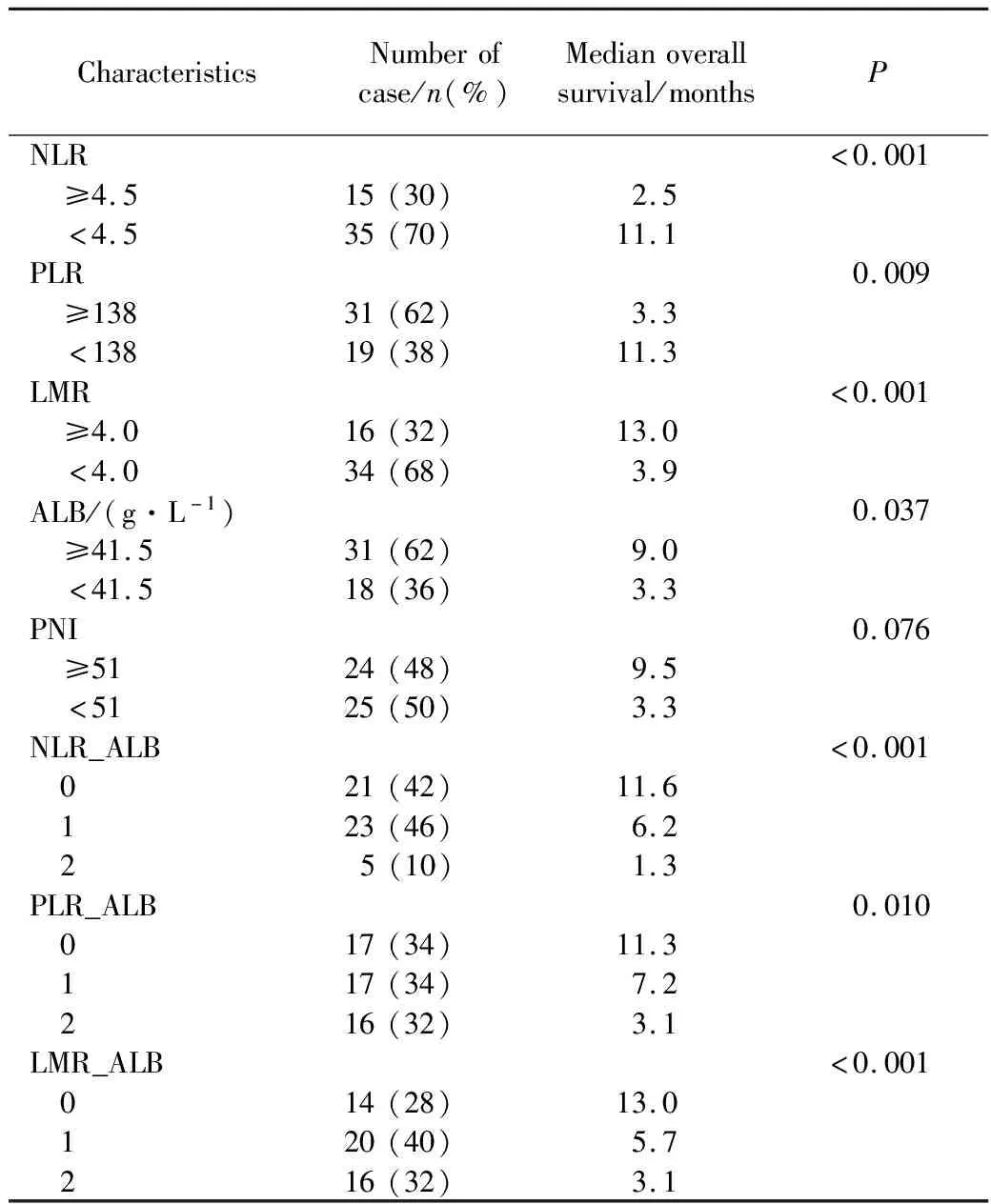
表2 晚期胰腺癌血液炎癥相關指標生存分析
進一步,分別將上述血液炎癥指標與單因素分析中差異具有統計學意義的臨床特征ECOG-PS評分、病理分化程度,以及對血液炎癥指標在生物學上具有潛在影響的年齡、性別納入多因素分析模型,結果顯示:臨床指標中,ECOS-PS評分≥2為晚期胰腺癌預后的獨立危險因素(P<0.05);血液炎癥指標NLR、PLR、LMR、ALB是晚期胰腺癌預后的獨立影響因素,其中NLR≥4.5、PLR≥138、ALB<41.5 g/L為獨立危險因素;LMR≥4為獨立保護因素。詳見表3。
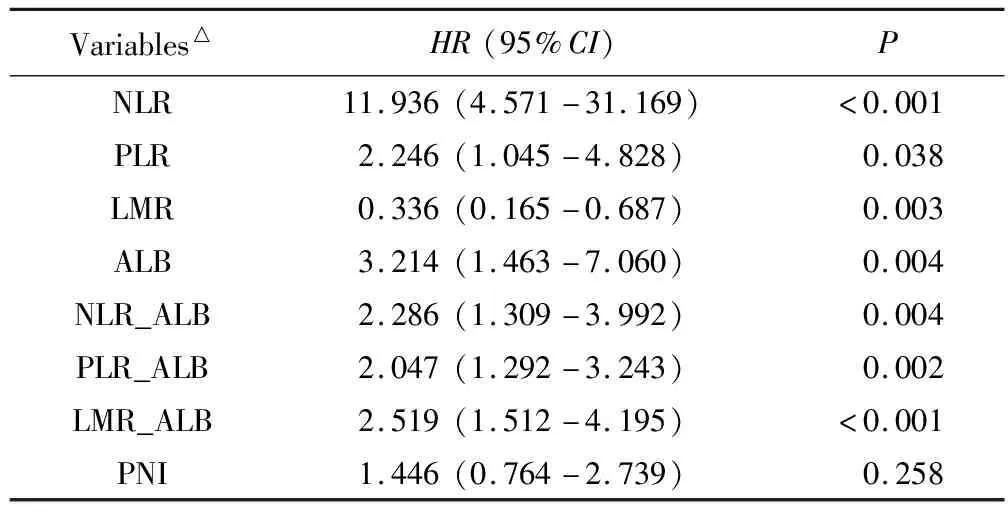
表3 血液炎癥相關指標多因素Cox回歸分析結果
聯合炎癥指標NLR_ALB、PLR_ALB、LMR_ALB評分為獨立危險因素,評分越高,死亡風險越高。PNI不是獨立危險因素。
3 討論
本研究系統評估了血液炎癥相關指標在晚期胰腺癌中的預后價值,結果顯示,NLR、LMR、PLR、ALB為晚期胰腺癌的獨立預后指標,聯合炎癥指標可能進一步指導臨床實踐。
既往基于臨床特征的預后指標中,ECOG-PS 評分和CA19-9是胰腺癌的主要預后因素[12]。胰腺癌惡性程度高,患者容易短期內出現惡病質,體力狀態不佳的患者難以耐受高強度的抗腫瘤治療,即使接受手術或化學藥物治療亦預后欠佳。本研究證實臨床指標ECOG-PS 評分為晚期胰腺癌的獨立預后因素,與既往研究[13-14]一致,但ECOG-PS 評分標準主觀性較強,作為預后指標準確性不足。既往文獻[15-16]報道CA19-9高于正常值上限為胰腺癌的不良預后因素,由于絕大多數晚期胰腺癌患者基線CA19-9高于正常上限(本研究中為88%),以此作為預后指標缺乏臨床指導價值,有待于尋找更為理想的臨界值作為預后指標。
炎癥在腫瘤發生、發展中具有重要意義。炎癥通過誘導基因突變,增加基因組的不穩定性,增強表觀遺傳修飾促進腫瘤發生;腫瘤相關炎癥刺激血管生成,招募調節性T細胞和激活趨化因子,抑制抗腫瘤免疫,促進腫瘤免疫微環境形成,促進腫瘤轉移[17-18]。中性粒細胞在炎癥反應中起關鍵作用,參與腫瘤增殖、侵襲、轉移以及免疫抑制[19-20];相反,淋巴細胞在抗腫瘤免疫中發揮核心作用;血小板則是細胞因子的重要來源,產生轉化生長因子-β(transforming growth factor-β,TGF-β)和血管內皮生成因子(vascular endothelial growth factor,VEGF),通過促進血管生成促進腫瘤增殖;單核細胞,特別是腫瘤相關巨噬細胞也參與腫瘤血管生成、腫瘤浸潤、轉移,抑制抗腫瘤免疫應答。盡管炎癥指標作為預后指標的具體機制不明,既往Meta分析[21-23]顯示,高NLR與較短的中位無進展生存期(progress-free survival period,PFS)及中位OS相關,類似地,高PLR[4-5]、低LMR[6]為晚期胰腺癌預后的危險因素,在本研究中,NLR、PLR、LMR的預后價值得到驗證,預后較好組中位OS在11~13個月,預后較差組中位OS僅為2.5~3.9個月。血液炎癥相關指標的臨界值存在較大爭議[24],目前尚無定論,有待多中心、大樣本的研究明確。ALB不僅反映機體營養狀態,更主要的是反映系統炎癥水平。在腫瘤相關系統炎癥狀態下,肝臟合成更多的急性期蛋白而ALB合成減少,同時血管通透性增加,出現外周血低蛋白血癥,既往有研究[8-9]報道ALB可以作為胰腺癌的獨立預后因素,在本研究中得到驗證。
由于在胰腺癌中高NLR和低ALB均為預后的獨立危險因素,MPS評分同時聯合評估二者,顯示出良好的預后價值[11],本研究首次對MPS進行了外部數據驗證,由于入組人群差異,本研究中NLR_ALB炎癥指標的臨界值選擇有差異,生存分析結果顯示,NLR_ALB與單獨的NLR、ALB檢測相比,可有效將晚期胰腺癌患者預后分為3組,中度危險組生存時間與中位OS接近,有助于指導臨床實踐,本研究首次探索了LMR_ALB、PLR_ALB作為晚期胰腺癌的預后價值,顯示出與NLR_ALB相似的預測能力。這些結果說明聯合炎癥指標能進一步優化對晚期胰腺癌患者預后的預測,在臨床實踐中具有良好的應用潛力,但鑒于單一炎癥指標已有較好的預測能力,便捷性略遜于單一炎癥指標。PNI由聯合淋巴細胞和ALB進行運算得到,低PNI說明存在淋巴細胞減少和/或低白蛋白血癥,在既往研究[10]中證實為胰腺癌預后的不良因素,但在本研究中未顯示出良好的預后價值。
綜上所述,血液炎癥相關指標NLR、LMR、PLR、ALB可以作為晚期胰腺癌的預后指標,聯合炎癥指標可以進一步優化預后預測,有助于簡便、迅速地評估預后,指導治療決策,具有較高的臨床應用價值。

