植物乳桿菌對頭孢氨芐耐藥性進化及益生性狀穩定性評價
吳阿敏,張富新*,吳珊,何晨
1(陜西師范大學 食品工程與營養科學學院,陜西 西安,710119)2(西安銀橋乳業(集團)有限公司,陜西 西安,710075) 3(咸陽市產品質量監督檢驗所,陜西 咸陽,712000)
頭孢氨芐是一種β-內酰胺類抗生素,具有廣譜抗菌性和低毒性,廣泛應用于治療由細菌引起的呼吸道、皮膚、泌尿道以及胃腸道等感染性疾病[1]。然而由于抗生素的廣泛使用或過度使用,使其在治療過程中對細菌產生一定的耐藥性,造成一些公共安全問題。目前有關抗生素耐藥性研究大多集中在致病菌,一旦致病菌獲得耐藥性就會造成臨床治療的失敗[2]。隨著人們對細菌耐藥性研究的逐漸深入,益生菌耐藥性的研究已受到人們的關注[3],當益生菌獲得耐藥性后,也許會對其益生效果產生積極作用,尤其是當益生菌與抗生素聯合應用時,更有利于益生菌發揮益生作用。據報道,通過抗生素和益生菌的聯合應用能協同治療腸道腹瀉、結腸炎、炎癥性腸病等相關疾病[4]。已有研究將植物乳桿菌、鼠李糖乳桿菌、嗜酸乳桿菌和雙歧桿菌與甲硝唑或萬古霉素聯合應用在治療腸道疾病中,也取得一定的效果[5],這進一步促進了益生菌的應用。
植物乳桿菌是人體胃腸道中的一種固有益生菌,具有改善腸道菌群,抑制致病菌生長繁殖,促進腸道營養物質吸收利用的作用[6],廣泛應用于各種發酵食品及保健食品中[7]。要發揮共生菌的益生效果,益生菌必須經過胃液的酸性環境和腸道的高膽鹽環境,并能在腸道中定植[3],大多數益生菌對抗生素是敏感的[7],當有抗生素存在時,抗生素在殺死致病菌的同時也會導致益生菌的死亡,從而影響益生菌的效果。通過馴化可有效提高益生菌的耐藥性[8],然而益生菌在獲得耐藥性的同時,其益生特性也許會發生相應改變,從而影響其益生效果。因此,本研究通過實驗室進化方法將植物乳桿菌在頭孢氨芐中進行耐藥性馴化,并對進化菌株的益生特性進行評價,同時應用全基因組測序技術檢測進化過程中菌株的基因突變,為植物乳桿菌與抗生素的聯合應用提供基礎。
1 材料與方法
1.1 實驗材料
植物乳桿菌(ATCC 14917),中國普通微生物菌種保藏管理中心;金黃色葡萄球菌(ATCC 6538)、大腸桿菌(ATCC 8739)、沙門氏菌(CMCC 50071)、單核細胞增生李斯特菌(ATCC 15313),中國工業微生物菌種保藏管理中心;頭孢氨芐,美國Sigma-Aldrich公司;de Man Rogosa Sharpe(MRS)培養基、Luria-Bertani(LB)培養基,北京奧博星生物技術有限責任公司;ISO(ISO-SENSITEST BROTH)培養基,英國oxoid公司;LSM培養基由90% ISO培養基和10% MRS培養基組成;牛膽鹽、氯仿、二甲苯和乙酸乙酯均為分析純,天津市天力化學試劑有限公司。
MRS培養基(g/L):蛋白胨10、葡萄糖20、乙酸鈉5、硫酸鎂0.2、硫酸錳0.05、牛肉粉5、酵母粉4、磷酸氫二鉀2、檸檬酸三銨2、吐溫80 1 mL,pH 6.2±0.2。
LB培養基(g/L):胰蛋白胨10、酵母提取物5、氯化鈉10,pH 7.0。
ISO培養基(g/L):水解酪蛋白11、蛋白胨3、葡萄糖2、氯化鈉3、可溶性淀粉1、磷酸氫二鈉2、乙酸鈉1、甘油磷酸鎂0.2、葡萄糖酸鈣0.1、硫酸鈷0.001、硫酸銅0.001、硫酸鋅0.001、硫酸亞鐵0.001、氯化錳0.002、甲萘醌0.001、氰鈷胺0.001、L-半胱氨酸鹽酸鹽0.02、L-色氨酸0.02、吡哆醇0.01,pH 7.4±0.2。
1.2 菌株的培養條件
菌株的培養條件按照ISO 10932/IDF223[9]的標準方法進行。菌株以1%接種量加入MRS培養基中經37 ℃,24 h培養進行活化,活化后的菌株以1%接種量在LSM培養基中經37 ℃,24 h傳代培養,進行菌株的耐藥性測定和實驗室進化。
在進行菌株益生特性的測定時,將活化后的菌株在5 000×g下離心10 min,然后用0.9%(質量分數)的滅菌生理鹽水將沉淀洗滌3次,再重懸于0.9%的滅菌生理鹽水中,調整菌液濃度為109CFU/mL后進行測定。
1.3 菌株耐藥性的測定
菌株耐藥性測定按照ISO 10932/IDF223[9]中的標準方法進行,菌株的耐藥性用最低抑制濃度(minimum inhibitory concentration,MIC)表示。首先用LSM培養基配制頭孢氨芐質量濃度為8 192 μg/mL的儲備液,用0.22 μm的濾膜過濾,頭孢氨芐質量濃度的檢測范圍為1~256 μg/mL,儲備液用LSM培養基進行2倍梯度稀釋。將活化后的菌株用LSM培養基稀釋500倍,按照1%接種量接入含不同濃度頭孢氨芐的稀釋液中,在37 ℃下培養48 h后觀察無肉眼可見細菌生長對應的最低抗生素濃度作為菌株的MIC值。
1.4 實驗室進化
為了獲得高耐藥性的菌株,在實驗室進化中選用半抑制濃度(IC50)作為菌株傳代時抗生素的初始濃度,IC50是指能夠抑制50%菌株生長的抗生素濃度[10]。本實驗中,菌株在MRS培養基中經37 ℃活化24 h后,按1%接種量接入含8 μg/mL頭孢氨芐的LSM培養基中,在37 ℃培養24 h,連續培養5 d,然后每5 d將LSM培養基中抗生素濃度增加1.5倍,繼續培養進化,直到MIC值保持穩定,其中每5 d測定1次MIC值。為了探究菌株耐藥性的穩定性,將獲得的耐藥性穩定的菌株在不含頭孢氨芐的LSM培養基中繼續傳代培養,并再次測定其MIC值直到穩定。
1.5 菌株益生特性的測定
1.5.1 菌株耐酸和耐膽鹽能力的測定
菌株耐酸能力的測定按照SUI等[11]的方法進行。用6 mol/L的鹽酸將MRS培養基pH調整為2.0、3.0、4.0,將活化后的菌株以1%的接種量接種于不同pH的MRS培養基中,在37 ℃培養3 h,用MRS瓊脂培養基在37 ℃培養24 h后進行菌落計數。
菌株耐膽鹽能力的測定按照SUI等[11]的方法進行。在MRS培養基中加入牛膽鹽,使膽鹽質量濃度達到0、1、3、5 g/L,將活化后的菌株以1%的接種量接種于不同牛膽鹽濃度的MRS培養基中,37 ℃培養3 h,用MRS瓊脂培養基在37 ℃培養24 h后進行菌落計數。
1.5.2 菌株黏附能力的測定
菌株的黏附能力用細胞疏水性和自凝集能力評價[12]。
細胞疏水性的測定采用PATEL等[12]的方法。將活化后的菌株按1%接種量接入PBS緩沖液(0.1 mol/L,pH 7.2)中,測定菌懸液在600 nm處的吸光度作為A0,然后將菌懸液與等體積的氯仿、二甲苯和乙酸乙酯混合,渦旋振蕩5 min,然后靜置30 min,直至混合物分層,在600 nm處測量水相吸光度作為A30。細胞疏水率計算如公式(1)所示:
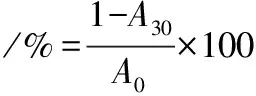
(1)
菌株自凝集能力的測定采用COLLADO等[13]的方法。將活化后的菌株懸浮在PBS緩沖液(0.1 mol/L,pH 7.2)中,用PBS緩沖液將吸光度(OD600nm)調節至0.25±0.05,然后在37 ℃靜置,在靜置2、16、20、24 h時,測量其在600 nm處的吸光度。自凝集率計算如公式(2)所示:
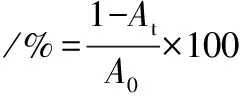
(2)
式中:At代表2、16、20、24 h的OD600nm值;A0代表0 h的OD600nm值。
1.5.3 菌株抑菌能力的測定
采用牛津杯法測定菌株的抑菌能力[14]。將活化后的菌液在5 000×g離心10 min,上清液用0.22 μm濾膜過濾得到無細胞上清液。指示菌活化后在5 000×g離心10 min,重懸于無菌生理鹽水中,調節指示菌濃度至106CFU/mL,分別涂布于LB瓊脂培養基中,室溫下放置10 min后用牛津杯[內徑(5.1±0.1)mm,外徑(7.1±0.1)mm]均勻打孔。將無細胞上清液100 μL 加入打好的孔中,37 ℃培養24 h,利用游標卡尺測量抑菌圈的直徑。
1.6 菌株全基因組測序分析
通過對實驗室進化后的菌株進行全基因組測序,并與原始菌株基因相比,檢測與耐藥性和益生特性相關的突變基因。細菌DNA提取試劑盒(Qiagen,Valencia,CA,美國)提取樣品的基因組DNA,采用微量紫外分光光度計和瓊脂糖凝膠電泳法測定基因組DNA的濃度和純度。提取的DNA樣品在Illumina HiSeq 2500平臺上進行測序,使用CLC Genomics Workbench v12.0軟件進行質量控制、修剪、參考序列匹配、去重復、突變檢測和產物注釋,得到的數據用于生物信息學分析[15]。
1.7 數據統計分析
所有實驗重復測定3次,所得數據用Excel軟件進行統計分析,并利用DPS數據處理系統進行差異顯著性分析,用Origin Pro 8.5軟件進行繪圖,數據表示為平均值±標準差。
2 結果與分析
2.1 植物乳桿菌對頭孢氨芐耐藥性的進化
植物乳桿菌在有頭孢氨芐和無頭孢氨芐條件下的耐藥性進化結果見圖1。
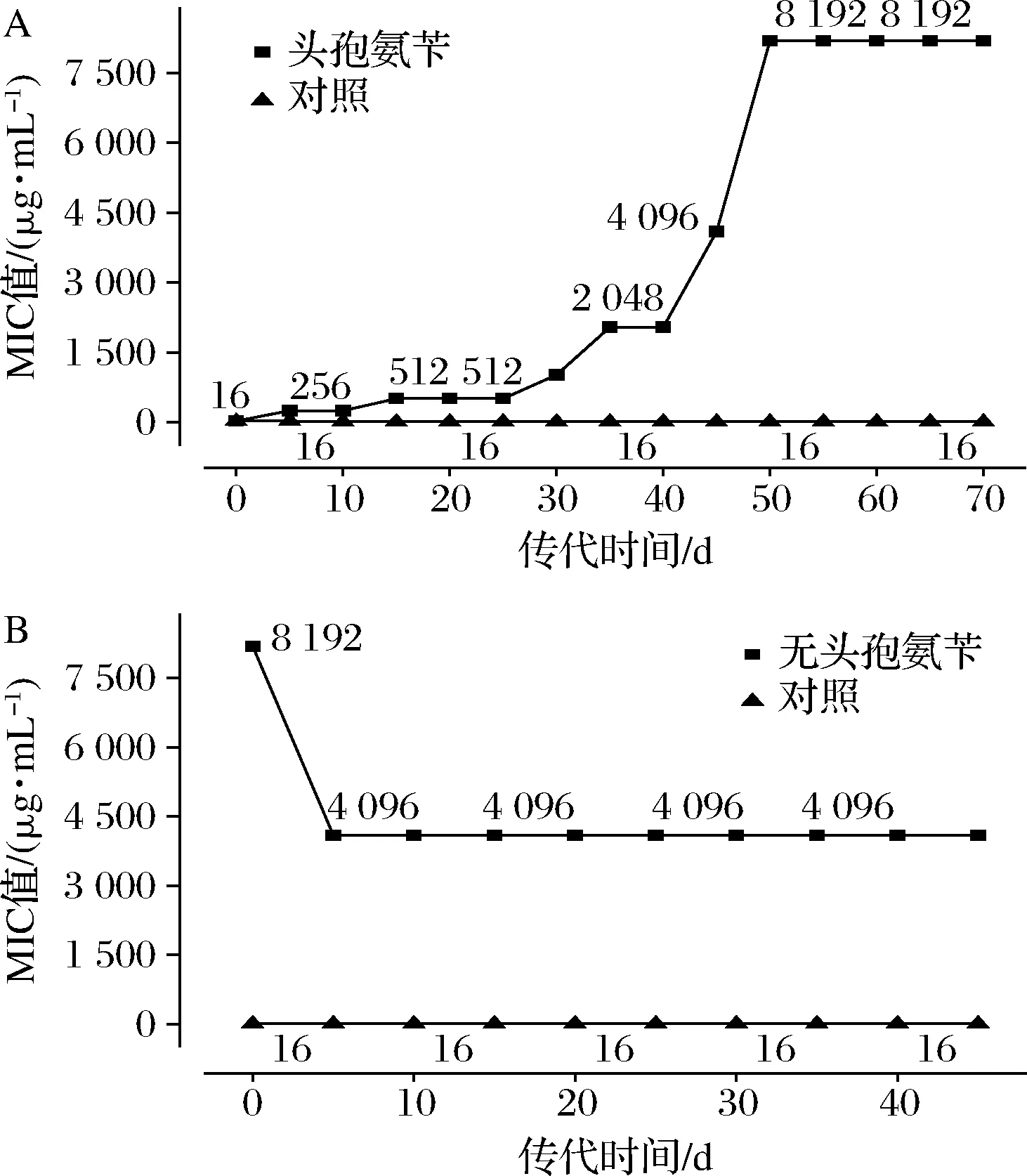
A-有頭孢氨芐;B-無頭孢氨芐圖1 植物乳桿菌在有、無頭孢氨芐的培養基中的耐藥性Fig.1 The resistance of Lactobacillus plantarum in medium with or without cephalexin注:對照為在無頭孢氨芐的LSM培養基中傳代的原始菌株
由圖1可知,頭孢氨芐對植物乳桿菌的初始MIC值為16 μg/mL,在頭孢氨芐的存在下植物乳桿菌的MIC值逐漸提高,在進化50 d后植物乳桿菌的MIC值達到最大,為8 192 μg/mL,繼續傳代時MIC值保持穩定。為探究高耐藥菌株的穩定性,將在頭孢氨芐中傳代后得到的菌株在去除頭孢氨芐的培養基中繼續傳代培養(圖1-B),發現菌株的MIC值在傳代初期顯著降低,經過5 d適應后,菌株的MIC值降至4 096 μg/mL,但在此后保持穩定。原始菌株(對照)在傳代過程中MIC值為16 μg/mL,一直保持穩定。與原始菌株的MIC值相比,在有頭孢氨芐條件下植物乳桿菌的MIC值提高了512倍,而在無頭孢氨芐條件下植物乳桿菌的MIC值雖然有所降低,但比原始菌株也提高了256倍,這表明通過實驗室進化植物乳桿菌對頭孢氨芐耐藥性的獲得是不可逆的。
對植物乳桿菌進化期間的耐藥性檢測(表1)發現植物乳桿菌原始菌株為敏感型菌株,進化后的LpR′和LpR菌株都表現出高的耐藥性,這也進一步說明通過實驗室進化可獲得高耐藥型菌株。

表1 植物乳桿菌進化期間對頭孢氨芐的耐藥性Table 1 The resistance of Lactobacillus plantarum to cephalexin during evolution
2.2 植物乳桿菌進化過程中益生特性的變化
2.2.1 植物乳桿菌的耐酸能力
植物乳桿菌進化過程中耐酸能力變化見圖2。隨著pH的降低,菌株活菌數有逐漸降低的趨勢,尤其是當pH為2時活菌數顯著降低。然而在相同pH條件下,原始菌株(Lp0)與在有頭孢氨芐傳代的高耐藥性菌株(LpR′)和無頭孢氨芐傳代的高耐藥性菌株(LpR)之間無顯著差異(P>0.05),這表明植物乳桿菌在進化期間的耐酸能力保持穩定,不受進化過程的影響。
2.2.2 植物乳桿菌的耐膽鹽能力
植物乳桿菌進化過程中耐膽鹽能力變化見圖3。隨著培養基中膽鹽濃度的增加,菌株的存活率逐漸降低,但在相同膽鹽濃度的培養基中,植物乳桿菌原始菌株(Lp0)與在有頭孢氨芐傳代的高耐藥性菌株(LpR′)和無頭孢氨芐傳代的高耐藥性菌株(LpR)之間的存活率無顯著性差異(P>0.05),表明植物乳桿菌在進化后的耐膽鹽能力穩定。
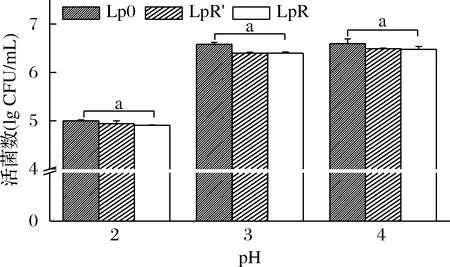
圖2 植物乳桿菌在進化期間耐酸能力的變化Fig.2 Changes in acid tolerance of Lactobacillus plantarum during evolution注:Lp0為原始菌株;LpR′為在頭孢氨芐條件下傳代的高耐藥性菌株; LpR為在去除頭孢氨芐后傳代的高耐藥性菌株;a表示差異不顯著 (P>0.05)(下同)
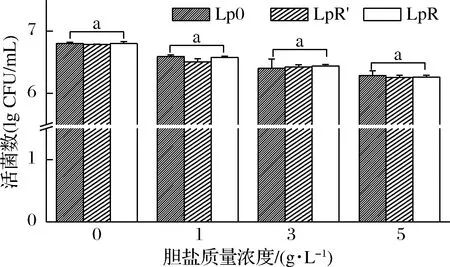
圖3 植物乳桿菌在進化期間耐膽鹽能力的變化Fig.3 Changes in bile salts tolerance of Lactobacillus plantarum during evolution
2.2.3 植物乳桿菌的黏附能力
植物乳桿菌進化期間菌株的黏附特性用菌株的疏水性和自凝集能力來評價[12]。由表2可以看出,原始菌株(Lp0)和進化菌株(LpR′和LpR)的自凝集率在培養不同時間有一定的變化,在培養2 h時,Lp0、LpR′和LpR菌株的自凝集率較低,但在培養16、20、24 h后,菌株的自凝集率均有不同程度的提高。但在培養相同時間時,Lp0、LpR′和LpR菌株之間無顯著差別(P>0.05),表明植物乳桿菌在進化后自凝集能力保持穩定。菌株在二甲苯、氯仿和乙酸乙酯溶劑中的疏水率有一定的差別,原始菌株的疏水率較低,但通過進化后的LpR′和LpR菌株的疏水率均有不同程度提高(P<0.05),且進化后的LpR′和LpR菌株間無顯著差異(P>0.05),這表明植物乳桿菌在進化后的疏水性有所提高。
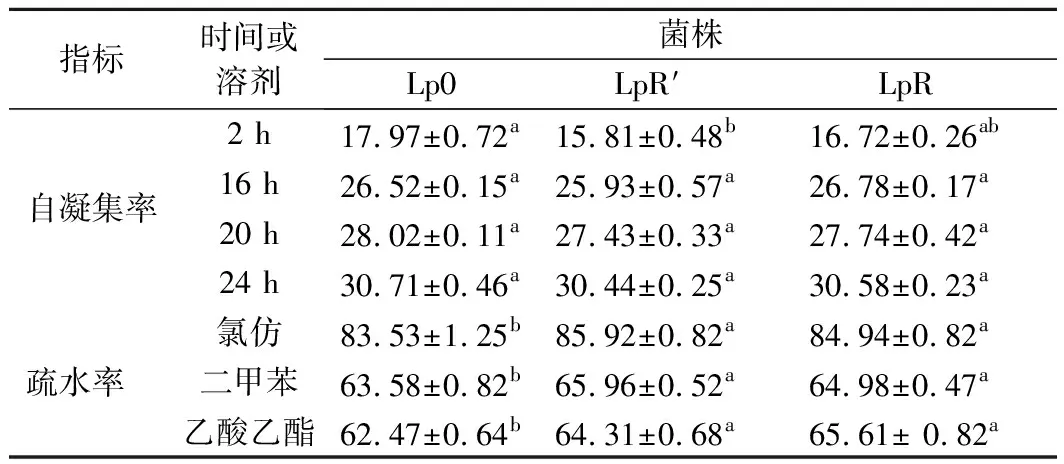
表2 植物乳桿菌進化期間的細胞疏水性和自凝集能力 單位:%
2.2.4 植物乳桿菌的抑菌能力
植物乳桿菌進化期間菌株的抑菌能力見表3。植物乳桿菌對2種革蘭氏陽性(G+)菌和2種革蘭氏陰性(G-)菌均有一定的抑制作用。植物乳桿菌原始菌株(Lp0)的抑菌圈直徑較大,具有較強的抑菌能力。通過進化后的LpR′和LpR菌株對4種致病菌也具有較好的抑菌性。與原始菌株(Lp0)相比,進化后的LpR′和LpR菌株對金黃色葡萄球菌(G+)抑制效果有所提高,而對大腸桿菌(G-)的抑制效果有輕微降低。總體而言,植物乳桿菌在進化后對單核細胞增生李斯特菌、金黃色葡萄球菌、大腸桿菌和沙門氏菌4種致病菌的抑制效果基本穩定。
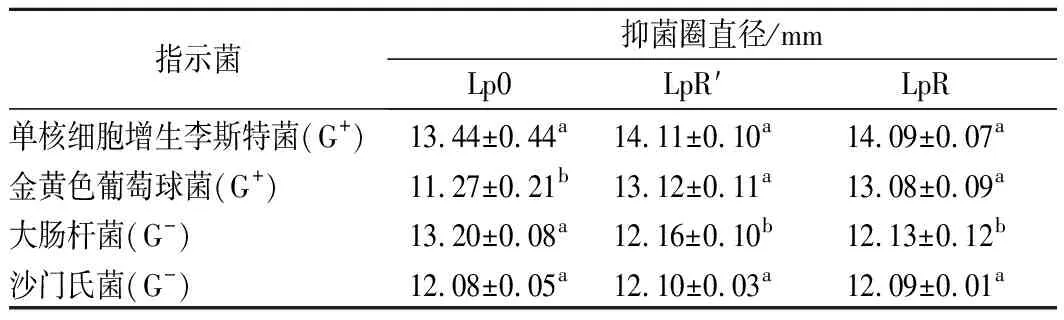
表3 植物乳桿菌進化期間的抑菌能力Table 3 Antimicrobial properties of Lactobacillus plantarum during evolution
2.3 植物乳桿菌進化菌株突變基因的分析
通過對植物乳桿菌進化后獲得的高耐藥性菌株LpR進行全基因組測序,并與原始菌株的基因序列比較,檢出與耐藥性和益生特性相關的突變基因及突變產物(表4)。在LpR菌株中共檢測到3種與頭孢氨芐相關的基因突變,其突變產物分別為耐藥性MFS轉運體(drug resistance MFS transporter)、絲氨酸型D-Ala-D-Ala羧肽酶(serine-typeD-Ala-D-Ala carboxypeptidase)和推定折疊酶蛋白PrsA2(putative foldase protein PrsA2)。同時,在LpR菌株中也檢測到2種與益生特性相關的基因突變,其突變產物分別為YibE/F樣蛋白(YibE/F-like protein)和推定折疊酶蛋白PrsA2(putative foldase protein PrsA2)。這些突變基因編碼的突變產物在植物乳桿菌進化過程中對其耐藥性和益生特性起至關重要的作用。
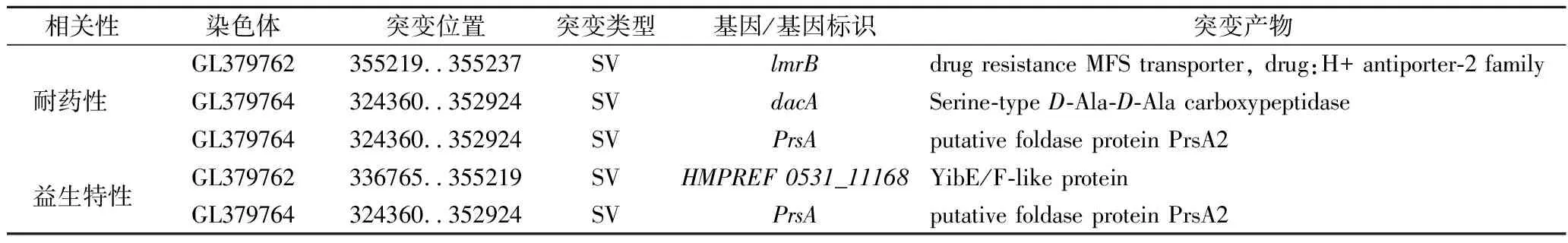
表4 植物乳桿菌進化中與耐藥性和益生特性相關的基因突變Table 4 Gene mutations related to resistance and probiotic properties in the evolution of Lactobacillus plantarum
3 討論
細菌的耐藥性通常通過自然進化產生,這種進化過程具有相當大的隨機性和不可控性[16-17]。當細菌形成耐藥性后可使一些抗生素的治療失敗,然而益生菌獲得耐藥性后也許對益生作用產生積極影響,尤其是當益生菌與抗生素聯合使用時效果更加顯著[18]。因此,有關益生菌耐藥性馴化已日益受到人們的關注[19]。為了進行可控的益生菌耐藥性馴化,實驗室進化已廣泛應用,GEORGE等[19]對植物乳桿菌在氨基糖苷類抗生素中進行進化,獲得高耐藥性菌株,我們從前也對植物乳桿菌在氨基糖苷類抗生素中進行馴化,獲得了高耐藥性的菌株[20]。本研究中植物乳桿菌(ATCC 14917)原始菌株對頭孢氨芐表現為敏感型,通過在頭孢氨芐存在下進行實驗室進化,其耐藥性提高了512倍,但這種耐藥性不穩定,在去除頭孢氨芐條件后進一步進行進化時,其耐藥性有所降低,經過一段時間適應后,其耐藥性達到4 096 μg/mL,并在此后進化中保持穩定,耐藥性比原始菌株提高了256倍,表明通過實驗室進化后可獲得高耐藥性的植物乳桿菌菌株,并且這種耐藥性的獲得是不可逆的。
益生菌產生益生作用的前提是能夠通過胃液的酸性環境和腸道的高膽鹽環境,并以活菌的狀態通過胃腸道并定植在腸道中,這樣才能發揮益生作用[3],當益生菌獲得耐藥性后,其益生性狀可能發生改變,因此,對益生菌的益生特性評價十分必要。本研究中,對獲得高耐藥性的植物乳桿菌菌株在酸性環境(pH 2、3、4)及高膽鹽環境(1、3、5 g/L)中進行培養,與原始菌株相比,其菌株的存活率無明顯變化(P>0.05)。在菌株的黏附特性中,細胞疏水性對比原始菌株有一定的提高。這表明當植物乳桿菌獲得耐藥性后,其主要益生特性保持穩定,一些性狀如疏水性有所提高,這為高耐藥性植物乳桿菌的應用提供了一定的基礎。
益生菌進化過程中的表型特性(包括耐藥性和益生特性)的改變本質上與進化過程中菌株的基因突變有關。通過對進化過程中菌株突變基因的檢測,可進一步從分子水平闡明表型特性變化的機制。我們從前對植物乳桿菌在慶大霉素進化后的耐藥性菌株的基因檢測發現lmrB、HMPREF0531_10299和HMPREF0531_11866基因是提高植物乳桿菌對慶大霉素耐藥性的主要因素[20]。本研究中,應用全基因組測序技術對植物乳桿菌進化后獲得的高耐藥性菌株基因突變檢測發現,突變基因lmrB、dacA和PrsA可能是增強植物乳桿菌耐藥性的主要原因,lmrB編碼的突變產物耐藥性MFS轉運體可以刺激細菌產生多藥轉運蛋白,在滲透壓促進裂解物的跨膜運動中可以排出抗生素,以保護細胞免受損傷[21],為植物乳桿菌在進化過程中耐藥性的提高發揮了重要作用。dacA編碼的絲氨酸型D-Ala-D-Ala羧肽酶是一種外肽酶,這種酶從肽聚糖胞壁五肽的側鏈取代末端的D-丙氨酸,使其不能與抗生素結合從而產生耐藥性[22]。PrsA編碼的推定折疊酶蛋白PrsA2,已被證明可調節β-內酰胺類抗生素的易感性[23],該蛋白可能通過調節分泌蛋白維持耐藥性菌株在傳代后期耐藥性的穩定。同時檢測到與益生特性相關的突變基因,HMPREF0531_11168和PrsA。HMPREF0531_11168編碼的YibE/F樣蛋白(YibE/F-like protein)家族中的序列與乳酸菌表達的2種蛋白質YibE和YibF相似,這些序列包含高比例的疏水性殘基[24],這對菌株在進化過程中保持一定水平的疏水性起著重要作用。PrsA編碼的推定折疊酶蛋白PrsA2會改變細胞壁或膜蛋白譜以及與細胞表面相關的表型[25],可以推測該突變產物在進化過程中與菌株的細胞表面疏水性的提高有關。
4 結論
通過實驗室進化方法對植物乳桿菌在頭孢氨芐中進行進化,獲得了具有高耐藥性的植物乳桿菌,并對其主要益生特性進行評價,發現獲得的高耐藥性植物乳桿菌具有穩定的耐酸,耐膽鹽能力以及較好的黏附能力,并對一些常見致病菌具有穩定的抑菌效果,其益生性狀穩定。同時應用全基因組測序技術對進化過程中突變基因檢測,檢測到了與耐藥性和益生特性相關的突變基因,這為植物乳桿菌與抗生素聯合應用的治療提供基礎。

