不同單肺通氣模式對胸腔鏡肺癌根治術動脈氧合及手術預后的影響
鄒麗明 陳文華
肺癌是我國常見的惡性腫瘤,隨著微創外科技術的發展,胸腔鏡肺癌手術越來越常見,對麻醉醫生術中單肺通氣管理的要求也越來越高。單肺通氣(OLV)有利于外科醫生手術操作,但其導致的嚴重并發癥包括低氧血癥、肺損傷和右心功能障礙也不容忽視[1]。得益于肺隔離裝置、對位技術及麻醉藥物和技術的改進,OLV期間低氧血癥的發生率已經從1970年代的25%下降到現在的4%~10%[2]。健康個體在OLV期間可以耐受低至85%~90%的血氧飽和度(SaO2)[3-4],但對于合并有心腦血管疾病或肺部疾病的患者,低氧血癥引起的并發癥包括心肌抑制、心房顫動、肺動脈高壓及認知功能障礙的風險更高[5]。胸外科手術患者在圍術期可能面臨的肺損傷包括肺不張、肺炎、氣胸、支氣管胸膜瘺和急性呼吸窘迫綜合征(ARDS)等[6]。在臨床麻醉過程中,如何改善患者的氧合功能、減輕肺損傷、預防和減少術后肺部并發癥的發生,成為麻醉科工作者探討的重要課題。容量控制通氣(VCV)和壓力控制通氣(PCV)是臨床麻醉中兩種常用的通氣模式,目前關于PCV模式能否明顯改善OLV時的氧合功能仍存在爭議,且關于不同的OLV模式對胸腔鏡肺癌根治術預后的影響研究較少,因此進一步驗證兩種通氣模式對氧合功能及手術預后的影響有一定的臨床參考價值,故本研究選取40例胸腔鏡肺癌根治術患者,分組施行不同的通氣模式并對其效果進行對比,現報告如下。
1 資料與方法
1.1 一般資料
選取福建醫科大學附屬協和醫院2014年10月-2015年2月收治的40例擇期行胸腔鏡肺癌根治術的患者為研究對象,納入標準:ASA分級Ⅰ、Ⅱ級,16~65 歲。排除標準:體重指數(BMI)>30 kg/m2,合并嚴重肝、腎及心腦血管疾病,術前肺功能異常。根據隨機數字表法分為兩組,每組20例。A組男10例,女10例;年齡(56.8±10.2)歲;OLV時間(164.4±89.2) min;手術部位:右 11例,左 9例。B組男13例,女7例;年齡(56.2±8.9)歲;OLV時間(146.0±63.6)min;手術部位:右10例,左10例。兩組一般資料比較差異無統計學意義(P>0.05),有可比性。本研究獲得本院醫學倫理委員會批準,所有患者均對本次研究知情同意。
1.2 方法
本研究所有患者均采取相同的全麻誘導和維持,快誘導后行雙腔支氣管插管,纖維支氣管鏡對位雙腔氣管導管位置良好。雙肺通氣(TLV)時采用VCV模式,潮氣量8 ml/kg,吸入氧濃度為100%,吸呼比1∶2。OLV時A組行VCV,潮氣量6 ml/kg,吸呼比1∶2,吸入氧濃度為100%;B組行PCV,吸氣壓調整至潮氣量等同6 ml/kg時的壓力值,吸呼比1∶2,吸入氧濃度為100%。在OLV期間均加用呼氣末正壓通氣5 cmH2O。調節呼吸頻率,使呼氣末二氧化碳分壓維持在35~45 mmHg。
1.3 觀察指標
比較40例患者不同時刻的氧合指數。比較兩組 在 TLV 30 min(T1)、OLV 30 min(T2)、OLV 60 min(T3)、恢復 TLV 20 min(T4)時的氧合指數、氣道峰壓(Ppeak)、氣道平臺壓(Pplat)及肺順應性。比較兩組術后住院天數、術后肺部炎癥及肺不張的發生率。
1.4 統計學處理
本研究數據采用SPSS 20.0統計學軟件進行分析和處理,計量資料以(±s)表示,采用t檢驗;計數資料以率(%)表示,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 40例患者術中不同時刻的氧合指數比較
與 T1的氧合指數(453.22±112.48) mmHg相比,T2時 氧 合 指 數(179.26±96.51) mmHg和 T3時的氧合指數(203.92±103.66) mmHg均明顯下降(P<0.05);且與T2時相比,T3時氧合指數升高(t=-2.414,P=0.021)。
2.2 兩組術中不同時刻的氧合指數比較
T2、T3時,兩組氧合指數均較T1時下降(P<0.05);T1、T2、T3、T4時,兩組氧合指數比較差異無統計學意義(P>0.05),見表1。
表1 兩組術中不同時刻氧合指數比較[mmHg,(±s)]

表1 兩組術中不同時刻氧合指數比較[mmHg,(±s)]
*與本組T1時比較,P<0.05。
組別 T1 T2 T3 T4 A組(n=20) 449.70±111.98 184.05±108.07* 194.15±109.28* 433.24±85.72 B組(n=20) 457.35±116.37 173.94±84.63* 214.78±99.01* 451.33±108.13 t值 -0.203 0.318 -0.607 -0.528 P值 0.840 0.752 0.548 0.602
2.3 兩組術中Ppeak、Pplat及肺順應性比較
T2、T3時,兩組 Ppeak、Pplat均 較 T1時 升高(P<0.05),且與A組相比,B組Ppeak較 低(P<0.05),兩組各時刻Pplat比較差異無統計學意義(P>0.05),見表2、表3。T2、T3時,兩組肺順應性較T1時下降,兩組各時刻肺順應性比較差異無統計學意義(P>0.05),見表4。
表2 兩組術中Ppeak比較[cmH2O,(±s)]
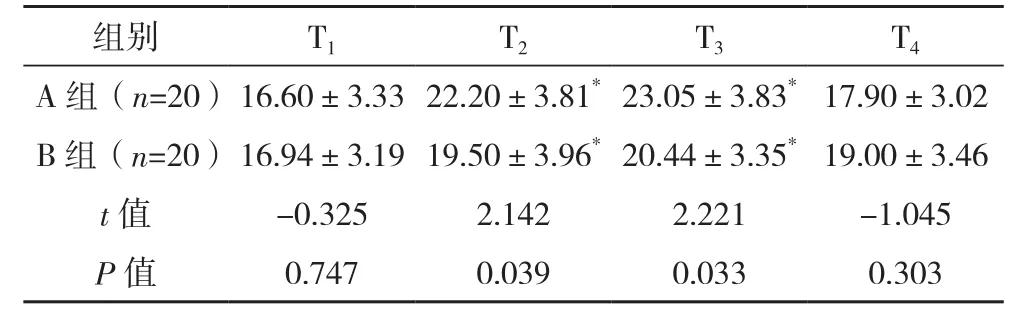
表2 兩組術中Ppeak比較[cmH2O,(±s)]
*與本組T1時比較,P<0.05。
組別 T1 T2 T3 T4 A 組(n=20)16.60±3.33 22.20±3.81*23.05±3.83*17.90±3.02 B 組(n=20)16.94±3.19 19.50±3.96*20.44±3.35*19.00±3.46 t值 -0.325 2.142 2.221 -1.045 P值 0.747 0.039 0.033 0.303
表3 兩組術中Pplat比較[cmH2O,(±s)]
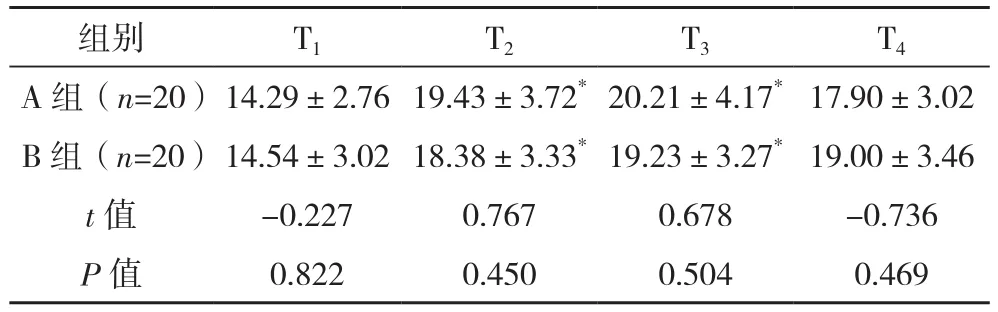
表3 兩組術中Pplat比較[cmH2O,(±s)]
*與本組T1時比較,P<0.05。
組別 T1 T2 T3 T4 A 組(n=20)14.29±2.76 19.43±3.72*20.21±4.17*17.90±3.02 B 組(n=20)14.54±3.02 18.38±3.33*19.23±3.27*19.00±3.46 t值 -0.227 0.767 0.678 -0.736 P值 0.822 0.450 0.504 0.469
表4 兩組術中肺順應性比較[ml/cmH2O,(±s)]

表4 兩組術中肺順應性比較[ml/cmH2O,(±s)]
*與本組T1時比較,P<0.05。
組別 T1 T2 T3 T4 A 組(n=20)40.36±8.48 22.86±6.93*22.93±7.13*37.64±11.34 B 組(n=20)44.77±9.06 27.46±7.26*26.46±6.25*34.92±9.61 t值 -1.307 -1.686 -1.364 0.670 P值 0.203 0.104 0.185 0.509
2.4 兩組術后住院天數、術后并發癥比較
A組術后住院天數(6.80±4.10)d,B組術后住院天數(6.24±2.63)d,兩組術后住院天數比較差異無統計學意義(t=0.488,P=0.628)。兩組術后肺部炎癥及肺不張的發生率比較差異無統計學意義(P>0.05),見表5。
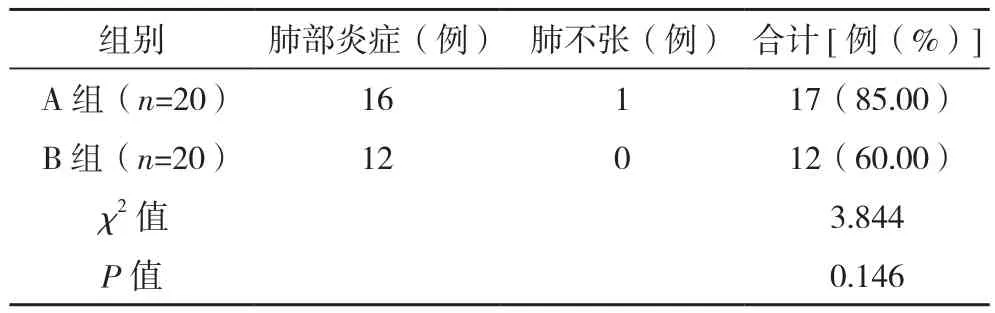
表5 兩組術后并發癥比較
3 討論
在臨床麻醉過程中,OLV導致的低氧血癥和肺損傷等并發癥一直是麻醉醫生關注的熱點問題。OLV導致的通氣側肺損傷機制包括氣壓傷和高容量性肺損傷,非通氣側肺損傷機制包括缺氧性肺損傷、肺萎陷復張性損傷、氧化應激性肺損傷及手術操作性肺損傷等[7]。過去為了防止肺不張的發生,曾建議在OLV期間使用10~12 ml/kg潮氣量進行肺通氣[8],但大潮氣量通氣可導致高容量性肺損傷。Lohser等[9]研究表明,在OLV期間與小潮氣量(5 ml/kg)相比較,大潮氣量(8~10 ml/kg)更容易引起肺部炎癥,增加術后肺部并發癥。有Meta分析表明,小潮氣量通氣可明顯降低肺部感染及急性呼吸窘迫綜合征(ARDS)的發生率[10]。Della等[11]研究也證實了OLV時大潮氣量與急性肺損傷(ALI)的關系,ALI發病率會因潮氣量增大而增加。Michelet等[12]研究表明小潮氣量聯合呼氣末正壓通氣能夠明顯減輕炎性反應。OLV期間,潮氣量4~6 ml/kg,呼氣末正壓(PEEP)5 cmH2O 是較為推薦的通氣參數設置[13]。故在本研究中,40例患者均采用小潮氣量聯合呼氣末正壓5 cmH2O的肺保護通氣方式。
本次研究發現與TLV時相比,OLV開始后無論是VCV還是PCV模式,氧合指數均下降,這是由于OLV時手術側肺萎陷沒有通氣,但仍有血流灌注,通氣血流不匹配,肺內分流增加所導致[1]。研究還發現與 OLV 30 min 相比,OLV 60 min 的氧合指數升高,這可能是由于缺氧性肺血管收縮(HPV)的作用。OLV以后,由于肺泡缺氧刺激HPV產生,使通過非通氣側肺的肺部血流減少40%~50%,導致通氣血流重新分配,肺內分流減少[14]。有研究報道動脈血氧分壓(PaO2)通常在OLV開始后20~30 min 達最低水平,在隨后 1~2 h 逐漸增加[15],與本次研究結果一致。本次研究發現兩種通氣模式在OLV時氧合指數差異無統計學意義(P>0.05),本研究結果與Choi等[16]研究結果一致,該研究也表明在胸科手術中,VCV和PCV兩組在呼吸力學、血流動力學及氧合功能方面沒有明顯差異。但本次研究結果與Tu?rul等[17]的研究結果不一致,該研究發現在OLV期間應用PCV模式時,肺內分流明顯低于VCV模式組,動脈血氧分壓明顯高于VCV模式組,尤其對于術前肺功能檢查中用力肺活量較低的患者,故PCV通氣模式可能更加適合應用于限制性肺部疾病患者。朱葉葦等[18]的研究也表明,對于行胸科手術的老年患者,在OLV期間使用PCV+PEEP通氣模式可有效降低氣道壓力,改善肺通氣及氧合,與本研究結果也不同。本次研究與上述研究結論不同的可能原因是研究對象的納入排除標準不一致,本次研究對象是排除了老年患者,且術前肺功能檢查均在正常范圍內。PCV模式能否改善OLV時的氧合功能,可能與患者年齡,術前肺功能狀態等有關。在臨床麻醉過程中,需要根據手術患者的年齡及肺功能等狀態選擇合適的通氣模式。
本次研究發現OLV開始后氣道峰壓、氣道平臺壓及平均氣道壓均升高,但OLV-PCV模式下氣道峰壓低于OLV-VCV模式組。機械通氣時的高氣道壓可導致機械通氣肺損傷,Beitler等[19]研究發現,術中氣道峰壓超過30 cmH2O時,患者術后可產生急性呼吸窘迫綜合征。當氣道峰壓超過40 cmH2O時,42%的肺切除術患者術后通過影像學可以診斷為ALI[20]。在本次研究中,雖然兩組患者OLV以后氣道壓力升高,但氣道峰壓均低于30 cmH2O。但也有研究表明,影響術后肺部并發癥的獨立危險因素是驅動壓(驅動壓=平臺壓-呼氣末正壓)的增加,而與潮氣量、呼氣末正壓及氣道峰壓無關[21-22],該理論可以用來解釋本次的研究結果。本次研究中兩組氣道平臺壓差異無統計學意義(P>0.05),PCV組的氣道峰壓雖然低于VCV組,但兩組術后住院天數及并發癥發生率的差異無統計學意義(P>0.05),可見氣道峰壓不是影響術后并發癥的主要危險因素。Mathis等[23]研究發現當驅動壓力<16 cmH2O時可以降低術后肺部并發癥的發生風險。雖然PCV模式沒有起到降低術后并發癥的作用,但其能起到限制氣道壓的效果,故該模式對于肺大皰患者有明顯優勢,其通過限制氣道壓力起到肺保護的作用,對于肺大皰手術患者可以選擇PCV模式。
綜上所述,壓力控制通氣模式未明顯改善OLV時的肺順應性和氧合功能,兩種通氣模式對手術預后的影響也未見明顯差別。對于術前肺功能正常的胸腔鏡肺癌根治術患者,兩種通氣模式均可以選擇。

