薄層液膜下外加直流電場對Cu/Ag 電偶腐蝕行為的影響
吳鳳麒,祁 康,黃華良
武漢工程大學化學與環境工程學院,湖北 武漢 430205
電子系統是科技時代信息傳遞的重要環節[1]。隨著電子系統集成度的不斷增加,器件和線路中的空間位置變得狹小,金屬材料變得更加細薄,金屬材料的腐蝕嚴重地影響了電子系統的使用壽命[2-3]。電子系統是多種多層金屬材料的集成系統,因此,其極易誘發電偶腐蝕[4]。在電子器件的制造過程中,銅是最受青睞的金屬材料之一。眾所周知,電偶腐蝕受多種因素控制,如材料的特性,腐蝕介質的種類、溫度、氧含量等[5]。Fan等[6]在酸性紅壤模擬溶液中模擬了接地網用銅拉拔鋼的電偶腐蝕行為,發現鋼作為陽極被腐蝕,而銅板作為陰極被保護。在酸性紅壤模擬溶液中,隨著pH 值從6 降至2.4,銅拉鋼電偶的腐蝕速率明顯加快。由銅拉鋼電偶形成的電場改變了銅和拉制鋼電極之間的離子遷移方向,從而影響了電極表面形成的腐蝕產物的成分和微觀結構。Pei等[7]采用碳鋼陽極和純銅陰極構成的Fe/Cu 型電偶ACM 傳感器在青島室外大氣環境中暴露34 d,在薄電解質層下監測了相對濕度、溫度、降雨狀況、污染物等對電偶電流的變化影響,發現降雨狀況是最主要的影響因素,ACM 傳感器表面銹層的生長降低了電偶電流預測的準確性。Conseil-Gudla等[8]研究了3-氨基-1,2,4-三唑-5-硫醇與氯化鈰協同抑制Al/Cu 偶合模型中的電偶腐蝕,采用掃描振動電極技術和中性充氣NaCl 溶液中鋁/銅電偶偶合模型,發現浸泡24 h 后,兩種抑制劑的組合顯示出正協同效應,Ce1 的抑制效果最好。綜上所述,關于外部環境對銅的電偶腐蝕行為影響受到越來越多學者的關注。在此基礎上,考慮到電子銅在服役過程中的真實環境,外加電場是作為電子系統中銅電偶腐蝕的重要影響因素之一。
在電子系統中,特別是電子器件在服役過程中,電子材料的電偶腐蝕不僅受環境因素的影響,而且還會受到外加電場的影響[9]。目前,大氣環境因素(溫度、濕度和污染物)對電偶腐蝕影響的研究較多[10-14],而有關外加電場作用下電子材料的電偶腐蝕行為和機理的研究較少。外加電場會改變金屬的自腐蝕電位、自腐蝕電流和極化行為[15];同時,強加的巨大電場梯度會改變離子分布,促進離子的擴散和遷移,造成局部腐蝕環境和腐蝕產物微觀結構的差異[16]。強加的漏電電流會破壞金屬表面氧化膜或保護性腐蝕產物膜,導致金屬活性增加[17]。因此,研究外加電場作用下電子材料的電偶腐蝕問題具有重要的理論和實際意義。目前研究難點主要在于材料在真實服役環境下的模擬和實驗測試方法的確立。因微電子金屬材料的服役環境較復雜,且常常暴露于薄層液膜環境下,本實驗采用自制銅/銀電偶模具,在質量分數3.5%NaCl 溶液的300 μm 薄層液膜下進行電化學測試,研究了直流電場作用下銅/銀電偶腐蝕規律和漏電電流對銅/銀電偶腐蝕行為的影響,并結合現代表征分析技術驗證實驗結果。
銅具有優良的延展性、導熱性和導電性[18-19],是最常用的材料之一[20]。然而,當銅暴露于大氣中,受大氣環境的影響,其表面經常發生氧化或腐蝕。因此,通常采用化學浸銀處理[21]。由于鍍銀層很薄,經常會存在一些缺陷或微孔,所以化學浸銀處理后的銅在腐蝕環境下極易誘發電偶腐蝕[22]。Huang 等[23]研究了電子系統中銅/銀在薄電解質層下的電偶腐蝕及緩蝕機理,結果表明陰陽面積比的增加顯著加速了銅的腐蝕,銅和銀之間的電偶效應降低了緩蝕劑的緩蝕效率。Bu 等[24]研究了薄液膜厚度、氯離子濃度和外加直流電場對銀在薄電解液層下腐蝕行為的影響,發現隨著電場強度的增加,正極板附近銀的腐蝕速率先增大后減小。在外加直流電場環境中,銀在不同位置極化行為的不同歸因于局部腐蝕環境的不同。Huang 等[25]研究了薄液膜下不同位置的外加電場對銅腐蝕的影響,結果表明外加電場顯著地改變了局部腐蝕環境,導致局部腐蝕行為的差異。然而,目前的研究均未考慮外加電場對電子系統電偶腐蝕行為的影響。因此,研究銅和銀在外加電場作用下的電偶腐蝕行為,并闡明其腐蝕機理,對于電子系統材料的可靠性研究具有重要的實際價值。
本文自制了可外加電場的薄液膜三電極腐蝕電解池,采用電化學測試方法和表面分析技術研究了質量分數3.5% NaCl 溶液中外加直流電場(direct current electric field,DCEF)作用下銅和銀之間的電偶腐蝕行為,探究了強加的電場梯度和漏電電流對Cu/Ag 電偶腐蝕行為的影響機制。
1 實驗部分
為了模擬真實的環境(微電子系統中金屬材料暴露的表面積較小,排列較緊湊,且常暴露于電場環境中),所用的工作電極材料為純銅和純銀,實驗前將電極材料加工成2 mm×2 mm×10 mm 的長方體。電場極板材料為純銀,加工成2 mm×5 mm×10 mm 的長方體。將工作電極和電場極板的一端分別焊接到一根普通銅絲上,然后用環氧樹脂密封,僅留下未焊接的端面作為工作面,工作面積為0.04 cm2,如圖1 所示。銅、銀電極平行排列于自制有機玻璃模具的中心,間距為1 mm。正負極板平行等距地放置在銅、銀電極兩側,與銅、銀電極之間的間距均為1 mm,正負極板之間的水平距離為4 mm,并與銅、銀電極的工作面處于同一平面,嵌入環氧樹脂中。在電化學測試之前,暴露表面依次用600#、800#、1000# 的砂紙逐級打磨,然后用去離子水清洗,用無水乙醇擦拭,冷風吹干以備用。本實驗采用的薄液膜厚度均為300 μm。測試溫度為30 ℃。
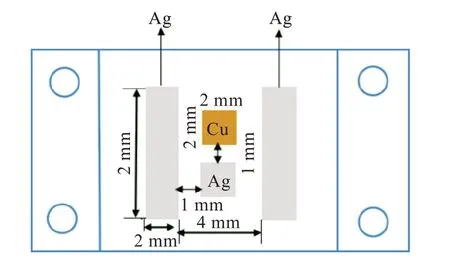
圖1 Cu、Ag 電極及電場極板的俯視圖Fig.1 Top views of Cu,Ag electrode and two polar plates of electric field
圖2 為實驗裝置,包括薄液膜厚度測試裝置和電化學測試裝置。薄液膜厚度測試裝置由鐵架臺、千分尺微分頭、一維移動平臺和鉑針組成。電化學測試裝置由電化學測量系統、帶底座的長方體有機玻璃容器、輔助電極(counter electrode,CE)和參比電極(reference electrode,RE)組成。前期工作準備好后,將試樣組裝到有機玻璃容器的底座上,然后將準備好的電解液加入有機玻璃容器內,直至電解液溢出試樣表面。以鉑針為工作電極(work electrode,WE)1,負極板為WE2,通過銅導線連接到CS350 電化學工作站,采用恒電位極化,極化電位為50 mV,記錄電流隨時間的變化。首先,緩慢旋轉微分頭,使鉑針垂直向電極表面移動。當鉑針接觸到液膜表面時,電流會發生第一次突躍,記錄此時千分尺的刻度。然后繼續旋轉微分頭,當鉑針接觸到銀表面時,此時電流會出現第二次突躍,再次記錄此時千分尺的刻度。最后計算這兩次刻度的差值,即為薄液膜厚度。
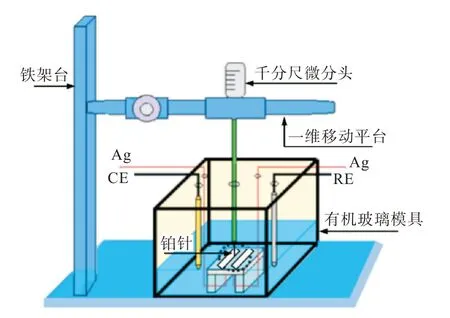
圖2 薄液膜厚度測量裝置示意圖Fig.2 Schematic diagram of thin electrolyte film thickness measuring device
液膜厚度調節到300 μm 后,通過銅導線將電場極板與直流電源(1.5 V 的大容量干電池)的正負極分別相連,即構成平行的直流電場。實驗過程中為了保持電壓的穩定,利用滑動變阻器,調節兩塊極板間的直流電壓為1 V,此時,兩極板之間不僅存在電場梯度,而且有漏電流。為了研究電場梯度和漏電電流對電偶腐蝕的貢獻,采用絕緣膠將直流電場兩極板的工作面密封,那么此時兩極板之間只存在電場梯度,無漏電電流。
采用CS350 電化學工作站進行電化學測試,使用傳統的三電極體系,以銅或銀電極作為WE,鉑片作為CE,飽和甘汞電極(saturated calomel electrode,SCE)作為RE。在未偶合、偶合、外加直流電場且偶合條件下進行開路電位(open circuit potential,OCP)測試,當OCP 達到穩定后,先使用幅值為10 mV 的正弦波激勵信號進行交流阻抗譜(electrochemical impedance spectroscopy,EIS)測試,頻率范圍為10-2Hz至105Hz。阻抗測試完畢后,接著進行極化曲線測試,其掃描范圍為-300 mV(SCE)至+1 200 mV(SCE)vs.OCP,掃描速率為1 mV·s-1。EIS 數據使用相應的等效電路采用Zview 軟件進行擬合。在電偶腐蝕實驗中,使用CS350 電化學腐蝕系統測試不同條件下Cu/Ag 偶對的電偶電位和電偶電流密度,銅作為WE1,銀作為WE2,SCE 作為RE。
偶合后的電化學測試方法為:液膜厚度調節好后,并迅速將銅和銀偶接在一起,分別在不同時間進行銅、銀的開路電位測試以及阻抗和極化測試。測試前,斷開銅和銀的電連接,測試完后又迅速將它們接偶在一起。
在不同條件下將Cu/Ag 偶對暴露在薄液膜下12 h 后,采 用JSM-5510LV 掃 描 電 鏡(scanning electron microscope,SEM)觀察其腐蝕形貌,通過ESCALAB Xi+ 型X 射 線 光 電 子 能 譜(X-ray photoelectron spectroscopy,XPS)分析其腐蝕產物的成分。
2 結果與討論
2.1 開路電位
圖3 為30 ℃,質量分數3.5% NaCl 溶液中銅和銀的腐蝕電位隨時間的變化。從圖3 可知銀的腐蝕電位始終大于銅的腐蝕電位,這表明當銅與銀偶接時,銅始終作為陽極,銀始終作為陰極。而且,在整個浸泡過程中銅和銀的腐蝕電位呈現出先負移后逐漸正移的變化趨勢。在浸泡初期,銅和銀腐蝕電位的負移可能歸因于大量氯離子的存在促進了其陽極過程,隨著浸泡時間的延長,銅和銀表面腐蝕產物逐漸積累,導致其陽極過程被抑制,使得腐蝕電位逐漸正移。
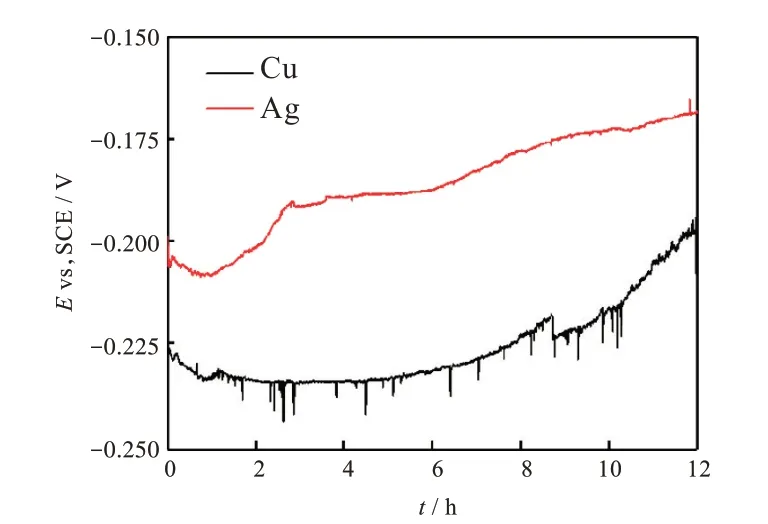
圖3 銅和銀在質量分數3.5% NaCl溶液(30 ℃)中的腐蝕電位隨時間的變化Fig.3 Changes of OCPs of Cu and Ag with time in 3.5%NaCl solution(30 ℃)
圖4 為銅和銀在不同條件下腐蝕電位隨時間的變化。從圖4(a)可知,在浸泡初期(1 h),偶合后,銅的電位負移,這歸結為它們之間的電偶效應加速了銅的陽極過程[26]。外加電場后,在無電流的情況下,銅的腐蝕電位沒有發生明顯的變化。外加電場后,在有電流的情況下,銅的腐蝕電位較未偶合條件下發生了正移,這可能歸因于電流加速了氫氧根離子的遷移導致銅陰極過程的加速。隨著浸泡時間的延長,銅的腐蝕電位均逐漸正移,這可能歸因于腐蝕產物逐漸積累,導致其陽極過程被抑制。而且始終有:偶合有電場無電流的腐蝕電位>偶合有電場有電流的腐蝕電位>未偶合的腐蝕電位>偶合后的腐蝕電位。這可能解釋為:偶合后電偶效應加速了銅的陽極過程;外加電場后,在無電流的情況下,電場梯度顯著地加速了氫氧根離子的遷移,導致銅的陰極過程的顯著加速;外加電場后,在有電流的情況下,電場負極板處因氧的還原產生的氫氧根離子在電流的作用下迅速向電場正極板遷移導致銅陰極過程的抑制。由圖4(b)可知,在浸泡初期(1 h),沒有外加直流電場時,偶合后銀的電位明顯負移,這可能是銀陽極過程被加速。因為銀作為陰極,電偶效應引起了銀陰極的極化,導致銀表面的腐蝕產物氯化銀沉積量較少,腐蝕產物膜對銀的保護作用較小,銀的陽極過程加速,開路電位負移。外加電場后,在無電流的情況下,銀的腐蝕電位較偶合無電場條件下發生了正移,因為溶液中離子的分布情況受外加電場所影響,導致銀電極表面Cl-濃度減小,抑制了銀的陽極過程。在有電場和有電流時,銀的開路電位是最正的。這是由于在外加直流電場(電流)的作用下,加速了陰離子迅速遷移到正極板的速度,陰離子被迅速消耗,導致銀表面的Cl-和OH-濃度降低,抑制銀的陽極過程,銀的電位正移。
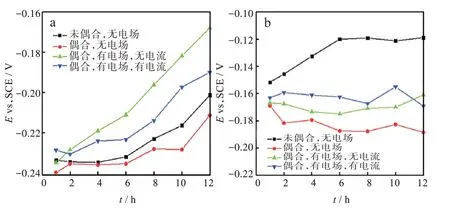
圖4 銅和銀在不同條件下腐蝕電位隨時間的變化:(a)Cu,(b)AgFig.4 Changes of OCPs of Cu and Ag with time under different conditions:(a)Cu,(b)Ag
2.2 極化曲線
圖5 為不同條件下銅在質量分數3.5%NaCl 溶液中浸泡1 h 后的極化曲線。由圖5 可知,偶合后銅的陰、陽極電流密度增加,這可能歸因于電偶效應加速了銅的腐蝕過程。外加電場后,在無電流的情況下,銅的陰極電流密度較偶合時輕微地減小,這可能由于有電場無電流時銅的腐蝕電位較偶合時正移,降低了銅和銀之間的電位差,從而削弱了它們之間電偶效應。外加電場后,在有電流的情況下,銅的陰極電流密度較偶合和有電場無電流時明顯減小,這可能由于電場負極板處因氧還原產生的氫氧根離子在電流的作用下迅速向電場正極板遷移導致銅陰極過程的抑制。然而,外加電場后,無論有電流還是無電流,銅的陰極電流密度均較未偶合時大,這可能歸因于電場加速了氫氧根離子的遷移從而導致銅陰極過程的加速。外加電場有電流的情況下,銅陽極電流密度的減小可能歸因于電場正極板大量Cl-的消耗。

圖5 不同條件下銅在3.5% NaCl溶液中浸泡1 h 后的極化曲線Fig.5 Polarization curves of Cu under different conditions after 1 h of immersion in 3.5% NaCl solution
考慮到腐蝕產物膜的形成和累積對陽極極化曲線的影響,我們采用陰極Tafel 外推法對測試的極化曲線進行擬合,相應的擬合參數:腐蝕電位(E0)、腐蝕電流密度(I0)和陰極Tafel 斜率(Bc),列于表1 中。從表1 可知,不同條件下銅的腐蝕電流密度順序為:偶合后的腐蝕電流密度>偶合有電場無電流的腐蝕電流密度>偶合有電場有電流的腐蝕電流密度>未偶合的腐蝕電流密度。
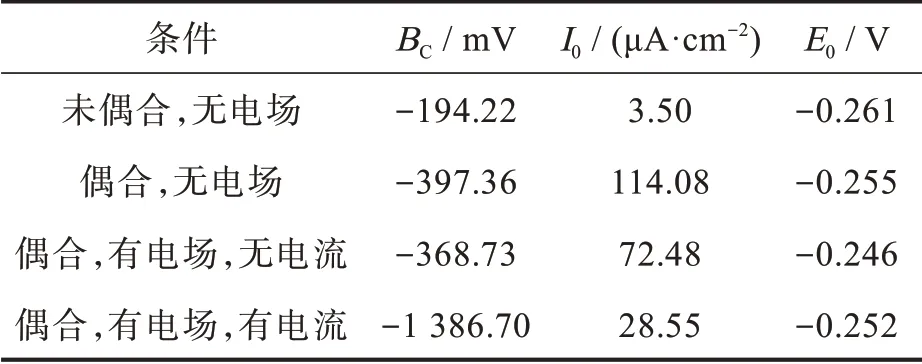
表1 不同條件下銅的極化曲線擬合參數Tab.1 Fitted parameters of polarization curves of Cu under different conditions
2.3 交流阻抗
圖6 為不同條件下銅在質量分數3.5% NaCl溶液中的EIS。從圖6(a)中可知,銅的EIS 只展現出1 個容抗弧,對應的Bode 圖只顯示出1 個時間常數。基于銅的腐蝕機理和腐蝕后的形貌,這個容抗弧實際上為時間常數非常接近的兩個容抗弧的部分重疊。高頻區域的容抗弧對應于銅表面腐蝕產物膜的容抗響應,低區域的容抗弧對應于腐蝕電化學反應的法拉第過程。在未偶合、偶合和外加電場且無電流偶合情況下,在Nyquist 圖尾部展示出一個擴散過程,這可能歸因于腐蝕產物物種的擴散過程[27]。然后,在外加電場且有電流偶合情況下無擴散過程,這可能歸因于電場的漏電電流顯著地加速了腐蝕產物物種的擴散。
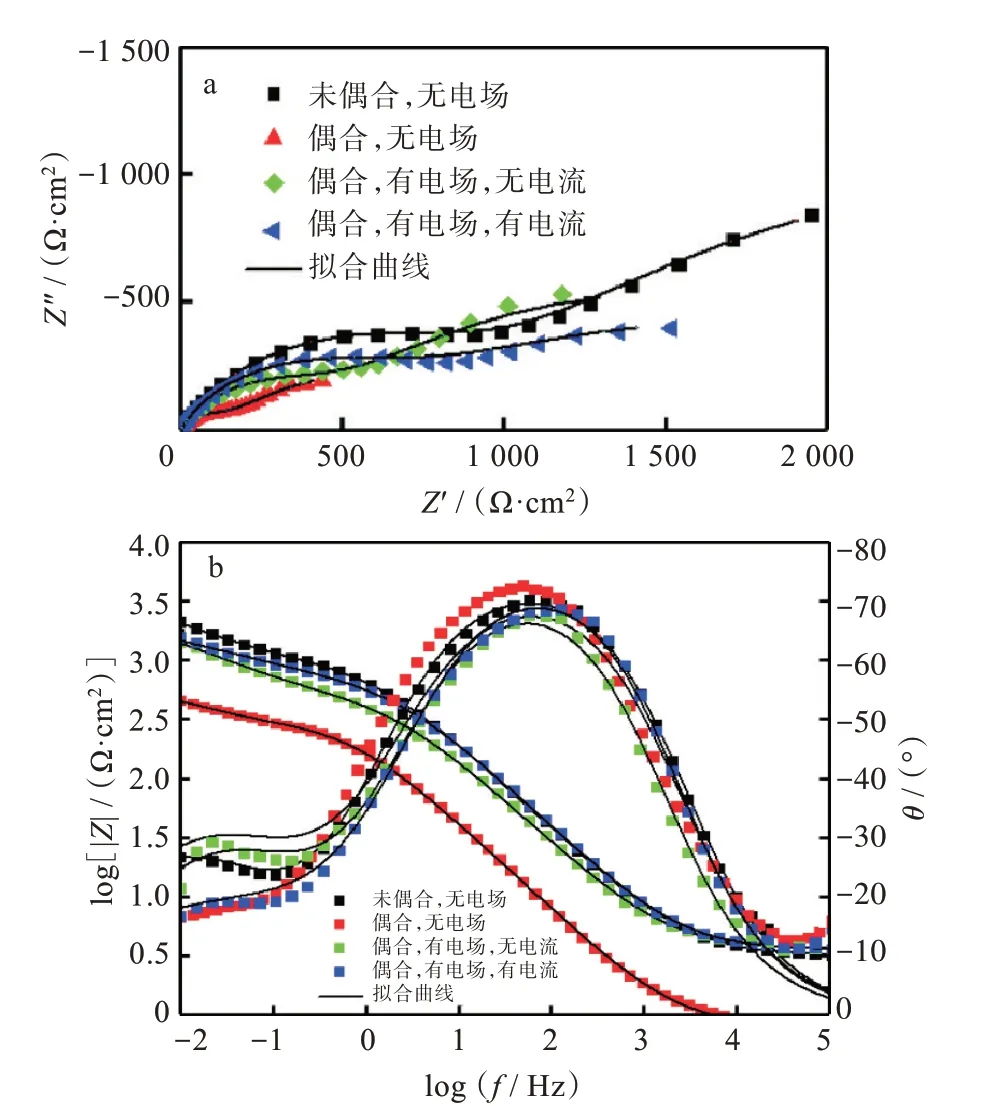
圖6 不同條件下銅的EIS:(a)Nyquist圖,(b)Bode 圖Fig.6 EIS of copper under different conditions:(a)Nyquist plots,(b)Bode plots
此外,由圖6(a)可知,不同條件下容抗弧直徑的大小順序為:未偶合>偶合有電場有電流>偶合有電場無電流>偶合。這暗示著銅在不同條件下的腐蝕速率順序為:偶合>偶合有電場無電流>偶合有電場有電流>未偶合,這和極化曲線的測試結果一致。
基于以上分析,采用圖7 所示的等效電路來擬合銅在不同條件下的EIS,相應的擬合參數列于表2 中。Rs表示溶液電阻,CPEf(constant phase angle element)表示腐蝕產物膜的膜電容,nf是與腐蝕產物膜電容相關的彌散系數,Rf表示腐蝕產物膜的電阻,CPEdl表示雙電層電容,ndl表示與雙電層電容相關的彌散系數,Rct表示電荷轉移電阻,W表示Warburg 阻抗,代表物質的擴散傳質過程。
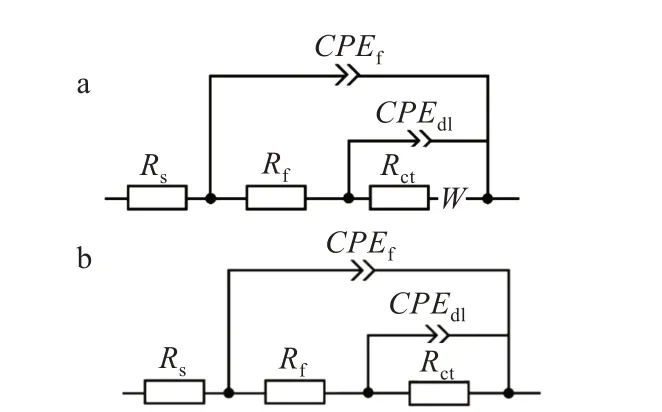
圖7 用于擬合EIS 數據的等效電路圖:(a)含擴散過程,(b)不含擴散過程Fig.7 EECs used for fitting EIS data:(a)with Warburg impedance,(b)without Warburg impedance
一般地,在薄液膜下,Rct比Rp(極化電阻)更適合表征金屬的腐蝕速率[28],且Rct越小,腐蝕速率越大[29-30]。從表2 可知,不同條件下銅的Rct大小順序為:未偶合>偶合有電場有電流>偶合有電場無電流>偶合。
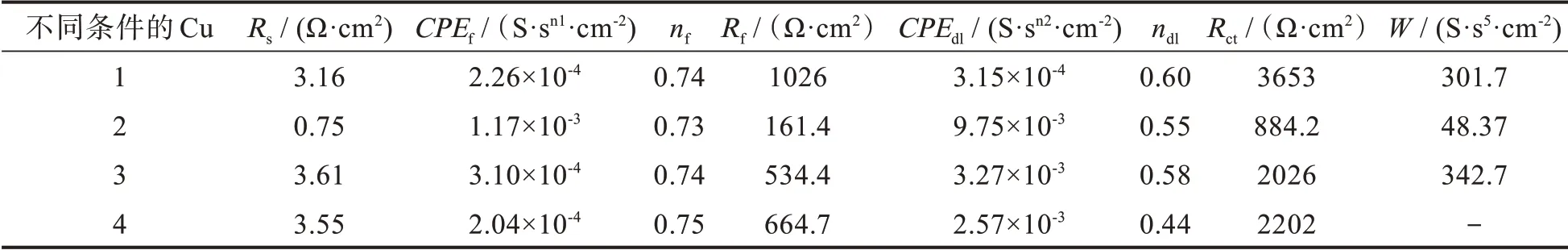
表2 不同條件下銅的EIS 擬合參數Tab.2 EIS fitting results of copper with different conditions
2.4 Cu/Ag 的電偶腐蝕測試
圖8 為不同條件下銅和銀之間的偶合電位和電偶電流密度隨時間的變化。由圖8(a)可知,不同條件下,銅和銀之間的偶合電位均呈現出先負移后逐漸正移的趨勢,這和腐蝕電位的測試結果一致。在腐蝕初期,由于電偶效應和大量氯離子的侵蝕加速了陽極過程導致偶合電位負移。隨著浸泡時間的延長,腐蝕產物的累積導致了陽極過程的抑制而使得偶合電位逐漸正移。由圖8(b)可知,在腐蝕初期(1 h),不同條件下銅和銀之間的電偶電流密度大小順序為:偶合無電場>偶合有電場無電流>偶合有電場有電流。這可能歸因于,在有電場無電流條件下,由于銅和銀之間的電位差減小,銅的阻抗增加,因而導致它們之間的電偶電流密度減小。然后,在有電場有電流情況下,由于電場陰極處氧的還原產生大量的氫氧根離子在電場的作用向電場正極遷移,導致電偶腐蝕的陰極過程被顯著抑制,因此導致電偶電流密度最小。隨著浸泡時間的延長,在有電場情況下,電偶電流密度保持相對穩定的狀態,而在無電場情況下的電偶電流密度呈現逐漸下降的趨勢。這可能歸因于有電場情況下,腐蝕產物物種在電場作用下遷移導致金屬表面腐蝕產物相對較少;而在無電場情況下,由于腐蝕產物的累積抑制了陽極過程,導致電偶電流密度逐漸減小。
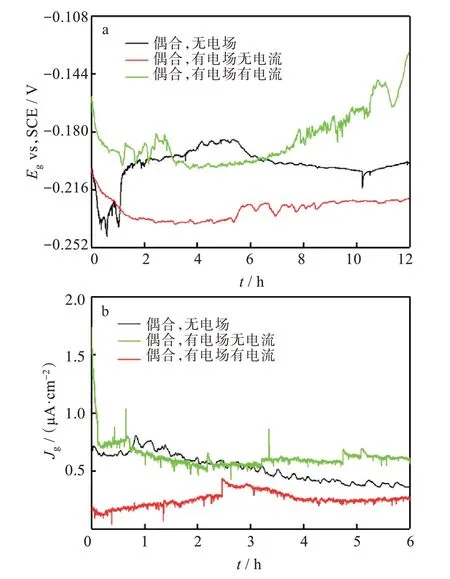
圖8 不同條件下銅和銀之間的偶合電位和電偶電流密度:(a)偶合電位,(b)電偶電流密度Fig.8 Couple potentials and galvanic current densities between copper and silver under different conditions:(a)coupled potentials,(b)galvanic current densities
2.5 微觀形貌和組成分析
圖9 為不同條件下銅在浸泡12 h 后的腐蝕形貌。由圖9(a)(b)可知,在沒有外加電場的情況下,偶合后銅表面沉積的腐蝕產物顯著增加,這歸因于電偶效應加速了銅的腐蝕。由圖9(c,d)可知,在外加直流電場作用下,偶合銅表面沒有明顯的腐蝕產物沉積,特別是在有電流的情況下。這歸因于電場作用下腐蝕產物物種的遷移。

圖9 不同條件下銅在溶液中浸泡12 h 后的腐蝕形貌圖:(a)未偶合銅,(b)偶合銅,(c)偶合銅,有電場,無電流,(d)偶合銅,有電場,有電流Fig.9 SEMs of copper under different conditions after 12 h of immersion:(a)uncoupled copper,(b)coupled copper,(c)coupled copper under electric field without electric current,(d)coupled copper under electric field with electric current
3 結 論
本文通過電化學方法和表面分析技術研究了薄層液膜下外加直流電場對Cu/Ag 電偶腐蝕行為的影響。實驗結果表明外加DCEF 降低了銅的電偶腐蝕速率。外加電場后,在無電流的情況下,DCEF 改變了銅的腐蝕行為,銅銀之間的電位差減小,降低了銅銀之間的電偶效應,從而減緩了銅銀之間的電偶腐蝕速率;在有電流的情況下,由于DCEF 負極處的析氫反應使得局部OH-離子濃度的增加,在電場梯度的作用下向電場正極遷移,從而導致電偶腐蝕的陰極過程受到抑制,因此,進一步抑制了銅銀之間的電偶腐蝕速率。外加電場后,無論是有電流還是無電流,銅的陰極電流密度均較未偶合時大,這可能歸因于電場加速了OH-離子的遷移從而導致銅陰極過程的加速。與無電流相比,外加電場,有電流的情況下,銅陽極電流密度的減小,可能歸因于電場正極板消耗大量了Cl-離子,抑制了銅的陽極反應。該研究對于電子系統腐蝕提供了一些理論依據,為電子元器件銅的腐蝕防護也提供了相關的思路。
金屬在微電子系統的服役環境是非常復雜的,所以在電場條件下,對金屬的電偶腐蝕行為研究方法與手段還需要進一步優化與改進:(1)可以引入多種表征及分析手段,如拉曼光譜、紅外光譜、能譜分析等。(2)在研究外加直流電場下的電偶腐蝕行為基礎上,有機結合電化學測試技術和大氣暴露實驗,深入研究外加電場作用下金屬的電偶腐蝕機制。(3)銅是微電子系統中的常用材料,常常與其他金屬材料聯合使用于PCB 電路板中,因此研究銅與其它金屬材料在外加電場下的電偶腐蝕行為具有重要的實際應用價值。

