線粒體蛋白組解析煙草雄性不育分子機制
柯漁洲 王平松 段麗麗 莫澤君 何 軼 喻奇偉 熊 晶 劉仁祥,*
(1 貴州大學煙草學院/貴州省煙草品質研究重點實驗室,貴州 貴陽 550025; 2 貴州省煙草公司畢節市公司,貴州 畢節 551700)
胞質雄性不育是由核基因組與細胞質基因組共同控制的、表現出雄蕊不能產生有活力的花粉而雌蕊能正常授粉結實的母系遺傳現象,普遍存在于多種植物中[1-2]。目前,我國煙草雜交種和不育系種植越發廣泛,培育煙草不育系和雜交種品種能促進雜種優勢的利用,不僅可以省去人工去雄環節,而且能明顯提高雜交種純度和制種效率[3]。但花粉的形成和發育受多重因素的影響,雄性不育形成的分子機制極其復雜。大多數線粒體蛋白由核基因編碼,并在細胞質的核糖體上合成前體蛋白,經線粒體膜上的TOM復合體(translocase of the outer mitochondrial membrane)通道進入線粒體內部[4],且線粒體作為主要供能單位提供細胞代謝活動所需的90%的能量。因此,通過線粒體蛋白組學探究煙草胞質雄性不育的形成機制具有重要意義。
在煙草雄性不育性的成因研究中,前人主要從細胞形態學方面比較小孢子發育的異同[5-7],明確其敗育的方式和時期。目前已有研究利用線粒體基因組重測序技術挖掘胞質雄性不育基因[8-10],先后發現了orf768a[11]、atp6[12]、orf25[13]、atp9[14]、ms1[15]等多個不育候選基因,利用基因剪輯技術進行基因功能驗證,表明胞質雄性不育與線粒體存在密切關系[16-18],但對煙草胞質雄性不育形成的分子機制鮮見報道。因此,本研究選用煙草雄性不育系云煙87(MSYY87)及其保持系云煙87(YY87)為試驗材料,利用石蠟切片結合線粒體蛋白質組學及生物信息學分析方法,探究煙草胞質雄性不育形成的分子機制,明確線粒體蛋白的表達模式,以期為揭示煙草胞質雄性不育的分子機理提供理論基礎。
1 材料與方法
1.1 試驗材料
以煙草雄性不育系云煙87及其同核異質保持系為試驗材料,材料由貴州省煙草品質研究重點實驗室提供。于2021年在安順市西秀區貴州大學煙草科研基地種植,采用3次重復隨機隨機區組設計。在移栽后25、30、35、40、45 d的花芽分化時期選取長勢均勻的煙株6株,其中3株取頂端5 cm處的花芽在甲醛乙酸乙醇固定液(formaldehyde-acetic acid-ethanol,FAA)中固定,用于石蠟切片觀察,切片厚度8~10 μm,番紅固綠對染,加拿大樹脂封片,拍照觀察。另外3株立刻用液氮保存,后置于-80℃低溫冰箱,后續用于線粒體蛋白分析試驗。
1.2 花芽線粒體蛋白的提取和質檢
選擇分化過程中出現形態差異時期的煙草花芽作為提取線粒體蛋白的材料。采用GMS30034.4v.4線粒體蛋白提取試劑盒(GENMED SCIENTIFICS INC,美國)提取花芽總線粒體蛋白。使用Bradford法繪制標準曲線,計算待測樣品的蛋白濃度。采用12%的聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate poly acrylamide gel electrophoresis, SDS-PAGE)對蛋白質進行分離,凝膠使用eStain LG蛋白染色儀(金斯瑞生物科技有限公司,重慶)進行考馬斯亮藍染色后,應用全自動數碼凝膠圖像分析系統成像。
1.3 TMT標記和液質檢測
6個蛋白樣品經胰蛋白酶Trypsin-TPCK酶切后,分別加入100 mmol·L-1的四乙基溴化銨(tetraethyl ammonium bromide, TEAB)緩沖液和含有不同同位素的串聯質譜標簽(tandem mass tages,TMT)標記的乙腈,渦流混勻,室溫反應1 h,加入5%羥胺終止反應15 min,然后凍干于-80℃保存。使用1100 HPLC高壓液相色譜系統(Agilent,美國)進行組分分離和液相色譜檢測,依次每隔1 min收集洗脫液到1~15號離心管中,然后收樣60 min,收集好后真空冷凍干燥抽干。對樣品進行液相二級質譜(liquid chromatorgraphy-mass spectrometry/mass spectrometry, LC-MS/MS)分析,質譜上機條件:一級圖譜(MS)分辨率設為 70 000, 自動增益控制值設為1e6,最大注射時間為50 ms;質譜掃描設定為全掃描荷質比(m/z)范圍300~1 600, 并對其中10個最高峰進行二級圖譜(MS-MS)掃描;所有圖譜采集使用數據依賴型的正離子模式下的高能碰撞裂解完成,碰撞能量設為32;MS/MS-MS的分辨率設為17 500,自動增益控制設為2e5,離子最大累積時間為80 ms;動態排除時間設為30 s,最終生成質譜檢測原始數據。
1.4 線粒體蛋白鑒定
利用Proteome Discoverer 2.4軟件對檢索結果進一步過濾,可信度在99%以上的譜肽為有效圖譜數(peptide spectrum matches,PSM),至少包含一個肽段的蛋白為可信蛋白,保留可信的有效圖譜肽和蛋白,通過錯誤比例(false discovery rate,FDR)值驗證,去除FDR大于0.01的肽段和蛋白。使用煙草基因組結合uniprot-proteome_UP000084051.fasta作為搜索數據庫對鑒定到的蛋白進行功能注釋和代謝通路注釋。
1.5 蛋白定量分析和差異表達蛋白功能分析
根據原始下機的圖譜峰面積可以得到各個樣品中每個PSM的相對定量值,再根據鑒定出的unique肽段中所包含的PSM定量信息校正得到unique肽段的相對定量值,最后根據每個蛋白質包含的所有unique肽段的定量信息校正得到每個蛋白的相對定量值。將每個蛋白在比較樣品中表達量與對照組表達量的比值作為差異倍數(fold change,FC)。將每個蛋白在樣品中的相對定量值進行T檢驗,P值為顯著性指標。當FC≥1.2,且P≤0.05時,蛋白表達量上調;當FC≤0.83,且P≤0.05時,蛋白表達量下調。針對篩選出來的差異蛋白進行基因注釋(gene ontology,GO)和代謝通路富集(kyoto encylopedia of genes and genomes,KEGG)分析,與所有鑒定到的蛋白背景相比,應用超幾何檢驗方法計算P值,以P≤0.05為閾值,滿足此條件的條目即為在差異蛋白質中顯著富集的條目。
2 結果與分析
2.1 不育系與保持系的花器官形態特征
由花器官形態特征觀察可以看出,MSYY87雄蕊花絲缺失或畸變、無花藥,柱頭變粗并出現部分彎曲,表現為完全雄性不育(圖1-A)。而YY87花絲發育正常,花藥飽滿,花藥略高于柱頭(圖1-B),能正常進行自花授粉。
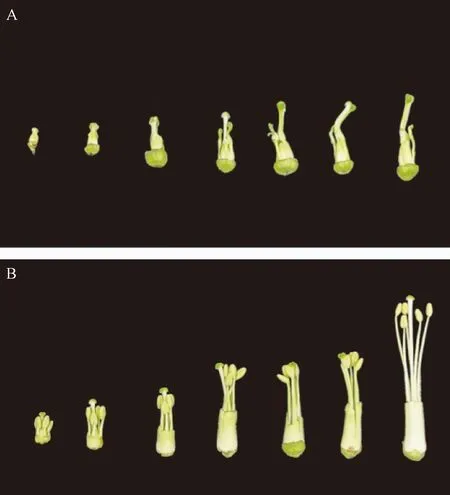
注:A:不育系;B:保持系。Note: A: Sterile line. B: Fertile line.圖1 MSYY87和YY87煙草花器官形態變化Fig.1 Morphological changes of floral organs of tobacco MSYY87 and YY87
2.2 不育系與保持系的小孢子發育形態觀察
隨著葉片數的增加,煙株由營養生長轉向生殖生長,這段生理生化變化被稱為花芽分化過程。觀察煙草MSYY87及YY87的花芽石蠟切片發現,MSYY87在花芽分化起始階段(圖2-A)能正常分化出花序原基;但在雌雄蕊原基分化時期(圖2-B),只有3個雄蕊原基且相互粘連,形態異常,不能正常產生孢原細胞;花粉母細胞時期(圖2-C),絨氈層細胞提前發生程序性死亡,使孢原細胞不能正常分裂為花粉母細胞,最終花絲畸變或雄蕊缺失(圖2-D),無花藥。

注:a~d: 不育系;e~h: 保持系。a、e:花序原基形成期;b、f:雌雄蕊原基分化時期花芽橫切面×200;c、g:花粉母細胞時期×200;d、h:花粉成熟期(d×50,h×200)。TP:花序原基;PP:雌蕊原基;SP:雄蕊原基;E:表皮層;En:內皮層;ML:中間層;T:絨氈層;P:雌蕊;S:雄蕊;PG:花粉粒。Note: a~d: Sterile line. e-h: Maintainer line. a,e: Inflorescence primordium formation stage. b,f: Cross section of flower bud at the primordia differentiation stage×200. c,g: Pollen mother cell stage×200. d,h: Pollen maturity stage(d×50, h×200). TP: Inflorescence primordium. PP: Pistil primordium. SP: Stamen primordium. E: Epidermis. En: Endodermis. ML: Middle layer. T:Tapetum. P: Pistil. S: Stamens. PG: Pollen grains.圖2 煙草MSYY87與YY87小孢子發育形態差異Fig.2 Morphological differences of microspore development between MSYY87 and YY87 in tobacco
YY87在花序原基形成期(圖2-E)正常分化出花序原基,此時煙株出葉速度快,隨著發育進行,逐步分化出1個雌蕊原基和5個雄蕊原基,隨著孢原細胞繼續平周分裂產生造胞細胞;造胞細胞(圖2-G)能分裂形成花粉母細胞,花粉母細胞繼續分裂產生小孢子,在藥室中有成熟花粉(圖2-H)。選擇在雌雄蕊原基分化時期的花芽來做線粒體蛋白組分析。
2.3 蛋白的質檢與分析鑒定
線粒體蛋白的SDS-PAGE結果顯示,各樣品的條帶清晰,說明提取線粒體蛋白質量較好,未受到污染(圖3)。利用可信蛋白的表達量進行各樣本間的主成分分析(圖4),從不同維度可發現MSYY87與YY87樣品間存在明顯差異,可進行后續試驗。再通過數據庫搜索,鑒定到二級圖譜(MS-MS)總數 285 815 個,有效圖譜數(PSM)5 828個,肽段(peptides)數 3 580 個,蛋白數(protein groups)1 251個。

圖3 煙草花芽線粒體蛋白的SDS-PAGE圖譜Fig.3 SDS-PAGE map of mitochondrial protein from tobacco flower bud

圖4 煙草花芽線粒體蛋白質樣品的主成分分析Fig.4 Principal component analysis of mitochondrialprotein samples from tobacco flower buds
2.4 差異表達蛋白
根據限制條件篩選差異表達蛋白,在注釋到的 1 251 個蛋白中,對每個蛋白質差異倍數以2為底取對數,將P值以10為底取對數的絕對值,繪制火山圖(圖5)以分析可信蛋白在不同樣品間的上調、下調情況。2組樣品無顯著差異的蛋白為735個,差異表達蛋白總數為113個,其中CMSYY87較YY87顯著上調的蛋白為48個,顯著下調的蛋白為65個。說明MSYY87與YY87線粒體蛋白的表達存在差異,上述差異蛋白可能是導致不育系產生的關鍵原因,進一步推測其可能在不育系的線粒體中發生代謝紊亂。

圖5 MSYY87與YY87差異表達蛋白火山圖Fig.5 Volcano diagram of differentially expressed proteinsof MSYY87 and YY87
2.5 差異蛋白的GO功能富集分析
差異蛋白GO顯著性富集分析主要包括生物學過程、細胞組分以及分子功能。經GO功能富集分析,兩類煙草樣品中的113個蛋白去除僅包含1個差異蛋白的條目,剩余30個可靠的GO條目。其中,達到顯著富集(P<0.05)水平的GO條目為30個,屬于生物學過程10個、細胞組分10個、分子功能10個(圖6)。生物過程類別分別為糖酵解過程(glycolytic process)、脂質運輸過程(lipid transport)、未折疊蛋白細胞響應(cellular response to unfolded protein)、內質網對未折疊蛋白響應(endoplasmic reticulum unfolded protein response)、重折疊蛋白過程(protein refolding)、內質網泛素依賴性降解途徑(ubiquitin-dependent ERAD pathway)、蛋白重折疊依賴性伴侶結合蛋白(chaperone cofactor-dependent protein refolding)、脂類代謝過程(lipid catabolic process)及內質網應急響應(response to endoplasmic reticulum stress)。
注釋到細胞組分,分別包括細胞溶質(cytosol)、細胞膜(membrance)、細胞核(nucleus)、內質網膜泡(endoplasmic reticulum lumen)、內質網膜互作復合體(endoplasmic reticulum lumen chaperone complex)、液泡(vacuole)、磷酸丙酮酸水合酶復合體(phosphopyruvate hydratase complex)及完整地膜組分(integral component of membrane)。
注釋到的分子功能,分別為營養庫活性(nutrient reservoir activity)、蛋白質二硫鍵異構酶活性(protein disulfide isomerase)、酰基甘油脂肪酶活性(acylglycerol lipase activity)、錯誤折疊結合蛋白(misfolded protein binding)、折疊蛋白伴侶(protein folding chaperone),磷脂酶活性(phospholipase activity)、及熱休克蛋白結合物(heat shock protein binding)、磷酸丙酮酸水合酶活性(phosphopyruvate hydratase activity)、二磷酸果糖醛縮酶活性(fructose-bisphosphate aldolase)及葡萄糖醛酸脂脫羧酶活性(UDP-glucuronate decarboxylase activity)。

圖6 GO富集柱狀圖Fig.6 Histogram of GO enrichment
2.6 差異蛋白的KEGG代謝通路分析
通過對差異蛋白進行KEGG代工謝通路分析(圖7),主要分為有機物代謝途徑、遺傳物質代謝及次生代謝物合成和抗氧化代謝三類。有機物代謝主要為細胞呼吸的系列反應,主要包括糖酵解和糖原異生途徑(glycolysis/gluconeogenesis)、果糖和甘露糖代謝(fructose and mannose metabolism)、氨基糖和核苷酸糖代謝(amino sugar and nucleotide sugar metabolism)、磷酸戊糖途徑(pentose phosphate pathway)、光合固碳有機體(carbon fixation in photosynthetic organisms)、丙酮酸代謝(pyruvate metabolism)、三羧酸循環(tricarboxylic acid, TCA)、甘油酯代謝(glycerolipid metabolism);遺傳物質代謝途徑主要包括RNA降解(RNA degradation)、內質網加工蛋白過程(protein processing in endoplasmic reticulum)、蛋白外運(protein export)、蛋白酶體(proteasome)、色氨酸代謝(tryptophan metabolism)、組氨酸代謝(hisidine metabolism);次生代謝產物合成和抗氧化代謝主要包括過氧化物酶體(peroxisome)、抗壞血酸和醛達酸代謝(ascorbate and aldarate metabolism)、谷胱甘肽代謝(glutathione metabolism)、類黃酮生物合成(flavonoid biosynthsis)、苯丙素生物合成(phenylpropanoid biosynthsis)。

圖7 KEGG富集氣泡圖Fig.7 KEGG enrichment bubble diagram
3 討論
通過煙草花芽的石蠟切片結果可知,MSYY87在發芽分化早期(雌雄蕊原基分化期)開始出現小孢子發育異常現象,這與前人的煙草雄性敗育發生在雄蕊原基分化后至孢原細胞形成前的觀點基本一致[5-6]。因此選用雌雄蕊分化時期的花芽進行線粒體蛋白組學分析。TMT標記是一種高分辨率高通量的蛋白定量檢測技術[19]。本試驗通過線粒體蛋白質組學TMT標記結合高效液相色譜質譜聯用技術和生物信息學分析,共鑒定出1 251個蛋白,在MSYY87和YY87的花芽中表達差異顯著的線粒體蛋白113個,其中48個蛋白在MSYY87的花芽中高表達,65個蛋白在YY87的花芽高表達。兩類樣品中表達差異的蛋白富集到7個類別細胞組分,分別為細胞溶質、細胞膜、細胞核、內質網膜泡、內質網膜復合體及細胞液泡。這與線粒體蛋白要經核基因在細胞質核糖體上翻譯、加工成前體蛋白,再運輸到作用部位線粒體的觀點[20]相一致,說明本研究采用的線粒體蛋白組研究方法可行,鑒定出的差異蛋白具有較高的可信度。
GO功能富集分析主要注釋到生物過程中糖酵解和脂的運輸代謝,脂肪轉運和代謝過程通常在線粒體基質中進行[21-22],對呼吸代謝有著重要的意義;由于線粒體相關呼吸代謝酶差異表達,致使線粒體代謝紊亂[23-24],注釋到的分子功能中營養庫活性、磷酸丙酮酸水合酶及二磷酸果糖醛縮酶等呼吸酶,推測線粒體代謝紊亂與煙草雄性不育有關。蛋白質空間結構的修飾影響其功能和作用。已有研究報道二硫鍵異構酶亞基[25-26]與熱休克蛋白[27]參與協同催化氧化蛋白折疊修飾過程,在擬南芥[27]中線粒體熱休克同源蛋白(mtHSC70-1)缺失突變體的花形態、花藥發育存在明顯缺陷,導致育性顯著減低,且經蛋白組學分析發現,在線粒體呼吸中電子傳遞和蛋白折疊的生物學過程發生改變。注釋到的生物過程有未折疊蛋白細胞反應過程、未折疊蛋白內質網反應、蛋白質重折疊過程、內質網泛素依賴性降解途徑、重折疊蛋白的伴侶蛋白復合體及內質網應急反應過程,及注釋到分子功能中的蛋白二硫鍵異構酶活性、錯誤折疊結合蛋白及熱休克蛋白,說明不育系中的線粒體蛋白的修飾受到影響。當線粒體受到細胞內外的脅迫刺激,會通過HDA-1調控線粒體未折疊蛋白反應的途徑來維持線粒體內的穩態和功能,當線粒體受損信號傳遞至細胞核,可促進核編碼的應激基因上調表達,從而保護和修復受損線粒體[28]。由此即推測,當煙草不育系線粒體基因與核基因之間互作不協調的信號不能傳遞給細胞核,則不能促進核編碼的應激基因上調表達,修復線粒體功能紊亂中斷,從而影響小孢子的形成和發育。
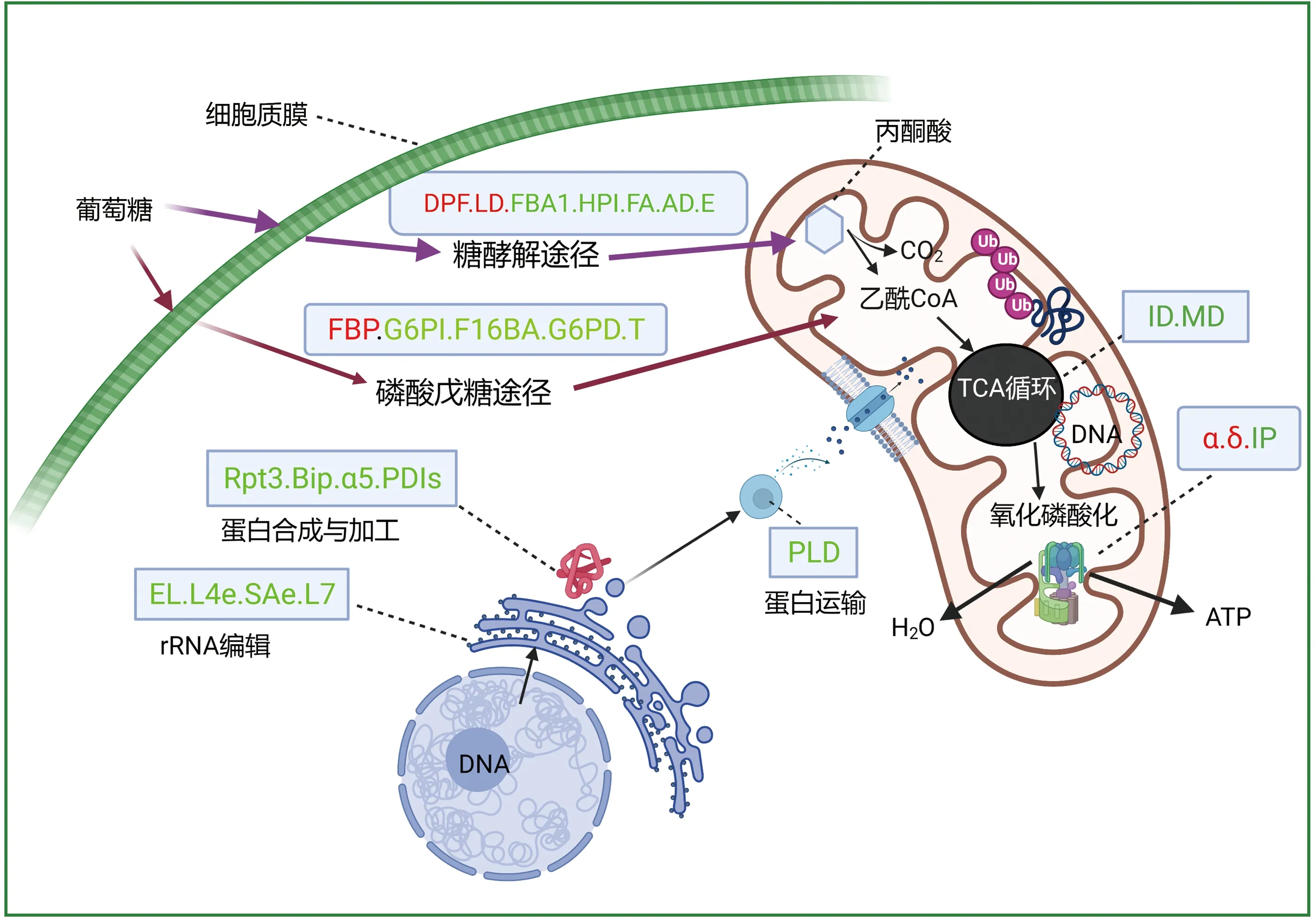
注:圖中字符表示酶或者亞基。紅色表示上調蛋白,綠色表示下調蛋白。Note: The characters in the figure indicate enzymes or subunits. Red represents up-regulated proteins and green represents down-regulated proteins.圖8 MSYY87花芽線粒體代謝紊亂圖Fig.8 Mitochondrial metabolic disorders in sterile lines
植物呼吸代謝是在線粒體中將有機物逐步氧化并釋放能量供其利用的生物學過程[29]。通過KEGG通路富集分析發現,磷酸戊糖途徑的6-磷酸葡萄糖異構酶G6PI(glucose-6-phosphate isomerase)、1,6-二磷酸果糖醛縮酶F16BA(fructose-bisphosphate aldolase)、轉醛酶T(transaldolase)、6-磷酸葡萄糖脫氫酶G6PD(6-phosphogluconate dehydrogenase)都下調表達,推測磷酸戊糖途徑代謝受阻(圖8)。首先糖酵解途徑中磷酸己糖異構酶(GPI)、果糖醛縮酶FA(fructose aldolase)、烯醇化酶E(enolase)、乙醇脫氫酶AD(alcohol dehydrogenase)都表現下調表達,說明丙酮酸生成受到抑制,其次在三羧酸循環途徑中蘋果酸脫氫酶(malate dehydrogenase,MD)和異檸檬酸脫氫酶(isocitrate dehydrogenase,ID)下調表達,然后在氧化磷酸化過程中焦磷酸酶(inorganic pyrophosphatase,IP)表達下調,ATP合酶的F1中α亞基(F-type H+-transporting ATPase subunit alpha)和δ亞基(ATPase subunit delta)蛋白表達上調,說明ATP合酶結構異常,最終結果說明由于蛋白酶下調和亞基異常導致不育系線粒體呼吸代謝過程ATP合成受阻。這與Wang等[30]研究相似,即細胞缺失C9orf72線粒體蛋白后,在合成ATP的氧化磷酸化途徑活性下調,最終誘導細胞死亡,其原因是C90r72蛋白通過招募抗增值蛋白(prohibitin,PHB)來阻斷氧化磷酸化中復合體I組裝因子TIMMDC1的降解,穩定復合體I的有效組裝和維持正常產能反應。
植物線粒體中RNA編輯調控線粒體PPR蛋白的形成[31]。RNA的穩態由轉錄速率和降解速率之間的平衡決定,核糖體RNA的穩定可能受核糖體蛋白裝配過程影響[32]。本研究發現核糖體RNA的大亞基L4e(large subunit ribosomal protein L4e)、L7(large subunit ribosomal protein L7)及小亞基中SAe(small subunit ribosomal protein SAe)的表達異常,調控RNA降解的烯醇酶EL(enolase)下調表達(圖8),說明核糖體RNA失調會影響線粒體蛋白裝配。多數線粒體蛋白由核基因編碼[33],經核糖體翻譯成的前體蛋白由線粒體外膜TOM復合體通道進入線粒體內,當線粒體蛋白導入受阻,通過改變蛋白酶體活性和伴侶蛋白水平調控線粒體蛋白表達[34-36]。研究發現,Ubx2與線粒體膜上TOM復合體結合并通過蛋白酶體去除未成功導入的前體蛋白,維持TOM通道的流暢[4]。本研究發現不育系中內質網蛋白加工酶(endoplasmic reticulum chaperone BiP)、蛋白二硫鍵異構酶(protein disulfide-isomerase,PDIs)和磷脂酶(phospholipase D,PLD)均下調表達,使線粒體蛋白的修飾和導入受阻,且蛋白酶復合體的PA700亞基Rpt3(proteasome regulatory subunit T3)和20S小亞基α5(proteasome subunit alpha 5)表達下調(圖8),導致蛋白酶體功能失調,不能降解未導入線粒體的前體蛋白,使線粒體蛋白的導入受阻而功能紊亂,不能維持花粉形成時細胞快速分裂分化所需的能量而小孢子形成中斷。
4 結論
本研究發現,煙草胞質雄性不育發生在發芽分化的雌雄蕊原基分化時期;不育系在線粒體蛋白修飾和導入過程中,內質網蛋白加工酶(BiP)、蛋白二硫鍵異構酶(PDIs)和磷脂酶(PLD)等下調表達,說明線粒體蛋白導入受阻,引起線粒體功能紊亂。存在線粒體呼吸代謝中6-磷酸葡萄糖脫氫酶(G6PD)、蘋果酸脫氫酶(MD)和焦磷酸酶(IP)等表達下調,說明呼吸代謝受阻。由此推測,煙草胞質雄性不育由于線粒體蛋白的合成、修飾及導入受阻,致使線粒體功能紊亂,即在呼吸代謝途經中蛋白酶下調表達,抑制了ATP的合成,從而不能為小孢子形成過程中的快速分裂分化提供充足的能量和營養物質,抑制了小孢子的形成和發育,表現為雄性不育。

