淫羊藿總黃酮和戊酸雌二醇對骨質疏松癥大鼠TGF-β1/Smads信號通路的影響
肖平 侯平 林正堅 劉元豪 周鋼
1.海口市第三人民醫院骨科,海南 海口 571100
2.海南省人民醫院(海南醫學院附屬海南醫院)關節外科,海南 海口 570311
骨質疏松癥(osteoporosis,OP)已成為威脅中老年人健康的一種常見和多發骨代謝疾病,隨著全球人口老齡化程度的加劇,OP的發病率逐年上升,尤其是絕經后骨質疏松癥(postmenopausal osteoporosis,PMOP)。OP嚴重危害老年人的生活質量和身體健康[1]。因此,OP已是不可忽視的重要世界衛生問題。目前,雌激素、鈣劑等是臨床治療OP的常用藥物,雖取得了一定療效,但長期使用不良反應較大,且價格昂貴[2]。近年來,中醫藥在防治OP上具有獨特優勢,淫羊藿總黃酮(total flavonoids of epimedium,TFE)具有抗骨質疏松作用,TFE可通過促進成骨細胞分化和抑制破骨細胞骨吸收來預防骨量丟失,尤其對PMOP具有良好的保護作用[3]。近年研宄表明TGF-β1/Smads信號通路與骨形成密切相關[4]。因此,本文基于TGF-β1/Smads信號通路探討淫羊藿總黃酮和戊酸雌二醇對骨質疏松大鼠的實驗研究。
1 材料與方法
1.1 實驗動物
6月齡健康成年雌性SD大鼠75只,清潔SPF級,體質量(265.28±36.32)g,購于海南藥物研究所有限責任公司[實驗動物許可證號:SCXK(瓊)2020-0007]飼養于海南醫學院實驗動物中心,同等飼養條件[環境溫度(22±3)℃、濕度50%,自由食水]。本研究通過海南醫學院動物實驗中心倫理委員會批準。
1.2 實驗試劑和儀器
淫羊藿總黃酮膠囊(TFE)(江蘇康緣陽光藥業有限公司),戊酸雌二醇片(廊坊高博京邦制藥有限公司),羊抗鼠TGF-β1、Smads和GAPDH多克隆抗體購于美國Sigma公司,TGF-β1、Smads2和GAPDH引物由英國Biorbyt公司設計并合成,血清鈣(Ca)、磷(P)、堿性磷酸酶(ALP)、骨鈣素(OC)、Ⅰ型原膠原N端前肽(PINP)檢測試劑盒購于北京中杉金橋生物技術有限公司。全自動生化分析儀購于日本HITACHI公司,Dexa Pro-1型雙能X射線骨密度儀購于美國Bose公司,骨生物力學萬能材料試驗機購于滄州市鑫鼎試驗儀器有限公司,PIDRed 96型聚合酶鏈式反應(PCR)儀購于美國LUNAR公司。
1.3 方法
1.3.1實驗分組、造模與藥物干預:以隨機數字法分為假手術組(Sham組)、模型組(Model組)、淫羊藿總黃酮組(TFE組)、雌二醇組(E2V組)、聯合藥物組(TFE+E2V組),15只/組。除Sham組外,其余4組大鼠均采用“卵巢摘除法”構建骨質疏松大鼠模型[5]。常規麻醉備皮消毒,背側腰椎棘突旁開1 cm處,0.8~1 cm縱行切口,鈍性分離,結扎輸卵管,切除菜花狀卵巢并徹底止血。Sham組僅切除卵巢周圍等量脂肪,但不摘除卵巢,術后青霉素預防感染,造模成功評估標準:骨密度降低和骨小梁微結構嚴重受損[6]。12周后開始給予灌胃藥物干預,1次/d,藥物劑量按照動物劑量體表面積換算公式進行折算,Sham組和Model組:等量0.9% Nacl灌胃,TFE組:淫羊藿總黃酮膠囊(150 mg/kg),E2V組:戊酸雌二醇片(0.6 mg/kg),TFE+E2V組:淫羊藿總黃酮膠囊(150 mg/kg)+戊酸雌二醇片(0.6 mg/kg)。連續給藥12周后處死各組大鼠。
1.3.2組織樣品采集:于末次給藥后禁食8~12 h,采用心臟抽血處死大鼠,心臟取血5 mL至離心管,3 000 r/min,4 ℃離心5 min,分離血清,-20 ℃保存待測,完整剖離右側整段股骨和腰椎(L3~5),截取長2~5 cm腰椎和股骨,0.9% Nacl沖洗,0.9% Nacl濕紗布包裹,待檢測,檢測完畢留取-80 ℃保存,后置液氮凍存備用。另留部分股骨10%多聚甲醛(室溫)固定48 h,75%乙醇過夜,10%乙二胺四乙酸(EDTA)脫鈣2~3周。將右側股骨沿矢狀面切開,脫水透明,浸蠟包埋,常規石蠟切片,60 ℃烤箱,室溫保存備用。
1.3.3檢測大鼠血清骨代謝指標:取出待測血清樣品,海南省人民醫院檢驗科采用全自動生化分析儀檢測血清鈣(Ca)、磷(P)、堿性磷酸酶(ALP)、骨鈣素(OC)、Ⅰ型原膠原N端前肽(PINP)含量。
1.3.4檢測股骨和椎體骨密度和灰重比:采用雙能X線吸收(DEXA)法檢測骨密度(BMD),將標本放置于儀器上,小動物BMD分析軟件分析,掃面信息區為興趣區,感興趣區BMD分析。檢測完畢后取出標本,置60 ℃烤箱中過夜,取出標本置于電子天平稱其干重,再置于800 ℃馬氏爐煅燒6~8 h,關爐,冷卻后電子天平稱其灰重,計算灰重/干重百分比(灰重/干重百分比=灰重/干重×100%)。
1.3.5檢測股骨骨骼生物力學參數:取出凍存標本,置于室溫復溫30 min,三點彎曲試驗,固定標本兩端,股骨中點加載點,掃描參數(支點跨距18 mm,加載速度2 mm/min),依據載荷-應力-變形曲線獲得骨生物力學相關參數。
1.3.6檢測股骨形態計量學參數:常規進行脫蠟復水,蘇木精-伊紅染液進行染色,參照常規H & E染色進行操作,光學顯微鏡下觀察,HMROVT顯微圖像分析軟件進行骨形態分析,靜態參數[骨小梁厚度(Tb.Th)、骨小梁分離度(Tb.Sp)、骨小梁數量(Tb.N)、單位骨小梁面積破骨細胞數(Oc.N)、骨小梁面積百分數(Tb.Ar)]。
1.3.7檢測股骨TGF-β1/Smads蛋白表達:常規脫蠟水化,依據SP試劑盒說明書逐步操作,3% H2O2封閉,10%血清室溫孵育,滴加稀釋兔抗鼠TGF-β1/Smads多克隆抗體,4 ℃過夜,滴加羊抗兔Ig二抗,DAB顯色反應,蘇木素核復染,光學顯微鏡觀察,Image proplus 6.0圖象分析系統測量平均積分光密度值(IOD)。
1.3.8檢測各組大鼠股骨TGF-β1/Smads2 mRNA表達:取出待測股骨組織,液氮中研成粉末并進行勻漿,參照實時熒光定量PCR(RT-qPCR)法試劑盒說明書采用Trizol法進行提取總RNA,鑒定RNA純度、濃度,RNA逆轉錄合成cDNA,cDNA為模板PCR擴增,PCR反應體系:TGF-β1上游引物:5’-GACAACTTCCTGTGCTCT-3’,反向引物:下游引物:5’-ACCGAAACTCTTGCCTCTTC-3’,Smads:上游引物:5’-GGTATCGGACGCCTGGTA-3’,下游引物:5’-TGTGCTTAGCGTCCTACTGGAAA-3’,逆轉錄和PCR擴增體系參照試劑盒說明書設定,PCR反應條件:94 ℃預變性7 min;95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸1 min,共40個循環,擴增曲線和熔解曲線分析,以GAPDH內參,瓊脂糖凝膠電泳法檢測PCR產物,2-ΔΔCt法計算各目標基因mRNA表達水平。
1.4 統計學分析
采用SPSS 25.0統計學軟件進行分析,計量資料以“均數±標準差”表示,單因素方差分析(One-way ANOVA),兩兩比較采用Student Newman Keuls檢驗,如方差齊LSD-t檢驗,如方差不齊則Tamhane’sT2檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 血清骨代謝指標
Model組血清Ca、P、OC、PINP較Sham組顯著降低(P<0.01),E2V組、TFE組、TFE+E2V組血清Ca、P、OC、PINP較Model組均顯著增加(P<0.05),TFE+E2V組血清Ca、P、OC、PINP較E2V組、TFE組均顯著增加(P<0.05)。Model組血清ALP較Sham組顯著增加(P<0.05),E2V組、TFE組、TFE+E2V組血清ALP較Model組均顯著降低(P<0.05),TFE+E2V組血清ALP較E2V組、TFE組均顯著降低(P<0.05)。見表1。
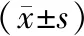
表1 各組大鼠骨代謝指標Table 1 Bone metabolism indexes of rats in each group
2.2 股骨和椎體骨密度、灰重比
Model組股骨和椎體骨密度、灰重比較Sham組顯著降低(P<0.01),E2V組、TFE組、TFE+E2V組骨密度、灰重比較Model組均顯著增加(P<0.05),TFE+E2V組骨密度、灰重比較E2V組、TFE組均顯著增加(P<0.05)。見表2。
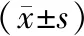
表2 各組大鼠骨密度和灰/干重比
2.3 股骨生物力學指標
Model組股骨最大載荷、最大位移、最大應力和彈性模量較Sham組顯著降低(P<0.05),E2V組、TFE組、TFE+E2V組最大載荷、最大位移、最大應力和彈性模量較Model組均顯著增加(P<0.05),TFE+E2V組最大載荷、最大位移、最大應力和彈性模量較E2V組、TFE組均顯著增加(P<0.05)。見表3。
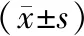
表3 各組大鼠骨生物力學指標Table 3 Bone biomechanics indexes of rats in each
2.4 股骨形態計量學參數
Model組股骨Tb.Ar、Tb.Th、Tb.N較Sham組均顯著降低(P<0.01),E2V組、TFE組、TFE+E2V組Tb.Ar、Tb.Th、Tb.N較Model組均顯著增加(P<0.05),TFE+E2V組Tb.Ar、Tb.Th、Tb.N較E2V組、TFE組均顯著增加(P<0.05);Model組股骨Tb.Sp、Oc.N較Sham組顯著增加(P<0.05),E2V組、TFE組、TFE+E2V組Tb.Sp、Oc.N較Model組均顯著降低(P<0.05),TFE+E2V組Tb.Sp、Oc.N較E2V組、TFE組均顯著降低(P<0.05)。見圖1和表4。
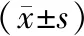
表4 各組大鼠股骨骨形態計量學靜態參數Table 4 The static parameters of femoral bone morphometry of rats in each
2.5 股骨TGF-β1/Smads2蛋白表達水平
TGF-β1和Smads2均表達于股骨骨小梁周圍成骨細胞胞漿和部分胞核,陽性染色呈棕黃色顆粒或棕黃色彌漫成片。Model組股骨TGF-β1和Smads2蛋白表達較Sham組顯著降低(P<0.01),E2V組、TFE組、TFE+E2V組TGF-β1和Smads2蛋白表達較Model組均顯著增加(P<0.05),TFE+E2V組較E2V組、TFE組TGF-β1和Smads2蛋白表達均顯著增加(P<0.05)。見圖2、圖3和表5。

表5 各組大鼠股骨TGF-β1/Smads2蛋白表達水平Table 5 The expression level of TGF-β1/Smads 2 protein in the femur of rats in each group
2.6 股骨TGF-β1/Smads2 mRNA表達水平
Model組大鼠股骨TGF-β1和Smads2 mRNA表達較Sham組顯著降低(P<0.01),E2V組、TFE組、TFE+E2V組TGF-β1和Smads2 mRNA表達較Model組均顯著增加(P<0.05),TFE+E2V組較E2V組、TFE組TGF-β1和Smads2 mRNA表達均顯著增加(P<0.05)。見表6。

表6 各組大鼠股骨TGF-β1/Smads2 mRNA表達水平Table 6 The expression level of TGF-β1/Smads2 mRNA in the femur of rats in each group
3 討論
OP應歸屬于中醫學“骨痹、骨痿、骨枯”等范疇,祖國醫學“腎藏精,精生髓,髓生骨,精足則髓足,髓足則骨強”[7-8]。中醫認為腎藏精,主骨生髓理論,骨痿、骨枯的發生與腎虛關系頗為密切,OP發生原因是因腎精不足、骨失滋養所導致的[9]。“腎為先天之本,主骨生髓”,骨的生長、發育與腎密切相關[10]。故近年來中醫藥防治骨質疏松癥多使用補腎藥,能明顯改善OP患者臨床癥狀。淫羊藿(Epimedium)作為傳統的補腎壯陽中藥,屬于小檗科植物淫羊藿的全草入藥,具有補腎陽、益精氣、堅筋骨、祛風濕的功效,是臨床中治療骨質疏松的常用藥[11]。黃酮類化合物是淫羊藿的主要化學成分,TFE即可影響成骨細胞增殖、分化,促進骨形成,又可抑制破骨細胞生成,減少骨質丟失,抑制骨吸收,改善骨代謝,具有顯著防治骨質疏松的作用[12-13]。研究表明合用雌激素,發揮較強的抑制骨轉換作用,對增加骨量可能有協同作用,同時淫羊藿具有雄激素樣作用,從而可對抗雌激素的毒副作用[14]。
轉化生長因子β-1(transforming growth factor-β,TGF-β1)/Smads通路在骨重建中發揮著重要的作用[15]。TGF-β1是參與骨重建調節過程中最重要的生長因子,能促進成骨細胞增殖分化,刺激骨形成,同時加快破骨細胞形成及骨吸收,是骨形成和骨吸收過程中重要調節偶聯因子,調節骨重建,維持骨代謝的平衡[16]。Smads蛋白家族是TGF-β唯一的細胞內信號轉導因子,TGF-β1可活化下游Smad蛋白,最終將TGF-β的信號應答由胞膜轉導入胞核內,啟動靶基因轉錄,刺激骨形成[17]。Smad7是TGF-β/Smads通路上的抑制蛋白,可抑制阻止TGF-β1信號傳導,在骨形成和骨重建過程中起著極其重要的作用[18]。研究證明TGF-β/Smads通路與骨質疏松癥有密切關系[19]。
淫羊藿總黃酮溫腎壯陽,戊酸雌二醇補雌激素,是中西醫藥防治PMOP的常用藥物,二者合用,有平補陰陽、益腎健骨的功效,本研究表明去勢大鼠骨組織smad2/3的蛋白和mRNA表達均降低,骨密度、骨生物力學指標、骨代謝和骨量等指標均降低,給予淫羊藿總黃酮和戊酸雌二醇藥物治療后可以明顯提高OP大鼠骨組織中TGF-β1蛋白及mRNA的表達,糾正骨代謝紊亂,增加骨量,提高骨密度和骨強度,改善骨微結構,促進骨形成,抑制骨吸收。淫羊藿總黃酮聯合戊酸雌二醇可能通過調控骨組織TGF-β1/Smads信號轉導通路有效防治OP。淫羊藿總黃酮可通過上調骨TGF-β1/Smads2的mRNA和蛋白表達,增加BMD和骨小梁數量,改善股骨微結構,提高血清骨代謝水平,從而修復骨構建失衡,起到防治OP的作用[20-21]。
OP的發病機制與TGF-β1/Smads信號轉導通路密切相關,淫羊藿總黃酮聯合戊酸雌二醇可能通過調節TGF-β1/Smads信號轉導通路,防止骨質疏松大鼠骨量丟失,改善骨代謝,修復骨顯微結構,提高骨強度,從而發揮防治骨質疏松的作用,并為以后探索中西醫預防OP方面奠定了堅實的理論基礎。

