肌骨系統中運動干預肌肉與骨骼交互功能的機制研究進展
徐帥 徐道明 沈飛


摘 要:肌肉和骨骼屬于內分泌器官,具有交互作用,共同構成肌骨系統。基于肌骨系統的整合性生物學機制,肌肉分泌因子作用于骨骼組織,肌肉分泌因子對骨細胞、成骨細胞和破骨細胞具有調節作用,并通過運動刺激刺激骨生成,抑制骨吸收。骨骼分泌因子作用于肌肉組織,骨骼分泌因子對肌肉質量和肌肉功能具有調節作用,并通過運動刺激提高肌肉質量,緩解肌肉流失。研究基于整合生物學研究視角,經肌骨系統理論挖掘肌肉和骨骼在交互機制中的功能作用,以運動干預為應力性刺激手段,對肌肉分泌因子與骨骼分泌因子的傳遞功能進行分析,為運動改善肌骨系統提供新思路,為促進和保持肌肉與骨骼的健康發展提供理論支持。
關鍵詞:肌骨系統;肌肉;骨骼;運動;交互作用
中圖分類號:G804.2?? 文獻標識碼:A? 文章編號:1006-2076(2022)02-0091-09
Research Progress in the Mechanism of Exercise Intervention in the Interactive Function of Muscle and Bone in the Musculoskeletal System
XU Shuai1,XU Daoming2,SHEN Fei3
1. Institute of P.E., Huaiyin Normal University, Huai'an 223300, Jiangsu, China; 2. Dept. of Acupuncture and Rehabilitation, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, Jiangsu, China; 3. Institute of P.E., Jiangsu Normal University, Xuzhou 221116, Jiangsu, China
Abstract: Muscle and bone are endocrine organs that interact to form the musculoskeletal system. Based on the integrated biological mechanism of the musculoskeletal system, muscle secreted factors act on bone. Muscle secreted factors have regulatory effects on osteocytes, osteoblasts and osteoclasts, and stimulate osteogenesis and inhibit bone resorption through exercise stimulation. Skeletal secreted factors act on muscle, and skeletal secreted factors have a regulatory effect on muscle mass and muscle function, and improve muscle mass and relieve muscle loss through exercise stimulation. Based on the perspective of integrative biology research, this paper explores the functional role of muscle and bone in the interaction mechanism through the theory of musculoskeletal system. And uses exercise intervention as a stress stimulation method to analyze the transmission function of muscle secreted factors and bone secreted factors. Exercise provides new ideas for improving the musculoskeletal system to promote and maintain healthy muscle and bone development.
Key words:musculoskeletal system; muscle; skeleton; exercise; interactive function
肌肉和骨骼作為關系緊密的毗鄰性結構組織,均從中胚層發育而來,共同決定機體組織含量,以此達到共調控的平衡發展狀態[1]。在機體發育、成長和衰老過程中,肌肉和骨骼可形成復雜性結構——肌肉骨骼單元,由此構建出肌骨系統(Musculoskeletal System, MS)學說。肌骨系統主要由骨骼、肌肉、肌腱、韌帶和關節軟骨組成,在物理和機械中相互作用,以確保機體運動、肌骨代謝和體內平衡。其中肌肉和骨骼對機能代謝具有相互影響的特殊作用,并支持機體站立、功能活動以及保護重要器官等。骨骼提供穩定性,通過肌腱和韌帶等結締組織與其他骨骼和肌肉相關聯。肌肉將骨骼固定并允許運動活動[2]。肌肉骨骼單元發生過程中,肌肉質量下降和肌肉力量減弱時,伴隨骨量減少現象。骨骼質量下降和骨密度(Bone Mineral Density, BMD)下降會誘發肌肉衰減發生。肌肉和骨骼除存在解剖學和生理學的相互影響外,運動刺激水平對肌肉和骨骼質量的變化亦存在著關聯作用,其低強度力學信號對肌肉和骨骼的合成均有促進作用[3]。EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
運動干預肌肉與骨骼交互功能機制對肌骨系統具有重要調節作用,肌肉和骨骼作為最直接感知運動的靶器官,通過其內分泌、旁分泌和自分泌功能共同參與機體組織器官的能量代謝調控作用[4]。肌骨系統機制中,肌源性分泌因子包括肌抑素(Myostatin, MSTN)、鳶尾素、基質金屬蛋白酶2(Matrix Metalloproteinase-2, MMP2)、β-氨基異丁酸(Beta-Aminoisobutyric Acid, BAIBA)、胰島素樣生長因子1(Insulin Like Growth Factor-1, IGF-1)以及成纖維細胞生長因子2(Fibroblast Growth Factor-2, FGF-2)等。骨骼作為骨內分泌系統(Bone Endocrine System)可分泌骨骼素(Osteocalcin, OCN)、成纖維細胞生長因子23(Fibroblast Growth Factor 23, FGF23)和脂質蛋白2(Lipocalin-2, LCN2)共3種特定激素[5]。除此以外,骨源性分泌因子還包括成纖維細胞生長因子9(Fibroblast Growth Factor-2, FGF-9)、前列腺素E2(Prostaglandin E2, PGE2)、轉化生長因子β(Transforming Growth Factor β, TGF-β)和NF-Κβ受體活化因子配體(Receptor for Activation of Nuclear Factor Kappa β Ligand, RANKL)等。基于整合生物學思路,本研究通過梳理肌肉與骨骼之間的分子機制聯系,探尋和整合相關調節因素,以期為運動改善肌骨系統提供新的思路和研究方向。
1 肌肉和骨骼交互機制
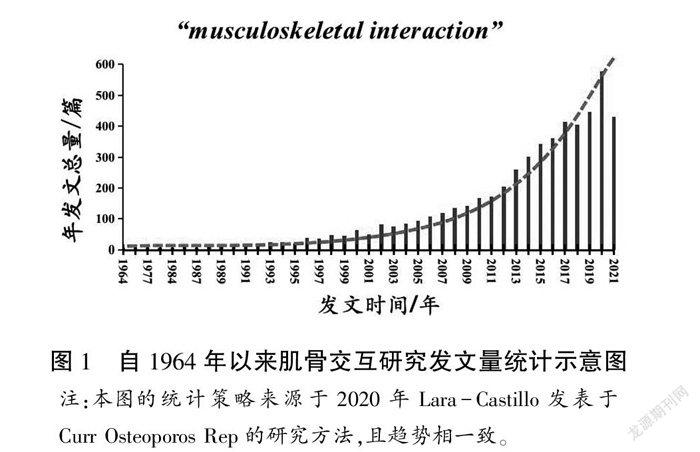
在傳統意義上,肌肉骨骼單元維持肌肉對骨骼負載作用以及骨骼為肌肉提供附著位點的簡單機械功能。除此以外,肌骨系統作為復雜的交互性結構,肌肉和骨骼通過自分泌、旁分泌和內分泌機制發揮交互作用。2012年7月,由美國國立衛生研究院(NIH)和美國骨礦鹽研究協會(ASBMR)主辦的會議交流了關于肌骨交互作用的最新研究結果和假設,試圖促進肌肉和骨骼兩個不同研究領域的交流。在過去的數十年,肌骨交互研究受到廣泛關注,相關主題論文呈指數增長(見圖1)。研究表明,肌肉和骨骼的功能活動通過交互機制相互影響,在發育和衰老過程中發揮重要作用[6]。
在治療骨折模型中,與未覆蓋肌肉瓣的骨折部位相比,覆蓋肌肉瓣的骨折部位表現出更快的愈合度以及更低的感染率。由此引入肌骨交互的相關研究,尤其是在肌少癥(Sarcopenia)和骨質疏松癥(Osteoporosis)的關聯性研究中,越來越多的證據支持肌肉和骨骼之間存在分子耦合和細胞交互機制,為更好地建立精確的因果關系,逐步提出了共發病機制:肌少-骨質疏松癥(Sarco-osteopenia)或肌骨共減綜合癥(Osteosarcopenia)[6]。肌肉與骨骼之間可進行相互調節在于肌肉和骨骼都是高度血管化的組織。肌纖維由1條動脈和2條靜脈供應并由1條神經支配,肌纖維形成束并被肌束膜結締組織包繞。在每個肌周膜內的肌纖維,周圍是一層薄的結締組織,主要由I型和III型膠原組成,稱為肌內膜。而肌內膜中肌纖維浸泡在營養豐富的液體中[3]。骨骼具有內分泌特性,骨骼中的骨單元中心含有神經、動脈和靜脈,骨組織內毛細血管與循環系統中血流相通,形成高度分化的血管形態,骨細胞存在于組織中,通過樹突狀小管相互連接,腔隙小管之間形成骨陷窩-骨小管網絡系統,有助于分子量小于70 kDa的蛋白和分子在骨液流與循環系統中自由擴散,保障骨骼分泌因子可達遠端器官和細胞[7]。肌骨交互中的擴散機制是其基本要素,骨膜是圍繞肌肉和骨骼的細胞層(約60 um),分子量小于40 kDa 的分子可通過半透性骨膜進行擴散,到達鄰近組織,分子量大于40 kDa的肌肉因子或骨骼因子可通過循環或細胞外囊泡進行傳遞[8]。
2 肌肉分泌因子及運動干預機制
肌肉作為內分泌器官釋放肌肉因子,影響破骨細胞的骨吸收和成骨細胞的骨形成,或直接作用于骨細胞受體,維持肌肉與骨骼交互作用。骨骼健康水平取決于肌肉收縮負荷,骨骼強度和形態根據身體活動水平和承受重力進行調節,當肌肉對骨骼刺激減弱時,骨質流失,骨體積密度降低以及脛骨小梁間隔增大。長時間臥床可降低股骨BMD和骨量水平(圖2)。肌肉質量和肌肉橫截面積(Cross-Sectional Area of the Muscle, CSA)與不同身體部位BMD水平呈正相關。同時,肌肉因子作用于遠端器官,對脂肪組織發揮作用,脂肪組織又通過脂肪因子分泌與肌肉進行相互調節[9]。而誘發的骨骼負性調節可通過運動干預肌肉功能和營養支持作用來緩解。
2.1 肌抑素(MSTN)
卵泡抑素可負性調控MSTN,MSTN由肌肉分泌到肌細胞外和循環體系中,屬于TGF-β家族成員,再經翻譯后修飾轉化為成熟MSTN,是肌肉生長自分泌/旁分泌抑制物,可刺激肌肉和骨骼生物功能。MSTN在骨折區域的高表達會影響骨折愈合早期的軟骨內骨化過程。在類風濕性關節炎(Rheumatoid Arthritis, RA)患者滑膜中MSTN高度表達,影響破骨細胞形成和關節治療。因此,MSTN是破骨細胞分化和抗成骨因子的直接調節物,正向調節破骨細胞分化、負向調節軟骨細胞和成骨細胞分化。MSTN可激活SMAD家族成員2(Smad family member 2, SMAD2)和絲裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)信號通路,抑制Wnt/β-catenin通路,協同調節肌肉和骨骼的生長和代謝[10]。
肌肉質量是預測BMD峰值的重要因素,MSTN-/-雄性小鼠作為肌肉質量增加模型,其MSTN缺乏導致肌肉質量增加伴有骨強度提高,MSTN通過SMAD2信號通路調節T細胞核因子c1(Nuclear Factor of Activated T cells c1, NFATc1),誘導骨髓巨噬細胞的成熟破骨細胞形成。抗阻訓練和和耐力訓練可有效誘發MSTN分泌水平下降[11]。在相關研究中,經負重跑步運動,MSTN下調可改善鏈脲佐菌素(Streptozocin, STZ)誘導的I型糖尿病(Type 1 Diabetic Mellitus, T1DM)小鼠股骨萎縮,引起激活素A受體2B型(Activin A Receptor Type 2B, ActRIIB)、SMAD2信號傳導因子表達水平下降,Wnt、GSK3β/β-catenin 信號傳導因子表達水平升高,最終表現出骨骼質量和肌肉質量升高[12]。在骨骼表型中,大鼠注射MSTN抗體(Polyclonal Antibody for MSTN, MsAb)能夠顯著增強皮質骨中BMD水平、提高骨體積/總體積比(Bone Volume over Total Volume, BV/TV)和骨小梁厚度,降低小梁分離比(Trabecular Separation, Tb.Sp),與單獨使用MsAb或單獨采用負重訓練相比,MsAb和負重訓練雙結合方式對骨骼積極影響更大[13]。在對MSTN-/-小鼠進行30 min/天、5天/周共4周跑步運動干預,骨骼極限力、位移、韌性和極限應變能力增加,骨強度增加30[14]。總而言之,運動可有效對抗肌肉MSTN分泌,促進骨骼信號傳導,提高骨骼質量。EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
2.2 鳶尾素
鳶尾素屬于運動誘發的肌肉因子,分布于肌肉和骨骼組織,由過氧化物酶體增殖物激活受體共激活因子1α(Peroxisome Proliferator-sactivated Receptor γ Coactivator-1α, PGC-1α)誘導Ⅲ型纖連蛋白組件包含蛋白5(Fibronectin Type Ⅲ Domain-Containing Protein 5,FNDC5)表達形成。在肌骨系統中,鳶尾素可緩解肌肉生理病理機制,同時刺激新骨生成,對皮質骨BMD和骨力學性可產生積極作用。鳶尾素缺乏會擾亂骨代謝,鳶尾素缺失表現出成骨細胞生成受到抑制,破骨細胞生成增加[15]。運動誘導肌肉PGC-1α表達,PGC-1α增多可促使FNDC5表達增加,重組鳶尾素治療可預防后肢懸浮小鼠骨質流失,維持皮質骨BMD和骨小梁水平,降低骨小梁體積下滑速度[16]。微重力作用中鳶尾素可預防轉錄激活因子4(Activating Transcription Factor 4, ATF4)、Runx2、Osterix和膠原蛋白I(Collagen I)下調水平;在運動員機體檢測中,鳶尾素與運動員骨強度、足球運動員BMD水平呈正相關性[17]。經5 000 m/天共2周自主跑輪運動,小鼠骨小梁、皮質骨、關節軟骨和骨-肌腱交界處中FNDC5/鳶尾素表達升高,抑制RANKL表達,引起成骨細胞生成水平增加[18]。而長期運動會提高雌激素缺乏小鼠(OVX模型)腓腸肌和比目魚肌中鳶尾素表達,改善OVX小鼠股骨小梁和皮質BMD降低水平[19]。
2.3 基質金屬蛋白酶2(MMP2)
MMP2屬于鋅依賴性酶家族,可降解細胞外基質(Extracellular Matrix, ECM)。MMP2作用于破骨細胞和成骨細胞,維持骨細胞功能和存活的骨細胞形態。健康骨骼中MMP2以低水平表達,而在骨折愈傷組織中可廣泛表達。MMP2基因突變導致骨骼疾病,形成骨質流失和關節侵蝕或多中心骨溶解伴關節炎(Multicentric Osteolysis with Arthritis, MOA)綜合征。MMP2缺乏小鼠表現出MOA表型特征,伴隨四肢BMD水平下降、關節軟骨破壞、長骨和顱面骨發育異常等[20]。經8周自主跑輪運動,激活MMP-2信號途徑并改善MMP-2/TIMP-2穩態平衡[21],肌肉中MMP-2分泌水平提高,繼而提高循環水平中MMP-2含量。MMP2循環水平是骨基質重塑標志,體育活動可以增加青春期骨量水平[22]。在運動員檢測中,運動前、運動后20 h和24 h的MMP2活性均顯著高于非運動員[23]。即肌肉中MMP2分泌水平通過運動刺激得以提高,最終刺激骨生成。
2.4 β-氨基異丁酸(BAIBA)
BAIBA是運動過程中肌肉分泌的小分子物質,是通過PGC-1α作用從纈氨酸或胸腺嘧啶產生的小代謝物,屬于天然胸腺嘧啶分解代謝物,分子量為103.6 Da。BAIBA通過激活肝臟脂肪酸β-氧化途徑增加能量消耗,引發白色脂肪褐變和胰島素抵抗,BAIBA還可減輕肌肉炎癥反應以及肝內質網應激。在骨骼代謝中,預防骨細胞免受活性氧(Reactive Oxygen Species, ROS)損傷,BAIBA經Mas相關G蛋白偶聯受體D型(Mas-related G Protein-coupled Receptor type D, MRGPRD)進行信號傳遞,預防骨細胞中線粒體分解。BAIBA可作為抗ROS的骨細胞保護因子,防止后肢卸載時骨質流失[24]。在小鼠后肢卸載模型(一種骨細胞凋亡模型)中,通過飲用水攝取BAIBA可預防ROS誘導的細胞死亡、保護線粒體完整性,最終維持因卸載而導致的肌肉功能喪失和骨質流失現象[25]。除此以外,BAIBA通過激活NAD(P)H/ROS信號傳導刺激骨祖細胞(MC3T3-E1細胞)的增殖和分化,維持骨骼質量和骨內穩態水平[26]。在有氧運動干預中,健康男性以40最大功率騎行車1 h或在55~75VO2中騎行運動20周后,BAIBA循環水平顯著增加[27]。換言之,BAIBA會因運動而增加,由肌肉分泌,并作用于其他組織,如骨骼組織、白色脂肪組織等[28]。
2.5 胰島素樣生長因子1(IGF-1)
IGF-1主要在肝臟中產生,肌肉和骨骼也是主要的分泌組織,IGF-1在肌肉生長、分化和再生中起著核心作用[29]。IGF-1作為全身生長因子,經肌肉骨骼交接界面旁分泌相互作用模型發現,肌肉生長、發育和肥大可導致IGF-1分泌,介導骨膜中IGF-1受體表達,刺激骨形成。IGF-1作為機體生長所需的主要激素之一,也是治療小兒骨骼疾病的關鍵藥物[30]。研究發現,罹患努南綜合癥(Noonan Syndrome, NS)兒童骨量減少,與肌肉量減少和血清IGF-1水平降低密切相關[31]。IGF-1不僅可恢復因后肢懸垂導致的肌肉萎縮,還可以改善骨表型[24]。肌肉中IGF-1表達可以防止廢用性骨質流失,機械和生物刺激具有相互協同作用[32]。IGF-1參與耦合骨重塑的關鍵因素,與骨髓微環境中的多種因素相互作用以調節骨重塑過程,刺激成骨細胞和骨細胞分化,幫助骨形成。
運動對肌肉的影響是通過旁分泌/自分泌IGF-1介導的[33]。力量訓練激活IGF-1,刺激mTOR通路,通過mRNA翻譯和核糖體生物合成導致肌肉蛋白質合成。然而有氧運動的影響因年齡而異,為期12周無氧和有氧聯合運動會改善老年女性的IGF-1水平以及胰島素抵抗能力[34]。在大鼠研究中,飲食限制條件下的跳躍運動會導致年輕雌性大鼠分泌更多的IGF-1含量,逐步形成更高的骨強度、骨礦物質含量、骨橫截面積、BMD水平和皮質骨體積[35]。這表明運動干預能夠有效刺激肌肉因子IGF-1分泌,不僅可有效緩解肌肉萎縮和肌肉質量流失,同時對于維持和刺激骨骼健康和骨生長具有重要作用。EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
2.6 成纖維細胞生長因子2(FGF-2)
FGF-2由成肌細胞、肌纖維細胞和肌衛星細胞分泌,在不同肌纖維中FGF-2的表達水平存在差異性。經12周抗阻運動干預,健康老年人比目魚肌分泌FGF-2水平顯著提高,而脛骨前肌分泌FGF-2水平沒有變化,整體研究下抗阻運動能夠有效調控FGF-2在衰老機體中的表達水平,緩解肌肉萎縮[36]。劇烈運動或外傷性肢體損傷誘發的肌肉損傷會促進FGF-2釋放,從而通過表達FGF-R2的骨膜骨祖細胞誘導骨形成并刺激骨折愈合[32]。FGF-2在成骨細胞中引起的作用與IGF-1相同,均可加速骨形成[37]。同時,FGF-2通過調節長骨和椎骨的骨小梁和皮質骨微結構緩解去卵巢切引起的骨質減少,外源性FGF-2在糖皮質激素中存在可維持成骨細胞生成,并抑制肌肉萎縮[38]。在運動干預刺激下,肌肉分泌FGF-2和FGF-21,不僅可刺激肌肉質量的進一步提高,同時作用于骨骼,引起BMD水平升高[37]。
3 骨骼分泌因子及運動干預機制
骨骼像肌肉組織一樣不斷地自我轉化和調節,受環境刺激或衰老過程的影響而改變自身組織結構,以影響肌肉和其他組織的形成、維持和再生。骨骼由骨皮質和骨小梁組成的結締組織,其中骨皮質約占骨骼總數80,骨小梁約占骨骼總數的20。BMD峰值通常在青春期和成年期之間,并且一直保持到老年,直到觀察到骨量下降為止。在骨骼的自身調節過程中,骨骼因子顯示出誘導肌肉合成代謝和分解代謝能力,影響成肌細胞分化[37,39]。
3.1 骨鈣素(OCN)
OCN屬于骨源性激素,是骨中含量最豐富的非膠原蛋白,由成骨細胞合成和分泌,可在骨吸收過程中被破骨細胞激活,形成GluOCN。其中,OCN在機體內主要以兩種結構形式存在,與羥基磷灰石結合的羧化“GlaOCN”和釋放到血液循環的羧基化“GluOCN”。GlaOCN在機體內不存在生物活性,GluOCN具有生物功能活性,可介導能量代謝和運動調節[5,40]。OCN脫羧后形成GluOCN,GluOCN作用于G蛋白偶聯受體家族6組A(G Protein-Coupled Receptor Family C Group 6 Subtype A, GPRC6A),刺激cAMP/CREB信號通路功能,誘導肌肉代謝表達,使葡萄糖攝取能力提高,線粒體生成水平加快。OCN可影響全身代謝、繁殖和認知水平。循環中受胰島素調節的低羧化OCN在前反饋循環中起作用,增加β細胞增殖以及胰島素產生和分泌,肌肉通過提高胰島素敏感性以應對OCN分泌水平[41]。GluOCN還可通過促進脂肪酸攝取和分解代謝能力、誘導睪丸中睪酮合成、肌纖維中蛋白質合成維持肌肉質量。GluOCN在促進肌纖維中白介素6(Interleukin 6, IL6)釋放過程中,骨吸收水平進一步增強,刺激OCN脫羧水平加快,繼而導致血清GluOCN循環水平提高[42]。對OCN-/-小鼠的研究發現,OCN-/-小鼠肌肉質量下降,肌纖維橫斷面積萎縮[43]。
體內注射GluOCN可以挽救小鼠的運動能力,并抑制小鼠肌肉質量流失[44]。運動引起血清GluOCN增加,經運動刺激,OCN在破骨細胞pH 4.5酸性環境中,脫羧形成GluOCN進入GPRC6A循環體系,增強肌肉組織中葡萄糖攝取、線粒體生成等代謝[5,45]。運動可提高肌肉組織中葡萄糖代謝并增加骨骼形成,C57BL/6小鼠運動后骨量、量小梁數量和BMD水平增加,血清GluOCN、GlaOCN水平升高,而GlaOCN對運動引起的糖代謝改善沒有作用[46]。限制小鼠卡路里攝入量,并進行運動干預,可顯著增加小鼠血清GluOCN分泌水平,繼而提高GPRC6A表達,提高肌肉質量和肌肉功能[5]。
3.2 成纖維細胞生長因子(FGF9和FGF23)
FGF9屬于FGF超家族成員,FGF9表達定位于軟骨膜/骨膜、骨小梁和發育中骨骼周圍的間充質,在骨骼發育和修復中具有復雜而重要的作用[47]。在骨細胞研究中,FGF9在成骨細胞中中度表達,在類骨細胞中高強度表達,在2周齡和4周齡小鼠股骨分離的骨細胞中中度表達[6]。研究指出,FGF9屬于骨骼到肌肉信號傳導的介質,在研究FGF9對肌生成作用中,FGF9對C2C12細胞分化抑制是由MSTN上調介導,用10 ng/mL和50 ng/mL的FGF9處理C2C12成肌細胞后,發現FGF9處理的肌管顯示出較低Ca2+峰值和較短的松弛期,以響應咖啡因誘導Ca2+釋放,抑制肌管中的鈣穩態;觀察到FGF9對肌源性分化的抑制、肌細胞生成素(Myogenin, MyoG)和肌球蛋白重鏈(Myosin Heavy Chain, Mhc)的表達降低以及MSTN表達增加[48]。在骨骼因子表達中,運動能夠有效刺激骨骼分泌,通過骨骼肌肉界面進行傳遞。運動刺激可有效改善FGF9表達水平,提高機體骨骼分泌和肌肉質量,FGF9在認知水平中樣存在顯著的調節作用[49]。
成骨細胞和骨細胞分泌的FGF23可調節磷酸鹽和維生素D水平,FGF23通過其受體Klotho的協調作用,與成纖維細胞生長因子1(Fibroblast Growth Factor Receptor 1, FGFR1)結合,調節血清磷和1,25二羥維生素D3活性,提高腎臟對磷的排泄,維持血清磷正常水平[50]。除FGF23外,骨細胞通過X染色體上的中性內肽酶(Phosphate Regulating Neutral Endopeptidase on Chromosome X, Phex)和牙本質基質蛋白-1(Dentin Matrix Protein-1, DMP1)調節磷酸鹽。Phex和DMP1均可下調骨細胞中FGF23表達水平,允許腎臟重新吸收磷酸鹽以維持循環磷酸鹽,保持正常的骨礦物質含量(Bone Mineral Content, BMC)。在缺乏Phex和DMP1的情況,骨細胞中FGF23升高,腎臟排泄磷酸鹽,導致骨軟化和佝僂病。人體FGF23升高會對心肌產生負面影響,心臟病風險增加、左心室肥厚、血管鈣化從而導致血管功能受損和脂肪量增加[24]。研究發現,運動可有效提高骨骼FGF23合成及血液循環中FGF23水平,在急性、力竭性及長期性運動中,血清FGF23均有所提高,尤其是以下坡跑運動最為突出[50]。EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
3.3 前列腺素E2(PGE2)
PGE2是由肌細胞分化的有效刺激物。 骨細胞分泌PGE2比肌細胞分泌水平高100倍之多。PGE2應流體流動剪切應力作用而升高,通過間隙連接蛋白43(Connexin 43,Cx43)半通道從骨細胞中釋放,可增強肌生成和離體初級肌肉功能。連接蛋白43半通道已被證明在響應加載的骨細胞釋放 PGE2中發揮重要作用[24]。成骨細胞或骨細胞中連接蛋白43靶向敲除可誘發皮質骨厚度下降,同時導致快肌中的長伸肌(Extensor Digitorum Longus, EDL)肌肉表型缺陷[51]。PGE2作用于損傷的肌肉,可促進肌肉的重塑和修復,誘發肌肉特異性干細胞(Muscle Specific Stem Cells, MuSCs)增殖,是肌纖維受損后修復的關鍵步驟[52]。運動可有效可上調OVX老年大鼠脛骨上段的松質骨丟失所需PGE2水平[53]。在動態運動期間,PGE2水平會顯著高于休息期狀態,而在機體恢復至平靜期過程中,PGE2水平也會顯著提高,最終對肌肉形成良性循環作用[54]。
3.4 轉化生長因子β(TGF-β)
TGF-β的最大來源是骨骼,由成骨細胞產生,可促進成骨細胞增殖與分化,抑制破骨細胞活性,提高骨形成作用,加快成骨細胞成熟過程[55],儲存在礦化骨基質中。與其他引起肌肉肥大反應的骨骼因子的分泌水平不同,病理狀態中骨骼分泌過量的TGF-β,抑制肌肉功能。TGF-β存在三種類型:TGF-β1、TGF-β2和TGF-β3,TGF-β與MSTN是被研究最多的肌肉超家族成員,TGF-β和MSTN通過復雜的配體、受體相互作用啟動信號轉導,導致MAPK級聯激活和SMAD蛋白的核積累,TGF-β具有重塑肌肉細胞外基質(Muscle Extracellular Matrix, ECM)以響應抗阻訓練的功能,肌肉中TGF-β在慢性阻力訓練的適應中起重要作用[56]。在肌肉力量方面的研究中,TGF-β及其家族成員MSTN導致肌肉萎縮或功能降低,經破骨細胞介導的骨吸收過程,TGF-β從骨基質中釋放到循環,影響肌肉。TGF-β雖沒有改變肌肉質量,但在肌肉力量表現中存在顯著下降,導致肌無力現象發生[57]。動物實驗研究中,34只雌性大鼠隨機分為對照控制、久坐控制、無負重跑15 min/天、負重40 g跑15min/天,5天/周,持續6周。干預后發現,骨骼中TGF-β分泌水平受跑步運動調節,跑步運動肱骨中TGF-β濃度顯著低于久坐控制[58]。研究亦指出,對衰老大鼠進行6周的跑臺運動訓練,TGFβ1和MSTN水平降低,抑制TGF-β經典及非經典通路,緩解肌肉流失[59]。TGF-β信號增強是誘發少肌肉衰減因素之一,TGF-β可抑制衛星細胞激活、肌肉質量及肌肉功能,運動訓練可通過抑制TGFβ經典和非經典信號,緩解肌肉流失,甚至抑制肌少癥的發生發展。
3.5 NF-Κβ受體活化因子配體(RANKL)
RANKL由骨細胞或成骨細胞分泌,以激活破骨細胞功能。RANKL又稱為腫瘤壞死因子配體超家族成員11(Tumor Necrosis Factor Ligand Superfamily Member 11, TNFSF11)。核因子ΚB受體激活因子(Receptor for Activation of Nuclear Factor Kappa β, RANK)屬于RANKL受體,在破骨細胞和肌肉中共同表達,RANKL與RANK結合促進骨吸收。肌肉RANKL調節Ca2+儲存以及內質網Ca2+-ATP酶活性。而RANK表達在營養不良的虛弱中發揮作用[51]。RANKL抑制可恢復骨量,并提高肌肉力量和胰島素敏感性[60]。抗RANKL可增強營養不良小鼠的骨骼水平,并減少肌肉炎癥和功能障礙[61]。為期1年的輕度有氧運動可以改善絕經女性的骨轉換。抗阻運動會提高BMD水平,提高護骨素(Osteoprotegerin, OPG)水平和OPG/RANKL比率[62],由此形成的RANKL水平降低,從而提高肌肉功能和肌肉質量。
4 小結與展望
從胚胎生成、生長、發育、成熟到衰老,肌肉和骨骼終生相互作用。肌肉和骨骼之間的機械和生物化學作用相互協同。機械應力為肌肉和骨骼的調節和釋放特定因子提供刺激,從而對相應組織發揮作用。本研究基于肌骨系統學說,從肌骨交互機制兩種進程,結合運動干預手段,指出運動可通過刺激肌肉分泌功能,改善MSTN、鳶尾素、MMP2、BAIBA、IGF-1和FGF-2等肌肉因子分泌水平,進而調節骨骼的生理功能特性,提高骨骼質量。同時運動可通過刺激骨骼分泌功能,改善OCN、FGF9、FGF23、PGE2、TGF-β和RANKL等骨骼因子分泌水平,進而調節肌肉的生理功能特性,提高肌肉質量(見圖3)。
在肌骨系統的整合機制研究中,依然存在值得深思和亟待解決的問題:(1)在生長、發育、衰老各個階段,應對肌骨系統進行思考,是否需要取代肌肉和骨骼的單獨研究而集中在肌肉骨骼的整體研究,尤其是在機械應力和分泌信號協同作用過程中的共調節機制。(2)肌肉和骨骼如何聯動可達到最佳機能效果,運動刺激肌肉骨骼的力學敏感性細胞內信號傳導通路是什么,是否依賴于機體的負重能力而發生改變,是否亦涉及到協同、增強或減弱負重對于肌骨系統的影響。(3)不同的運動手段可分別有效地改善和提高肌肉和骨骼組織,但是在對預防和治療肌肉骨骼的損傷和丟失,如何確定一種運動模式來維持肌肉和骨骼含量,需要進一步明確,尤其是面臨機體衰老過程。總而言之,基于運動干預手段深入探討肌骨系統中的肌骨交互作用,為深入了解肌肉和骨骼的生理功能提供了新視角和新方向。更值得關注的是,運動與肌骨交互的討論為挖掘運動與肌少癥、骨質疏松癥的關聯性提供了新的研究思路和理論依據。
參考文獻:
[1]趙常紅,李世昌,孫朋,等.運動對骨骼和肌肉的共調作用研究[J].首都體育學院學報,2017,29(6):565-570.EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
[2]MAGAR M S, BERTACCHINI J, FLORIO F, et al. Identification of Sclerostin as a Putative New Myokine Involved in the Muscle-to-Bone Crosstalk[J]. Biomedicines,2021,9(1):71.
[3]BONEWALD L F, KIEL D P, CLEMENS T L, et al. Forum on bone and skeletal muscle interactions: Summary of the proceedings of an ASBMR workshop[J]. J Bone Mineral Res,2013,28(9):1857-1865.
[4]宗博藝,李世昌,孫朋,等.肌骨系統在運動調控脂肪代謝中的作用機制研究進展[J].體育科學,2019,39(5):61-69.
[5]徐帥,陳祥和,李世昌.下丘腦介導能量代謝與骨骼反調節及其運動干預機制研究進展[J].中國體育科技,2021,57(2):74-81.
[6]LARA-CASTILLO N, JOHNSON M L. Bone-Muscle Mutual Interactions[J]. Curr Osteoporos Rep,2020,18(2):408-421.
[7]DALLAS S L, PRIDEAUX M, BONEWALD L F. The osteocyte: an endocrine cell … and more[J]. Endocr Rev,2013,34(5):658-690.
[8]LAI X, PRICE C, LU X, et al. Imaging and quantifying solute transport across periosteum: Implications for muscle-bone crosstalk[J]. Bone,2014,66(6):82-89.
[9]BOSCO F, MUSOLINO V, GLIOZZI M, et al. The muscle to bone axis (and viceversa): An encrypted language affecting tissues and organs and yet to be codified?[J]. Pharmacol Res,2021,165(3):105427.
[10]CUI Y, YI Q, SUN W, et al. Molecular basis and therapeutic potential of myostatin on bone formation and metabolism in orthopedic disease[J]. Biofactors,2020,doi:10.1002/biof.1675.
[11]ZOHREH S, MOHAMMAD F, EBRAHIM B, et al. Effect of moderate and high-intensity endurance and resistance training on serum concentrations of MSTN and IGF-1 in old male Wistar rats.[J]. Horm Mol Biol Clin Investig,2019,38(2):1-7.
[12]YANG J, SUN L, FAN X, et al. Effect of exercise on bone in poorly controlled type 1 diabetes mediated by the ActRIIB/Smad signaling pathway[J]. Exp Ther Med,2018,16(4):3686-3693.
[13]TANG L, GAO X, YANG X, et al. Combination of Weight-Bearing Training and Anti-MSTN Polyclonal Antibody Improve Bone Quality in Rats[J]. Int J Sport Nutr Exerc Metab,2016,26(6):516-524.
[14]HAMRICK M W, SAMADDAR T, PENNINGTON C, et al. Increased Muscle Mass With Myostatin Deficiency Improves Gains in Bone Strength With Exercise[J]. JBMR,2006,21(3):477-483.
[15]ZHU X, LI X, WANG X, et al. Irisin deficiency disturbs bone metabolism[J]. Cell Physiol,2020,236(1):664-676.
[16]COLAIANNI G, GRANO M. Role of Irisin on the bone-muscle functional unit[J]. Bonekey Rep,2015,4(12):765.
[17]BUCCOLIERO C, ORANGER A, COLAIANNI G, et al. The effect of Irisin on bone cells in vivo and in vitro[J]. Biochem Soc Trans,2021,49(1):477-484.EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
[18]JIN Z, XU Z, TU Q, et al. Exercise-induced irisin in bone and systemic irisin administration reveal new regulatory mechanisms of bone metabolism[J]. Bone Res,2017,5(1):49-62.
[19]KAWAO N, IEMURA S, KAWAGUCHI M, et al. Role of irisin in effects of chronic exercise on muscle and bone in ovariectomized mice[J].J Bone Miner Metab,2021,39(4):547-557.
[20]SHIRLEY L, ERIK H, RUSSELL D, et al. Impaired remodeling phase of fracture repair in the absence of matrix metalloproteinase-2.[J]. Dis Model Mech,2011,4(2):203-211.
[21]任磊,苗杰,秦永生,等.自主跑輪運動調控MMP-2/TIMP-2穩態平衡改善去卵巢大鼠心臟重塑[J].天津體育學院學報,2019,34(4):330-336.
[22]TOURNAIRE N, JAFFR C, JACOB M P, et al. MMP2 and MMP9 plasma levels as markers of bone remodeling: a study on young male tennis players[J]. Sci Sports,2007,22(2):123-125.
[23]RAMIN A, ABBAS M, ALI G A, et al. Effects of Exhaustive Aerobic Exercise on Matrix Metaloproteases Activity in Athletes and Non-Athletes[J]. World J Sport Sci,2011,4(2):185-191.
[24]BONETTO A, BONEWALD L F. Bone and Muscle[J]. Basic App Bone Bio,2019,16(6):317-332.
[25]KITASE Y, VALLEJO J A, GUTHEIL W, et al. beta-Aminoisobutyric acid, l-BAIBA, is a muscle-derived osteocyte survival factor[J]. Cell Rep,2018,22(6):1531-1544.
[26]ZHU X W, DING K, DAI X Y, et al. β-aminoisobutyric acid accelerates the proliferation and differentiation of MC3T3-E1 cells via moderate activation of ROS signaling[J].J Chin Med Assoc,2018,81(7):611-618.
[27]GONZALEZ-GIL A M, ELIZONDO-MONTEMAYOR L. The Role of Exercise in the Interplay between Myokines, Hepatokines, Osteokines, Adipokines, and Modulation of Inflammation for Energy Substrate Redistribution and Fat Mass Loss: A Review[J]. Nutrients,2020,12(6):1899.
[28]KAMEI Y, HATAZAWA Y, RAN U, et al. Regulation of Skeletal Muscle Function by Amino Acids[J]. Nutrients,2020,12(1):261.
[29]ASCENZI F, BARBERI L, DOBROWOLNY G, et al. Effects of IGF-1 isoforms on muscle growth and sarcopenia[J]. Aging Cell,2019,18(3):e12954.
[30]RACINE H L, SERRAT M A. The Actions of IGF-1 in the Growth Plate and Its Role in Postnatal Bone Elongation[J]. Curr Osteoporos Rep,2020,18(3):210-227.
[31]MARINE D, VANESSA R, CATIE C, et al. Low bone mass in Noonan syndrome children correlates with decreased muscle mass and low IGF-1 levels[J]. Bone,2021,4(9):116170.
[32]HAMRICK M W, MCNEIL P L, PATTERSON S L.Role of muscle-derived growth factors in bone formation[J]. J Musculoskelet Neuronal Interact,2010,10(1):64-70.EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
[33]FRYSTYK J. Exercise and the growth hormone-insulin-like growth factor axis[J]. Med Sci Sports Exerc,2010,42(1):58-66.
[34]ANGULO J, ASSAR M E, BUSTOS A L, et al.Physical activity and exercise: Strategies to manage frailty[J]. Redox Biology,2020,35(8):101513.
[35]AIKAWA Y, WAKASUGI Y, NARUKAWA T, et al. Jump Exercise and Food Restriction on Bone Parameters in Young Female Rats[J]. Calcif Tissue Int,2019,105(5):557-566.
[36]金晶,謝嬌嬌,姜丹陽,等.運動和細胞信號分子的交互作用及骨骼肌肥大調控機制[J].中國體育科技,2021,57(2):66-73.
[37]KIRK B, FEEHAN J, LOMBARDI G, et al. Muscle, Bone, and Fat Crosstalk: the Biological Role of Myokines, Osteokines, and Adipokines[J]. Curr Osteoporos Rep,2020,18(4):388-400.
[38]ADHIKARY S, CHOUDHARY D, TRIPATHI A K, et al. FGF-2 targets sclerostin in bone and myostatin in skeletal muscle to mitigate the deleterious effects of glucocorticoid on musculoskeletal degradation[J]. Life Sci,2019,229(7):261-276.
[39]HERRMANN M, ENGELKE K, EBERT R, et al. Interactions between Muscle and Bone-Where Physics Meets Biology[J]. Biomolecules,2020,10(3):432.
[40]徐帥,李世昌,方幸,等.運動對T2DM中骨鈣素介導的能量代謝調控機制[J].中國體育科技,2018,54(1):129-135.
[41]ZOCH M L, CLEMENS T L, RIDDLE R C. New insights into the biology of osteocalcin[J]. Bone,2016,82(2):42-49.
[42]KOMORI T. What is the function of osteocalcin?[J]. J Oral Biosci,2020,62(3):223-227.
[43]TOSHIHISA K. Functions of Osteocalcin in Bone, Pancreas, Testis, and Muscle[J]. Int J Mol Sci,2020, 21(20):7513.
[44]MOSER S C, VAN D E B. Osteocalcin-A Versatile Bone-Derived Hormone[J]. Front Endocrinol,2019,9(2):794.
[45]RAHIMI G M, NIYAZI A, ALAEE S. The effect of exercise training on osteocalcin, adipocytokines, and insulin resistance: a systematic review and meta-analysis of randomized controlled trials[J]. Osteop Int,2021,32(2):213-224.
[46]TAKESHI M, RYOSUKE O, TAKUYA I, et al. Osteocalcin is necessary for the alignment of apatite crystallites, but not glucose metabolism, testosterone synthesis, or muscle mass[J]. PLoS Genet,2020,16(5):e1008586.
[47]WANG L, ROTH T, ABBOTT M, et al. Osteoblast-derived FGF9 regulates skeletal homeostasis[J]. Bone,2017,98(5):18-25.
[48]HUANG J, WANG K, MCCORMICK L, et al. Fibroblast Growth Factor 9 (FGF9) is Expressed in An Osteocyte-like "Mini-bone" Cell Line and Inhibits C2C12 Myogenesis via Overexpression of Myostatin[J]. FASEB,2018,32(S1):491.
[49]XIA J, XUE X, LIU W, et al. The Role of Fgf9 in the Antidepressant Effects of Exercise and Fluoxetine in Chronic Unpredictable Mild Stress Mice[J]. Psychosom Med,2021,83(7):795-804.EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8
[50]徐帥,李世昌,陳祥和.運動對雄性小鼠骨內分泌FGF23-Klotho/FGFR1軸及相關因子表達的影響[J].中國運動醫學雜志,2019,38(10):882-889.
[51]LYNDA B. Use it or lose it to age: A review of bone and muscle communication[J].Bone,2018,120(3):212-218.
[52]ZHANG Y, DESAI A, YANG S Y, et al. Inhibition of the prostaglandin-degrading enzyme 15-PGDH potentiates tissue regeneration[J]. Science,2015,348(6240):a2340.
[53]MO A, YAO W, LI C, et al. Bipedal stance exercise and prostaglandin E2 (PGE2) and its synergistic effect in increasing bone mass and in lowering the PGE2 dose required to prevent ovariectomized-induced cancellous bone loss in aged rats[J]. Bone,2002,31(3):406.
[54]BURIAN A, FRANGIONE V, ROVATI S, et al. An exploratory microdialysis study investigating the effect of repeated application of a diclofenac epolamine medicated plaster on prostaglandin concentrations in skeletal muscle after standardized physical exercise[J]. Br J Clin Pharmacol Actions,2014,76(6):880-887.
[55]周燕,李世昌.生長期運動干預對去卵巢小鼠晚年骨密度、骨組織TGF-β1/Smad3信號通路的影響[J].北京體育大學學報,2014,37(9):73-78.
[56]GUMUCIO J P, SUGG K B, MENDIAS C L. TGF-β Superfamily Signaling in Muscle and Tendon Adaptation to Resistance Exercise[J]. Exerc Sport Sci Rev,2015,43(2): 93-99.
[57]JENNA N R, TRUPTI T, THERESA A G, et al. The Role of TGFβ in Bone-Muscle Crosstalk[J]. Curr Osteoporos Rep,2017,15(1):18-23.
[58]BRAVENBOER N, ENGELBREGT M J, VISSER N A, et al. The effect of exercise on systemic and bone concentrations of growth factors in rats[J]. J Orthop Res,2001,19(5):945-949.
[59]王今越,王小虹,馮維斗.運動訓練抑制了TGFβ通路并緩解了D-半乳糖誘導衰老大鼠的肌肉流失[J].體育科學,2014,34(10):72-77.
[60]BONNET N, BOURGOIN L, BIVER E, et al. RANKL inhibition improves muscle strength and insulin sensitivity and restores bone mass[J]. J Clin Invest,2019,129(8):3214-3223.
[61]DOUNIA H, LAETITIA M, ANTOINE P B, et al. An anti-RANKL treatment reduces muscle inflammation and dysfunction and strengthens bone in dystrophic mice[J]. Hum Mol Genet,2019,28(18):3101-3112.
[62]LOMBARDI G. Exercise-Dependent Modulation of Bone Metabolism and Bone Endocrine Function: New Findings and Therapeutic Perspectives[J]. J Sci Sport Exer,2019,1(1):20-28.
收稿日期:2021-12-24
基金項目:江蘇省教育科學“十三五”規劃重點課題(編號:T-a/2020/04),江蘇省衛生健康委員會項目(編號:H2019093)。
作者簡介:徐 帥(1990- ),男,江蘇徐州人,碩士,實驗師,研究方向運動與骨內分泌系統。
通訊作者:徐道明(1982- ),男,江蘇南京人,博士,副主任醫師,研究方向康復醫學與骨健康。
作者單位:1.淮陰師范學院體育學院,江蘇 淮安 223300;2.南京中醫藥大學附屬醫院,江蘇 南京 210029;3.江蘇師范大學體育學院,江蘇 徐州 221116EF1E75D4-20DC-4ED4-A497-2DE08B31D4E8

