血漿前蛋白轉化酶枯草溶菌素9水平與急性腦梗死分型及頸動脈粥樣硬化斑塊性質的相關性研究
徐義君, 陶春花, 王興儀, 張 松, 劉振生, 王英歌
(1. 揚州大學附屬醫院 神經內科, 江蘇 揚州, 225000; 2. 揚州大學醫學院, 江蘇 揚州, 225000; 3. 揚州大學護理學院, 江蘇 揚州, 225000)
腦卒中是導致中國成年人群致死和致殘的重要原因,其中腦梗死占腦血管疾病的70%~80%[1]。動脈粥樣硬化導致的斑塊形成及破裂、血栓形成、血管狹窄是引發腦梗死的重要病因。2003年首次發現的前蛋白轉化酶枯草溶菌素9(PCSK9)在脂質代謝、炎癥、細胞凋亡、血小板反應性等方面起著重要的作用[2-3], 尤其是其抑制劑可通過介導低密度脂蛋白受體(LDLR)升高而使低密度脂蛋白膽固醇(LDL-C)降低,參與動脈粥樣硬化性心腦血管疾病的發展過程。本研究以TOAST分型為基礎,探討急性腦梗死患者血漿PCSK9水平與TOAST亞型及頸動脈粥樣斑塊性質的關系,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年12月—2021年6月揚州大學附屬醫院神經內科收治的158例急性腦梗死患者為急性腦梗死組,另選取同期78例健康體檢者為對照組。根據TOAST分型標準,將急性腦梗死患者分為大動脈粥樣硬化(LAA)型亞組(n=62)、心源性栓塞(CE)型亞組(n=25)、小動脈閉塞(SAO)型亞組(n= 44)、不明原因(SUE)型亞組(n=22)、其他病因明確(SDE)型亞組(n=5)。根據頸動脈粥樣斑塊情況及斑塊穩定性分為不穩定斑塊亞組(n=86)、穩定斑塊亞組(n=56)、無斑塊亞組(n=16)。所有患者符合急性腦梗死診斷標準[4], 均為首次發病且未接受任何治療。排除腦梗死伴出血傾向、血液系統或凝血功能異常患者; 排除合并嚴重心臟疾病患者,如心肌梗死、心力衰竭等; 排除合并嚴重肝腎功能不全、感染、腫瘤等患者。本研究經醫院倫理委員會審批通過,患者或家屬簽署知情同意書。
1.2 方法
記錄所有研究對象的臨床資料,包括年齡、性別、吸煙史、飲酒史、體質量指數、高血壓、糖尿病及常規生化指標等。所有研究對象入院后抽取靜脈血3 mL, 不抗凝, 25 ℃下3 000轉/min離心10 min, 分離血漿并置于-80 ℃冰箱備用。采用酶聯免疫吸附法測定血漿PCSK9的水平, PCSK9試劑盒購自南京生物科技有限公司,操作嚴格按說明書執行。
采用頸動脈彩色多普勒超聲儀檢查頸總動脈分叉處、頸內動脈顱外段及雙側頸總動脈,患者取仰臥位,充分暴露頸部,采用頻率為9~13 MHz的探頭掃描粥樣硬化斑塊形態[5]。根據血管超聲檢查指南[6]中頸動脈粥樣硬化程度標準進行分類: 頸動脈斑塊呈強回聲,表面光滑為穩定斑塊; 表面不光滑,存在低回聲和不規則低回聲暗區,或斑塊內出血、斑塊潰瘍為不穩定斑塊; 不穩定斑塊和穩定斑塊同時存在視為不穩定斑塊。
1.3 統計學方法
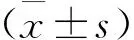
2 結 果
2.1 急性腦梗死組與對照組臨床資料比較
急性腦梗死組與對照組在高血壓、吸煙、飲酒、男性比率、糖化血紅蛋白(HbA1c)、低密度脂蛋白膽固醇(LDL-C)、載脂蛋白B(ApoB)、白細胞(WBC)計數、超敏C反應蛋白(hs-CRP)、PCSK9方面比較,差異有統計學意義(P<0.05)。見表1。
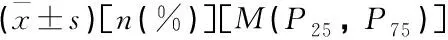
表1 2組臨床資料比較
2.2 不同TOAST分型的急性腦梗死患者PCSK9、美國國立衛生院卒中量表(NIHSS)比較
不同TOAST分型中, LAA型PCSK9水平高于CE、SAO、SUE、SDE型,差異均有統計學意義(P<0.01); LAA型NIHSS評分與其他各組比較,差異有統計學意義(P<0.05),其中CE型與SAO型比較,差異也有統計學意義(P<0.05)。見表2。將CE、SAO、SUE、SDE型合并為非LAA型(n=96),結果顯示LAA型PCSK9水平、NIHSS評分均高于非LAA型,差異有統計學意義(P<0.01)。見表3。

表2 不同TOAST分型患者PCSK9、NIHSS比較

表3 LAA型與非LAA型患者PCSK9、NIHSS比較
2.3 影響LAA型急性腦梗死發生的危險因素分析
以是否發生LAA型急性腦梗死為因變量進行多元Logistic回歸分析,在控制混雜因素后,結果顯示PCSK9、不穩定斑塊、HbA1c是LAA型急性腦梗死發生的危險因素(P<0.05或P<0.01)。見表4。

表4 LAA型急性腦梗死發生的危險因素的Logistic回歸分析
2.4 急性腦梗死患者血漿PCSK9與病情嚴重程度的相關性分析
Pearson相關性分析顯示,急性腦梗死患者血漿PCSK9水平與病情嚴重程度(NIHSS評分)呈正相關(rs=0.468,P<0.001)。單因素方差分析顯示,神經功能缺損重度患者PCSK9水平高于中度、輕度患者,中度患者PCSK9水平高于輕度患者,差異有統計學意義(P<0.05)。見表5。
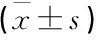
表5 不同病情嚴重程度患者血漿PCSK9水平比較
2.5 各斑塊組PCSK9、NIHSS比較及不穩定斑塊的危險因素分析
不穩定斑塊組PCSK9水平高于穩定斑塊組和無斑塊組,穩定斑塊組PCSK9水平高于無斑塊組,差異均有統計學意義(P<0.05); 不穩定斑塊組NIHSS評分高于穩定斑塊組和無斑塊組,差異有統計學意義(P<0.05)。見表6。以是否為不穩定斑塊為因變量進行Logistic回歸分析,在控制混雜因素后,結果顯示PCSK9、HbA1c是頸動脈斑塊不穩定性的危險因素(P<0.05)。見表7。

表6 各斑塊組PCSK9水平、NIHSS評分比較

表7 ACI頸動脈不穩定斑塊的危險因素Logistic回歸
2.6 血漿PCSK9對LAA型急性腦梗死的預測分析
以是否發生LAA型急性腦梗死為金標準,繪制ROC曲線,結果顯示PCSK9預測LAA型急性腦梗死的曲線下面積為0.800(95%CI: 0.703~0.896,P<0.001)。當PCSK9取438.21 ng/mL時,約登指數達最大值0.702, 相應的敏感度為0.781, 特異度為0.702, 即PCSK9>438.21 ng/mL時,認為該患者可能有較大風險發生LAA型急性腦梗死。見圖1。

圖1 PCSK9預測LAA型急性腦梗死的ROC曲線
3 討 論
PCSK9主要通過影響脂質代謝、炎癥反應、細胞凋亡、增加血小板反應性等促進動脈粥樣硬化易損斑塊的形成,進而影響到腦梗死的發生和發展。PCSK9可以與肝細胞表面的低密度脂蛋白受體(LDLR)的表皮生長因子A結構域結合,導致后者在溶酶體降解,循環LDL-C清除率降低,從而影響動脈粥樣硬化的進展[7]。在預測心腦血管疾病風險的過程中, ApoB是有效的風險標記。PCSK9通過LDLR依賴性和非依賴性機制促進腸道過度產生富含甘油三酯的ApoB脂蛋白,脂蛋白殘余顆粒驅動動脈巨噬細胞中膽固醇的積累,導致冠狀動脈疾病的進展[8]。本研究重點分析急性腦梗死患者血漿PCSK9水平與TOAST分型及頸動脈斑塊的關系,發現血漿PCSK9水平在急性腦梗死患者中表達量顯著增高; 在不同的TOAST分型中, PCSK9表達存在差異,以LAA型患者表達量最高; LAA型患者病情嚴重程度高, NIHSS評分顯著高于其他分型患者。
PCSK9可能通過促進核因子κB(NF-κB)活化、載脂蛋白E受體2(ApoER2)信號轉導、Bcl-2/Bax-caspase9/3級聯活化參與炎癥反應和凋亡通路[2, 9-10]。PCSK9siRNA可以通過抑制NF-κB的啟動而減輕炎癥。PCSK9抑制劑預處理可以抑制小膠質細胞的活化,從而抑制炎癥反應。缺血損傷后出現反應性星形膠質細胞增生,膠質纖維酸性蛋白表達增加,促炎因子分泌增多。研究[11]表明, PCSK9抑制劑預處理能夠抑制心肌缺血再灌注所致腦損傷中星形膠質細胞的增生和肥大,抑制星形膠質細胞的破壞作用。本研究急性腦缺血患者WBC計數與hs-CRP明顯升高,表明腦缺血后存在嚴重的炎癥反應,PCSK9可通過增加炎癥應答促進疾病發生發展。逆向轉運膽固醇可以從多種途徑阻止動脈粥樣硬化的發生: 首先,PCSK9可以增加巨噬細胞吸收氧化的LDL-C形成泡沫細胞; 其次,PCSK9可能會影響巨噬細胞膽固醇的流出,阻斷肝臟膽固醇的攝取,抑制腸道膽固醇的吸收,從而促進動脈粥樣硬化[12-13]。
動脈循環中血栓形成是動脈血栓性疾病的主要病因。血小板活化、積聚以及隨后產生的閉塞性血栓是動脈血栓性疾病的關鍵。研究[14]發現, PCSK9水平與急性冠狀動脈綜合征患者血小板活化相關。研究[15]證明,在心房顫動患者中, PCSK9可通過放大NADPH氧化酶2型(Nox2)活性直接誘導CD36受體介導血小板活化,這種效應在LDL存在時被放大。研究[16]表明PCSK9與血小板活化主要因為PCSK9和尿液中人11去氫血栓烷B2(11-DH-TXB2)之間存在直接相關性。PCSK9抑制劑或阿司匹林消除了PCSK9對血小板活化和體內血栓形成的增強作用。上述結果表明PCSK9參與了心血管疾病,且與脂質代謝無關。盡管他汀類藥物治療可較好地控制LDL-C水平,但PCSK9抑制劑可能是降低心血管并發癥發生率的首選,特別是在血漿PCSK9水平高的患者中。PCSK9的缺乏還與預防靜脈血栓形成有關,這種保護作用與血栓形成部位白細胞募集有關[17]。
NIHSS評分>15分可定義為嚴重中風事件,該評分考慮了前循環和后循環,是目前使用最廣泛的中風評分標準[18-19]。本研究結果顯示,急性腦梗死患者血漿PCSK9水平與疾病的嚴重程度呈顯著正相關, PCSK9表達水平與頸動脈粥樣斑塊不穩定性呈正相關。研究[20]顯示,急性心肌梗死患者PCSK9水平升高,多變量邏輯回歸分析表明血漿PCSK9水平是冠心病的獨立預測因子。一項血管內超聲研究[21]表明,在急性冠狀動脈綜合征患者中,血漿PCSK9水平與斑塊壞死核心的數量呈線性相關,且獨立于血漿LDL-C水平和所有亞組患者(包括他汀類藥物使用者、非他汀類藥物使用者以及低和高水平的LDL-C患者),這表明了PCSK9在斑塊炎癥中具有直接作用。
綜上所述,血漿PCSK9水平有望成為預測急性腦梗死患者病情嚴重程度及頸動脈粥樣斑塊穩定性的重要血漿標志物。

