基于網絡藥理學探討薏苡仁-蒼術“異病同治”類風濕關節炎和痛風性關節炎作用機制
莫美玲,羅嗣雄,劉永芳,楊靈梅,黃秉慧,甘麗賢,陳延強
1.廣西中醫藥大學,廣西 南寧 530004;2.廣西中醫藥大學第一附屬醫院,廣西 南寧 530022
類風濕關節炎(rheumatoid arthritis,RA)是慢性全身性自身免疫性疾病,通常表現為局部關節疼痛、僵硬、腫脹等,其病理改變主要是慢性滑膜炎、滑膜增生、骨侵蝕等。痛風性關節炎(gouty arthritis,GA)是一種因長期高尿酸血癥導致的單鈉尿酸鹽晶體沉積在關節腔等所致的全身性炎癥性疾病,臨床主要表現為局部紅、腫、熱、痛等,主要病理改變有滑膜炎等。
RA及GA均屬中醫學“痹證”范疇,且病因病機多有相似。《素問·痹論篇》“痹病,五臟虧虛為之大因”,《濟生方·痹》“非獨責之于風寒濕,體虛相合,痹證乃生”,強調了臟腑在痹證發病中的重要作用。《素問·至真要大論篇》言:“諸濕腫滿,皆屬于脾。”《脾胃論》曰:“脾病,體重即痛,為痛痹,為寒痹,為諸濕痹。”馬武開教授提出RA的發病基礎是脾虛濕阻經脈,認為脾虛生內濕,加之外濕困脾,內外相合,日久入絡,致四肢關節疼痛,纏綿難愈。李濟仁教授認為,GA屬內外因雜合而致,“濁濕內蘊、經絡痹阻”是其病機關鍵。由此可見,二者病變部位均與脾臟關系密切,病機均有脾虛濕阻經絡,可能為中醫“異病同治”的基礎。
薏苡仁和蒼術均為臨床常用健脾除濕藥。薏苡仁甘、淡,微寒,有健脾補中、利水消腫、滲濕除痹等功效,亦能舒筋脈,緩和拘攣,常用于濕痹而筋脈攣急的疼痛;蒼術辛、苦,溫,有燥濕健脾、祛風濕等功效,常用于濕阻中焦、風寒濕痹、腳膝腫痛等。如《簡明醫彀》蒼術薏苡湯即以二者為君,具有祛風散寒、除濕通絡功效。薏苡仁-蒼術藥對共奏燥濕健脾之功,治痹證濕勝者尤宜。郭會卿教授治療濕痹時擅聯合使用大劑量生、炒薏苡仁以健脾祛濕,常加蒼術等增強健脾祛濕之功,效果顯著。周芳伊分析健脾祛濕法治療GA相關用藥,其中薏苡仁、蒼術使用頻率分別居第1、2位。王欣妍等基于數據挖掘分析近10年RA活動期用藥規律,頻次排名前5位中藥包括薏苡仁、蒼術。薏苡仁及蒼術對脾虛濕阻型RA、GA均有良好療效,體現了“異病同治”理念。本研究通過網絡藥理學對薏苡仁-蒼術藥對“異病同治”RA及GA的相關機制進行研究,為其臨床研究提供依據。
1 資料與方法
1.1 薏苡仁-蒼術活性成分及靶點篩選
分別以“薏苡仁”“蒼術”為關鍵詞檢索TCMSP數據庫(https://old.tcmsp-e.com/tcmsp.php),以口服生物利用度(OB)≥30%且類藥性(DL)≥0.18為條件篩選藥物活性成分。通過TCMSP數據庫對活性成分進行靶點預測,利用UniProt數據庫(https://www.uniprot.org/)對靶點名稱進行規范并轉化為基因名稱。
1.2 疾病靶點收集
分別以“rheumatoid arthritis”及“gouty arthritis”“gout”為關鍵詞,通過GeneCards(https://www.genecards.org)、OMIM(http://www.omim.org)數據庫收集RA和GA的疾病靶點。
1.3 藥物-活性成分-靶點網絡構建與分析
通過Venny2.1軟件分析RA、GA疾病靶點與薏苡仁-蒼術藥物靶點的交集靶點,利用Cytoscape3.7.1軟件構建藥物-活性成分-靶點網絡,運用該軟件Network Analyzer工具進行拓撲分析,根據節點度值(degree)判斷薏苡仁-蒼術治療RA及GA的核心成分。
1.4 蛋白相互作用網絡構建與分析
將藥物與疾病交集靶點上傳至STRING11.0(https://string-db.org/),設定物種為“Homo sapiens”,最小相互作用閾值為“medium confidence”(≥0.400),其余參數為默認值,構建蛋白相互作用(PPI)網絡。以TSV格式導入Cytoscape3.7.1軟件進行拓撲分析,根據靶點在PPI網絡中的度值找出核心基因,度值越大代表其在PPI網絡中越重要。
1.5 GO功能和KEGG通路富集分析
運用R4.0.5軟件先將基因簡稱(Symbol)轉化為基因ID(EntrezID),然后運用R 軟件的colorspace、stringi、ggplot2 包及Bioconductor 平臺 的DOSE、clusterProfiler、enrichplot、pathview程序包進行GO功能富集分析與KEGG 通路富集分析,并繪制信號通路圖。
1.6 中藥成分-靶點-通路網絡構建
將薏苡仁-蒼術藥對活性成分、KEGG富集分析前20條通路及對應的蛋白靶點,借助Cytoscape3.7.1軟件構建中藥成分-靶點-通路網絡圖。
2 結果
2.1 薏苡仁-蒼術的活性成分及靶點篩選
通過TCMSP檢索并篩選后共獲得薏苡仁和蒼術各9種活性成分,刪除無對應靶點的活性成分,最終獲得10種活性成分,分別為薏苡仁6種、蒼術4種,見表1。薏苡仁、蒼術活性成分對應靶點分別為42、65個,合并后刪除重復靶點,共得到薏苡仁-蒼術靶點70個。
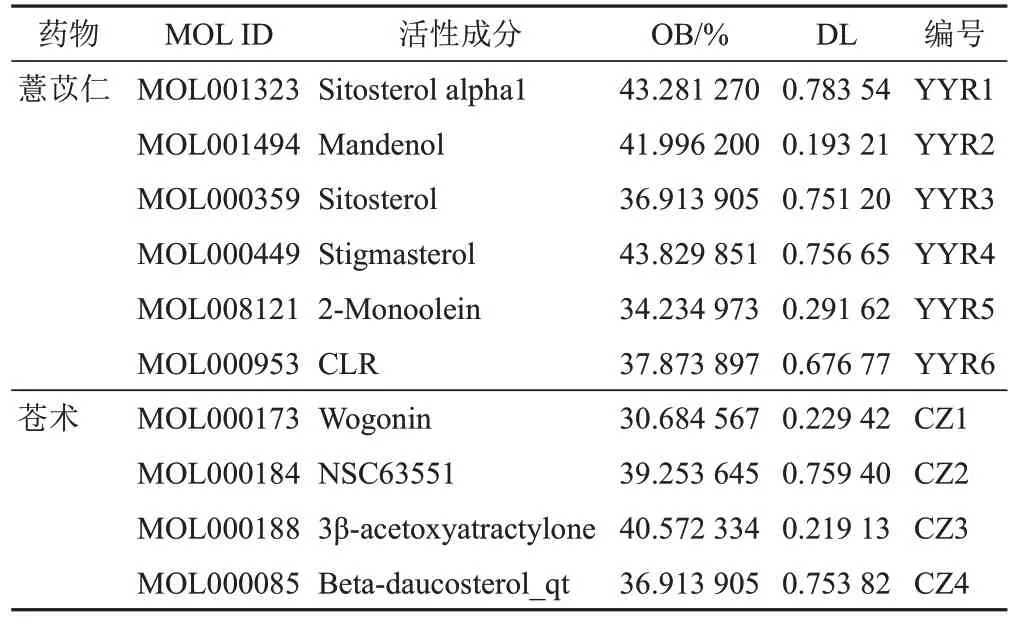
表1 薏苡仁-蒼術活性成分
2.2 疾病靶點
通過GeneCards數據庫分別得到RA、GA相關靶點4 734、1 565個,通過OMIM數據庫分別得到RA、GA相關靶點42、10個,合并后去重,分別獲得RA、GA靶點4 763、1 572個。
2.3 藥物-活性成分-靶點網絡
將藥物靶點與疾病靶點取交集,得到24個共同靶點。利用Cytoscape3.7.1軟件構建藥物-活性成分-靶點網絡,見圖1。該網絡包含82個節點和117條邊,節點度值越大,表明其在網絡中越重要。根據網絡拓撲分析結果,度值前3位的活性成分分別為Wogonin(漢黃芩素)、Stigmasterol(豆甾醇)、3β-acetoxyatractylone(3β-乙酰氧基蒼術酮),其度值分別為44、29、21,這些成分可能是薏苡仁-蒼術治療RA及GA的核心成分。

圖1 薏苡仁-蒼術治療RA及GA藥物-活性成分-靶點網絡
2.4 蛋白相互作用網絡
將24個交集靶點通過STRING數據庫構建PPI網絡,見圖2。該網絡共有24個節點和136條邊。對PPI網絡中的靶點進行拓撲分析,篩選出度值大于中位數的基因(見圖3),分別為AKT1、IL6、TNF、CXCL8、PTGS2、TP53、MAPK14、JUN、KDR、NOS2、PPARG、HSP90AA1,可能是薏苡仁-蒼術“異病同治”RA及GA的核心基因。

圖2 薏苡仁-蒼術治療RA及GA靶點PPI網絡

圖3 薏苡仁-蒼術治療RA及GA核心基因
2.5 GO功能和KEGG通路富集分析結果
24個交集基因GO功能富集分析結果顯示:生物過程(BP)有1 238條,主要與急性炎癥反應、炎癥反應的調節、活性氧代謝過程、細胞對生物刺激的反應及對脂多糖的反應等相關,見圖4A;細胞組分(CC)有9條,主要包括膜筏、質膜微區、膜區域、轉錄調控復合物、外膜等,見圖4B;分子功能(MF)有38條,涉及蛋白磷酸酶結合、DNA結合轉錄因子結合、絲氨酸水解酶活性、激活轉錄因子結合、受體配體活性等,見圖4C。KEGG通路富集分析得到123條通路,主要有Toll 樣受體信號通路(Toll-like receptor signaling pathway)、IL-17信號通路(IL-17 signaling pathway)、TNF信號通路(TNF signaling pathway)及NF-κB信號通路(NF-kappa B signaling pathway)等,見圖4D。選取圖中與RA及GA相關性較大的Toll樣受體信號通路繪制通路圖,見圖5。

圖4 薏苡仁-蒼術治療RA及GA靶點富集分析

圖5 薏苡仁-蒼術治療RA及GA的Toll樣受體信號通路
2.6 中藥成分-靶點-通路網絡
將薏苡仁-蒼術藥對活性成分、KEGG富集分析前20條通路及對應的蛋白靶點導入Cytoscape3.7.1,繪制中藥成分-靶點-通路網絡圖,見圖6。該網絡反映出薏苡仁-蒼術藥對治療RA及GA通過多成分、多靶點、多通路調控而發揮“異病同治”作用。

圖6 薏苡仁-蒼術治療RA及GA的中藥成分-靶點-通路網絡
3 討論
“異病同治”是指不同疾病在發展過程中出現相同病機時可采用相同的治法。RA及GA西醫病因雖不同,但二者均有炎癥反應,臨床癥狀表現為關節腫脹、關節腔積液等,均為濕邪作祟,病機以脾虛為本。薏苡仁-蒼術藥對有燥濕健脾之功。現代藥理研究發現,薏苡仁具有抗炎鎮痛、增強免疫、調節水液代謝、抗氧化、抗腫瘤等作用,蒼術具有抗炎鎮靜、調節免疫、利尿、抗氧化、抗腫瘤、抗肥胖等作用。
本研究運用網絡藥理學方法,共篩選出薏苡仁-蒼術10種有效活性成分,70個作用靶點,24個藥物與RA及GA交集靶點。薏苡仁-蒼術的關鍵活性成分為漢黃芩素、豆甾醇、3β-乙酰氧基蒼術酮等。研究表明,漢黃芩素有抗炎、抗氧化、抗腫瘤及神經保護等作用。Huynh等發現,漢黃芩素對環氧化酶-2和前列腺素E2(PGE2)的抑制作用是急性炎癥的主要分子機制,漢黃芩素還可能通過抑制Th1細胞因子和增加Th2細胞因子,從而減少炎癥。Huang等研究表明,漢黃芩素通過抑制p38/MAPK和NF-κB/p65的磷酸化調節MAPK/NF-κB信號通路活性,并誘導抗氧化應激表達。豆甾醇具有抗炎、抗氧化、抗腫瘤等作用。Gabay等研究顯示,豆甾醇可抑制多種炎癥介質及基質降解,且至少部分通過抑制NF-κB 通路來阻礙與軟骨降解有關的MMPs的表達,同時對促炎介質PGE2產生抑制作用。蒼術酮具有抗炎、抗病毒等作用,Kim等發現蒼術酮可減弱caspase-1/NF-κB/MAPKs通路的激活,減少炎癥因子產生。
PPI網絡分析提示,薏苡仁-蒼術干預RA和GA的過程主要涉及AKT1、IL6、TNF、CXCL8、PTGS2、TP53、MAPK14、JUN、KDR、NOS2、PPARG、HSP90AA1等靶基因。IL6能促進T、B淋巴細胞活化及調節炎癥相關的急性期反應,被認為是炎癥、免疫反應的介質。Ahsan等通過關節炎大鼠模型實驗表明,使用藥物抑制TNF-α、IL-1β、IL-6和PGE2等促炎因子表達,可有效改善類風濕關節炎,使大鼠爪腫脹顯著下降,降低ESR及CRP等指標,減緩骨侵蝕等。Dai等研究尿酸鈉結晶誘導的急性GA大鼠模型發現,Tregs/Th17細胞失衡可能參與了急性GA發病,而IL-6是決定Treg/Th17平衡的關鍵因素,提示抑制IL-1β、IL-6、TNF-α等基因是治療急性GA發作的新策略。研究表明,GATA1通過誘導NOS2轉錄參與了RA的發展和惡化,導致破壞軟骨等。HSP90AA1可間接阻滯NF-κB信號通路激活,減少炎性細胞因子產生,HSP90AA1靶向藥物可用于治療RA,可減少滑膜炎癥和防止軟骨破壞。研究表明,AKT1可參與炎癥、免疫代謝和細胞增殖分化相關信號通路,在膠原誘導性關節炎小鼠中,circRNA_09505可以充當miR-6089海綿并通過miR-6089/AKT1/NF-κB軸調節炎癥,顯著緩解小鼠關節炎和體內炎癥。MAPK家族參與炎癥反應、凋亡、增殖和分化等多種細胞功能,其參與RA 發生發展已得到廣泛確認。研究亦顯示,MAPKs信號通路介導了GA發生與發展。p53蛋白由TP5基因編碼,p53上調可能促進疾病進展中的軟骨細胞凋亡,p53抑癌基因和其他關鍵調控基因突變的發展可能有助于將炎癥轉化為RA和其他炎癥性疾病的慢性疾病,在RA患者的滑膜中觀察到p53顯著過度表達。趨化因子是趨化性促炎細胞因子,可將白細胞募集到炎癥部位,在腫瘤生長、血管生成、組織硬化和自身免疫中也具有重要作用。CXCL8是CXC趨化因子家族的成員,相關實驗研究表明CXCL8是RA疾病的重要危險因子。另外,無論痛風患者的疾病活動度如何,其滑液和血清中CXCL8水平均升高。
為深入了解薏苡仁-蒼術對RA和GA“異病同治”作用機制,使用R 語言對交集靶點進行GO 功能及KEGG通路富集分析。GO功能富集分析提示薏苡仁-蒼術“異病同治”RA和GA的生物過程主要涉及急性炎癥反應、炎癥反應的調節、活性氧代謝過程及對脂多糖的反應等,分子功能涉及蛋白磷酸酶結合、激活轉錄因子結合、受體配體活性等。KEGG通路富集分析結果表明,主要涉及AGE-RAGE信號通路、IL-17信號通路、Toll 樣受體信號通路及TNF 信號通路等。AGE-RAGE信號通路可激活炎癥反應和氧化應激等,如激活NF-κB,進而產生炎癥因子。IL-17在各種炎癥反應和自身免疫性疾病的發病機制中起著關鍵作用,IL-17 信號通路參與了RA 患者MMP13 的調控,從而參與了RA進程中軟骨細胞的降解。Toll樣受體在RA及GA等風濕性疾病的慢性炎癥中起重要作用,Toll樣受體信號通路大多依賴MyD88途徑,從而激活NF-κB,誘導促炎因子、趨化因子等。Gong等通過膠原誘導性關節炎模型大鼠實驗發現追風透骨膠囊通過TLR2/4-NF-κB信號通路調節CRP水平、ESR和RFs進而改善大鼠RA癥狀。段姮妃等以尿酸鈉注入大鼠右后踝關節誘導GA模型并予灌胃,發現清熱通絡方可下調TLRs信號通路相關蛋白TLR2、NF-κB表達水平,從而阻斷TLRs信號通路的激活,最終抑制炎癥因子釋放。
綜上所述,薏苡仁-蒼術治療RA和GA的靶點及通路極為相似,通過炎癥反應、免疫調節及抗氧化等多維網絡調控,發揮“異病同治”作用。本研究可為薏苡仁-蒼術臨床治療以脾虛濕阻為病機的RA、GA及中醫“異病同治”提供依據。但網絡藥理學預測為理論研究,數據庫收錄局限可能影響其結果,且忽略了中藥組分在煎煮時可能發生的化學變化,有待今后深入分析及實驗驗證。

