基于GEO數據庫篩選肺炎鏈球菌感染的關鍵基因和信號通路研究
李 靜,王 書,張 穎
(安徽醫科大學第三附屬醫院(合肥市第一人民醫院) 老年醫學科,安徽 合肥 230000)
0 引言
肺炎鏈球菌是一種人類共生細菌和主要的機會性呼吸道病原體,它不僅會導致嚴重的侵襲性疾病,甚至每年在全世界造成數百萬人死亡[1]。鼻咽分泌物的吸入可使肺炎鏈球菌在肺實質中侵襲和傳播,從而導致肺部感染[2]。肺炎球菌肺炎的高發病率和高死亡率給個人和社會帶來了沉重的醫療負擔[3]。因此,探究機體對肺炎鏈球菌感染的反應機制對防治肺炎鏈球菌感染至關重要。近年來,運用生物信息學方法在分子水平上進行數據挖掘,為研究各種疾病的分子機制提供了新的思路。本研究通過對肺炎鏈球菌感染小鼠的肺關鍵基因的分析及鑒定,以期了解機體抵制肺炎鏈球菌感染背后的分子機制。
1 資料與方法
1.1 數據下載和處理
GSE83612數據集來自GEO數據庫(https://www.ncbi.nlm.nih.gov/geo),共納入4例肺炎鏈球菌(SP)感染小鼠和4例磷酸鹽緩沖鹽水 (PBS)對照的小鼠基因表達信息,其檢測平臺為GPL6887。對從 GEO 數據庫下載的探針表達矩陣文件進行歸一化和log2轉換,將平臺注釋文件與每個探針表達矩陣進行匹配,并保留注釋良好的探針。對于對應一個基因的多個探針,取平均表達值用于進一步分析。
1.2 DEG 的鑒定
基于對照(HC)樣本和SP樣本表達值的比較,通過RStudio軟件(版本:1.3.1056)的limma包[4]篩選出差異表達基因(DEGs)。DEG 的篩選標準如下:log2 倍數變化 (FC) 應大于 2 或小于-2,調整后P<0.05。
1.3 功能富集分析
應用colorspace,stringi,colorspace包對差異表達基因進行 GO (Gene Ontology)分析和 KEGG (Kyoto Encyclopedia of Genes and Genomes)通路分析,P<0.05且Q<0.05為篩選條件。
1.4 PPI網絡構建與模塊分析
為了探索不同基因編碼蛋白質之間的相互關系,將DEGs導入STRING網站(https://www.string-db.org/)進行進一步分析。最低交互分數應大于 0.9,并刪除網絡中的孤立節點。接下來,將分析結果輸出一個TSV格式的文件中,并使用Cytoscape軟件(版本:3.8.2)進行細節處理和模塊分析。MCODE是從 Cytoscape App Store下載的插件,可以根據拓撲結構在復雜網絡中找到緊密相連的節點。因此,應用此插件,以degree cutoff=2,node score cutoff=0.2,k-core=2和max.depth=100為標準[5],來檢測PPI網絡中的關鍵模塊,并應用Cytohubba插件,按degree算法計算出評分位于前10位的樞紐基因。
2 結果
2.1 DEG 的鑒定
通過使用limma包分析整合數據集的差異表達,獲得了325個DEG由281個上調基因和44個下調基因組成(表1列出部分),以及按調整后的P值排序的前 20 個基因的表達(見表2)。
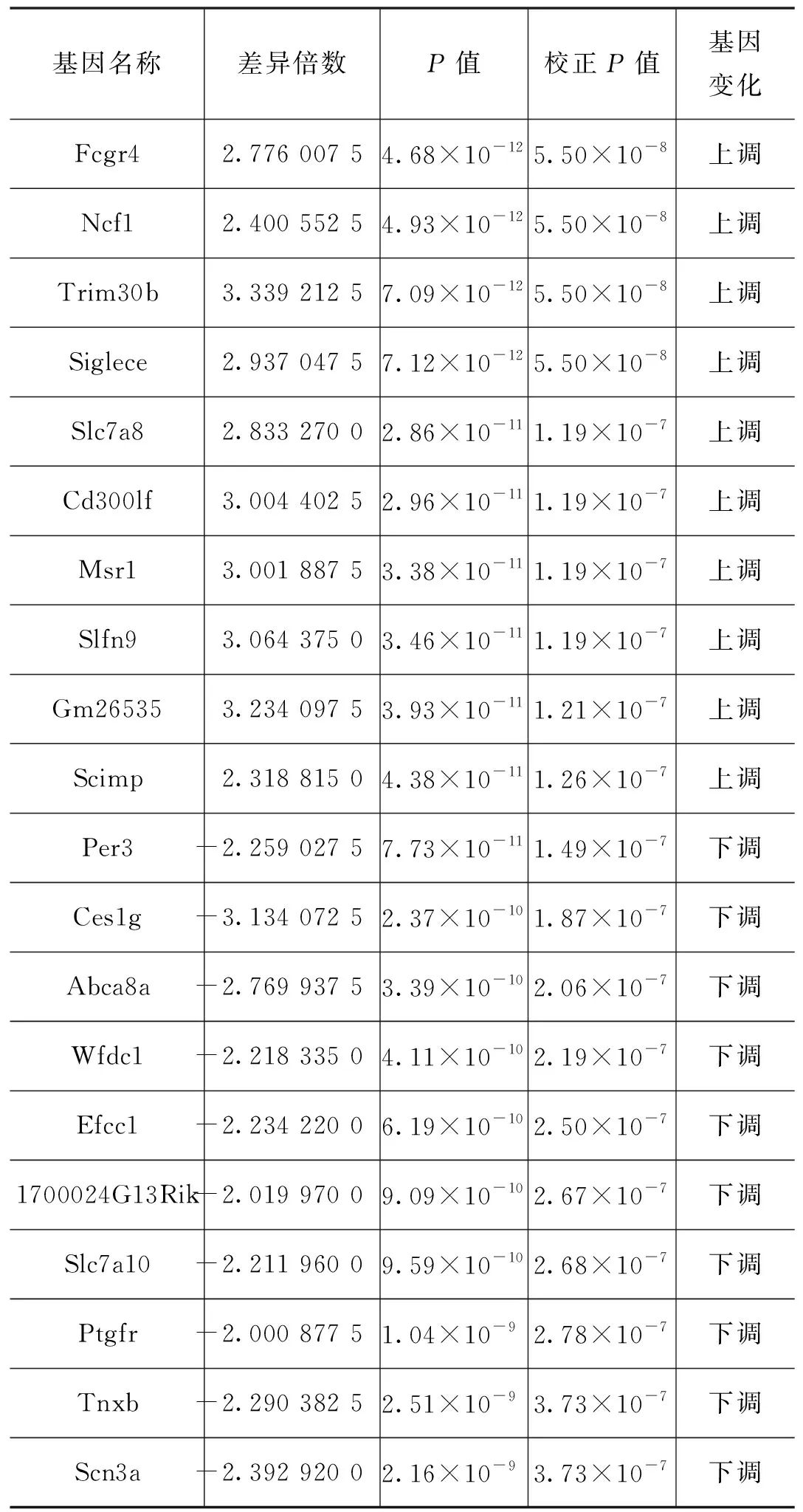
表1 部分差異表達基因
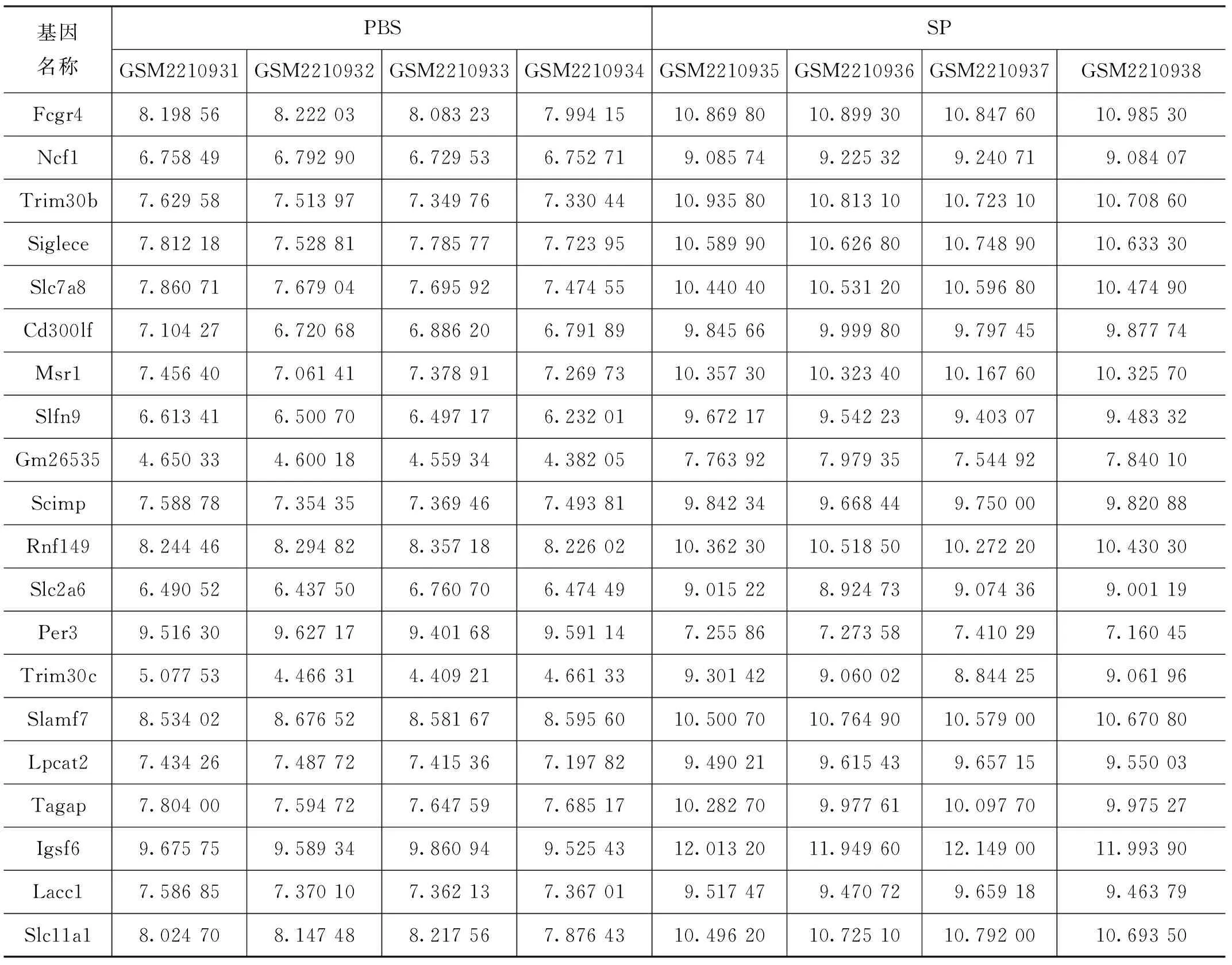
表2 按調整后的P值排序的前20個基因的表達
2.2 GO 和 KEGG 富集分析
Cluster Profiler包進行的富集分析揭示了與DEG相關的生物學功能和途徑。如表3所示,DEG的GO注釋由3部分(BP,CC,MF)組成(每部分列出前10項)。發現主要細胞成分(CC)位于血漿脂蛋白粒子、液泡、溶酶體等;主要分子功能(MF)與細胞因子活性、趨化因子活性、G蛋白偶聯受體等相關;主要涉及白細胞及各種粒細胞遷移、γ-干擾素反應等生物過程。KEGG分析的前10條路徑(見表4)表明DEGs參與信號轉導和炎癥反應相關通路,如腫瘤壞死因子信號通路、Toll樣受體信號通路、細胞因子-細胞因子受體相互作用和IL-17信號通路等。
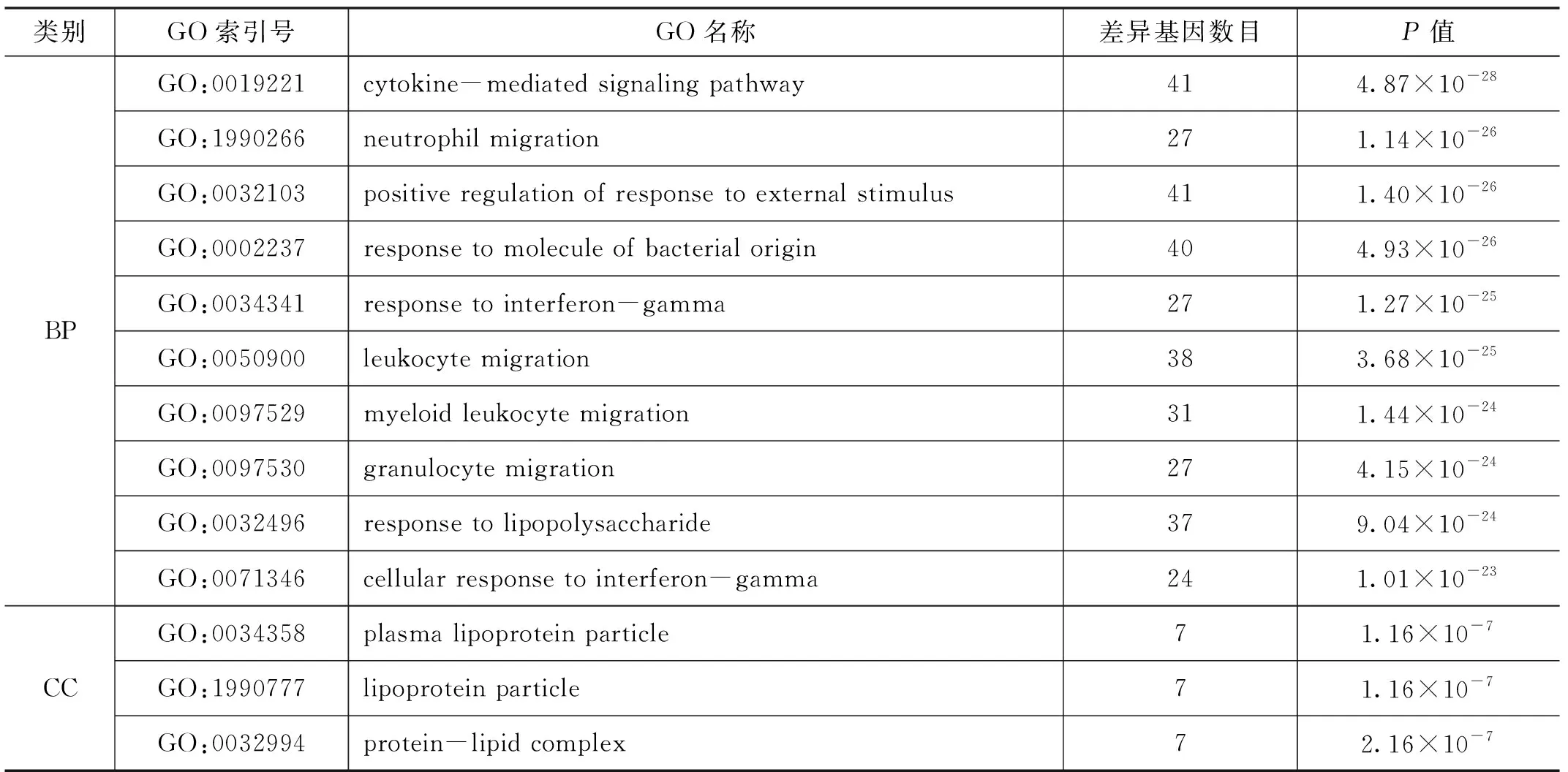
表3 差異表達基因的GO富集分析結果(列出了每個類別的前10項)
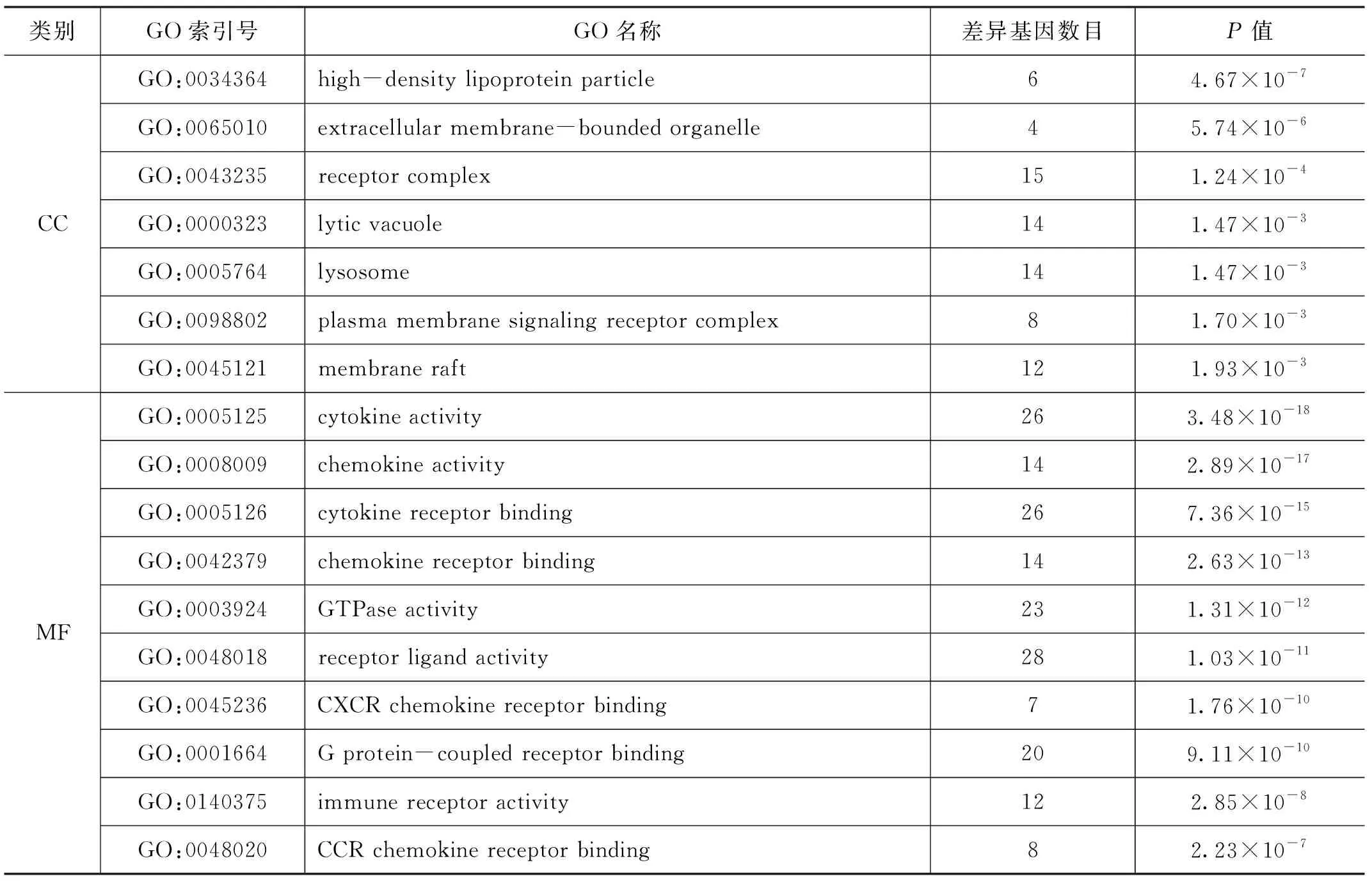
表3(續)

表4 差異表達基因的KEGG富集分析結果(列出前10項)
2.3 PPI2.3網絡搭建與MCODE插件分析
STRING數據庫構建的PPI網絡經Cytoscape調整可視化。為了找出復雜網絡的核心模塊,進行了MCODE插件分析,確定了得分最高的2個重要模塊(其一:Ccl4,Il1b,Il1a,Csf2,Ccl7,Tnf,Cxcl13,Cxcr3,Cxcl1,Il6,Cxcl10。其二:Ifi44,Oas2,Rsad2,Isg15,MX1,Oasl1,Oasl2,Rtp4,Usp18),得分均為5分,顯示主要與趨化因子及干擾素反應相關。運用cytoHubba插件,利用MCC法篩選出排名前10的樞紐基因依次為Irf7,Ifit1,Rsad2,Usp18,Oas12,Mx1,Ifi44,Cxcl10,Il1b,Isg15。
3 討論
肺炎球菌感染可導致人類高死亡率和發病率[6]。作為鼻咽共生菌群的一部分,肺炎球菌如何從共生狀態轉變為致病狀態所涉及的宿主反應目前尚不清楚。確定宿主感染肺炎鏈球菌后機體的反應機制,有利于開發宿主導向的療法和篩選測試,進行個體化的治療。本研究旨在通過生物信息學分析來識別肺炎球菌感染的生物標志物并揭示其生物學功能,為制定相關的防治靶點提供思路。
在分析中,篩選出281個上調和44個下調的 DEG,肺炎鏈球菌感染和對照樣本之間的變化至少為 4 倍。按調整后的P值排序的前 50 個基因的表達顯示Igsf6,Ccd33,Il1b等基因在肺炎鏈球菌感染的肺轉錄組中顯著高表達,表明這些基因可能參與肺炎球菌感染的發生發展。接下來,通過功能富集分析對DEGs進行注釋,觀察可知這些基因與細胞反應和炎癥信號密切相關,例如各種炎性細胞遷移、趨化因子信號通路、腫瘤壞死因子信號通路和IL-17 信號通路。使用STRING網站和Cytoscape軟件建立DEG的PPI網絡。在MCODE插件的幫助下,篩選出最重要的子網絡,主要集中在調控干擾素及趨化因子的基因上,類似地,最后應用cytoHubba篩選出的前10位樞紐基因,也主要與這兩種基因有關。
在樞紐基因及顯著模塊中,干擾素相關基因的表達顯著上調。據報道,I型干擾素(IFN-I)通過調節緊密連接蛋白的表達可降低上皮細胞通透性和抑制細菌遷移[7],防止肺炎鏈球菌局部肺部感染發展為侵襲性疾病[8]。研究表明,缺乏 IFN-I 受體的小鼠在肺部感染肺炎鏈球菌后顯示出菌血癥風險的增加[7]。類似的,II型干擾素(IFN-γ)在肺炎球菌肺炎期間可以控制傳染源和調節免疫系統[9],增強高親和力細胞表面分子FcγRI(CD64)和主要組織相容性復合體(MHC)的表達從而參與炎癥反應[10]。然而,IFN信號過度活化或沒有及時消除也會引起免疫系統紊亂,有可能會引發慢性炎癥,因此需要表達免疫負調控因子準確、適時地調整胞內信號通路的激活,從而保證機體免疫平衡。本研究中Irf7,Ifit1,Rsad2,Usp18,Oas12,Mx1,Ifi44,Isg15作為樞紐基因,協同調控干擾素在肺炎鏈球菌感染期間的作用。最顯著模塊中的基因還包括趨化因子及促炎細胞因子,如Cxcl10,Ccl4,Cxcl1,Ccl2等趨化因子顯著上調,趨化因子可與白細胞上的細胞表面受體結合,并將它們吸引到宿主感染部位[1],通過及時和協調地招募免疫細胞,在對抗微生物感染和啟動組織修復方面發揮著至關重要的作用[11]。發揮重要作用的促炎細胞因子包括IL-6和Tnf等,IL-6可通過促進肺修復、上皮細胞存活和減少成纖維細胞積累,在氣道細菌和病毒感染期間作為維持屏障完整性的關鍵免疫介質[12];腫瘤壞死因子(TNF)是免疫的中樞調節劑[13]。在實驗模型中,阻斷TNF-α和IL-6等細胞因子的表達或作用會削弱肺炎球菌肺炎期間的宿主防御能力,并導致細菌清除受損和存活率降低[14]。
綜上,筆者整合了多種生物信息學工具,確定了10個中樞基因可能作為肺炎鏈球菌感染的潛在治療靶點,在未來可通過嘗試使用化學誘導物(如趨化因子)將免疫細胞募集到肺部或直接調節免疫細胞功能(調節相應細胞因子活性或信號通路的開放)等手段治療肺炎鏈球菌肺炎。

