血清sICAM-1、VEGF在缺血性腦卒中致血管性癡呆患者中的表達及臨床意義*
孫娜,馬先軍,肖輝,杜青,王惠,寧倩
(南京中醫藥大學連云港附屬醫院腦病科,江蘇連云港 222001)
血管性癡呆(vascular dementia, VD)是腦血管疾病所致的嚴重認知功能障礙綜合征,缺血性腦卒中是其主要致病因素之一,缺血性腦卒中后VD 的發生率為18.2%~34.2%[1]。神經細胞發生缺血、缺氧性損傷的過程中,部分生物標志物的變化通常先于臨床癥狀變化。因此,探尋敏感性、特異性、準確性較高的生物標志物對VD 的預防具有重要意義。可溶性細胞間黏附分子-1(soluble intercellular adhesion molecule-1, sICAM-1)、血管內皮生長因子(vascular endothelial growth factor, VEGF)是與神經損傷密切相關的因子。缺血性腦卒中患者治療后sICAM-1、VEGF 水平較治療前明顯降低[2-3]。另有研究[4-5]表明,血清sICAM-1、VEGF 水平與癡呆性疾病密切相關,但關于兩者在VD 中表達意義的報道較少。本研究回顧性分析缺血性腦卒中患者的臨床資料,探討血清sICAM-1、VEGF 在缺血性腦卒中致VD 患者中的表達及對VD 發生的預測價值。現報道如下。
1 資料與方法
1.1 研究對象
回顧性分析2020年1月—2021年6月南京中醫藥大學連云港附屬醫院112 例缺血性腦卒中患者的臨床資料。所有缺血性腦卒中患者均在3 個月后復診,發生VD 的31 例為VD 組,其余81 例為非VD組。另選取本院同期體檢的健康人員55 例為健康組,健康組體檢指標正常,認知功能正常,簡易精神狀態檢查(MMSE)量表分數為27~30 分。納入標準:①符合《中國急性缺血性腦卒中診治指南2014》[6]的診斷標準,VD 診斷符合美國國立衛生院與瑞士日內瓦國際神經科學研究協會制定的NINDS-AIREN 標準[7],經顱腦MRI 檢查證實;②發病至就診< 7 d;③臨床資料完整。排除標準:①出血性腦卒中、腦血管畸形、腦創傷、硬膜下水腫或積液、顱內腫瘤或顱內手術患者;②多器官功能異常、呼吸衰竭、凝血功能異常;③膿毒癥、重癥肺炎等嚴重感染性疾病;④長期使用化療藥物、激素和/或免疫抑制劑;⑤皮質下缺血性血管性癡呆、混合型癡呆及多發梗死性癡呆等其他類型癡呆;⑥精神疾病患者。本研究經醫院醫學倫理委員會批準,受試者均自愿簽署知情同意書。
1.2 方法
1.2.1 血清sICAM-1、VEGF 水平檢測健康組體檢時、缺血性腦卒中患者入院后次日清晨采集肘部靜脈血5 mL,3 500 r/min 離心20 min,取上清液4℃冷藏保存。采用雙抗體夾心法檢測sICAM-1 水平,酶聯免疫吸附試驗檢測VEGF 水平,均經全自動生化分析儀測定,試劑盒購自上海澤葉生物科技有限公司。
1.2.2 觀察指標收集缺血性腦卒中患者的臨床資料,包括年齡,性別構成,體質量指數(BMI),飲酒,吸煙,VD 家族史,高鹽飲食(每日攝入食鹽量>6 g),高脂血癥,糖尿病,冠心病,高血壓,美國國立衛生研究院腦卒中量表(NIHSS)評分,多發性腦梗死,腦梗死病史,腦白質疏松,腦梗死部位(額葉、顳葉、頂葉、枕葉、基底節、丘腦),梗死范圍[腔梗(梗死最大徑線< 3.0 cm)、中面積(3.0 cm≤梗死最大徑線≤5.0 cm)、大面積(梗死最大徑線> 5.0 cm)][8],職業類型(體力、腦力)。
1.3 統計學方法
數據分析采用SPSS 19.0 統計軟件。計量資料以均數±標準差(±s)表示,比較用t檢驗或重復測量設計的方差分析;計數資料以例(%)表示,比較用χ2檢驗;繪制ROC 曲線;影響因素的分析用多因素逐步Logistic 回歸模型;P<0.05 為差異有統計學意義。
2 結果
2.1 3組血清sICAM-1、VEGF水平比較
健康組、非VD 組、VD 組血清sICAM-1、VEGF 水平比較,經方差分析,差異有統計學意義(P<0.05);進一步兩兩比較,非VD 組、VD 組血清sICAM-1、VEGF 水平較健康組升高(P<0.05);與非VD 組比較,VD 組血清sICAM-1 水平升高(P<0.05),血清VEGF 水平降低(P<0.05)。見表1。
表1 3組血清sICAM-1、VEGF水平比較 (±s)
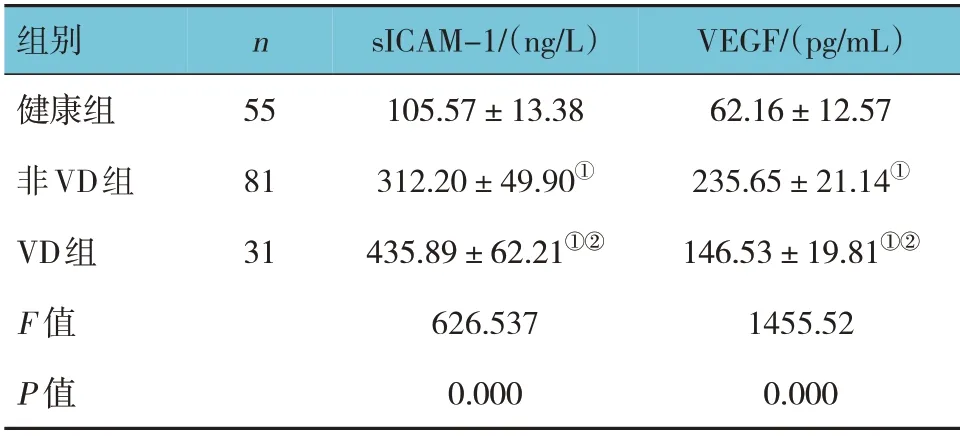
表1 3組血清sICAM-1、VEGF水平比較 (±s)
注:①與健康組比較,P<0.05;②與非VD組比較,P<0.05。
組別健康組非VD組VD組F 值P 值VEGF/(pg/mL)62.16±12.57 235.65±21.14①146.53±19.81①②1455.52 0.000 n 55 81 31 sICAM-1/(ng/L)105.57±13.38 312.20±49.90①435.89±62.21①②626.537 0.000
2.2 兩組臨床資料比較
VD 組和非VD 組的吸煙占比、高血壓及NIHSS評分比較,差異有統計學意義(P<0.05),VD 組較非VD 組高;VD 組和非VD 組的年齡、性別構成、BMI、飲酒、VD 家族史、高鹽飲食、高脂血癥、糖尿病、冠心病、多發性腦梗死、腦梗死病史、腦白質疏松、腦梗死部位、梗死范圍、職業類型比較,差異無統計學意義(P>0.05)。見表2。

表2 兩組臨床資料比較
2.3 缺血性腦卒中后發生VD 影響因素的多因素逐步Logistic回歸分析
以發生VD(無= 0,有= 1)為因變量,以吸煙(否= 0,是= 1)、高血壓(無= 0,有= 1)、NIHSS評分(取原始數值)、腦梗死部位(額葉= 0,顳葉=1,頂葉= 2,枕葉= 3,基底節= 4,丘腦= 5)、sICAM-1(取原始數值)、VEGF(取原始數值)為自變量,行多因素逐步Logistic 回歸分析(α入=0.05,α出=0.10),結果顯示,吸煙[=1.881(95% CI:1.521, 2.242)]、 高血壓[=7.043 (95% CI:4.123,9.963)]、NIHSS 評分[=4.674(95% CI:2.379,6.969)]、額葉腦梗死[=2.396(95% CI:1.985,2.808)]、sICAM-1 [=4.591 (95% CI:2.379, 6.802)]、 VEGF [=4.889 (95% CI:2.147,7.631)]均是缺血性腦卒中后發生VD 的危險因素(P<0.05)(見表3)。
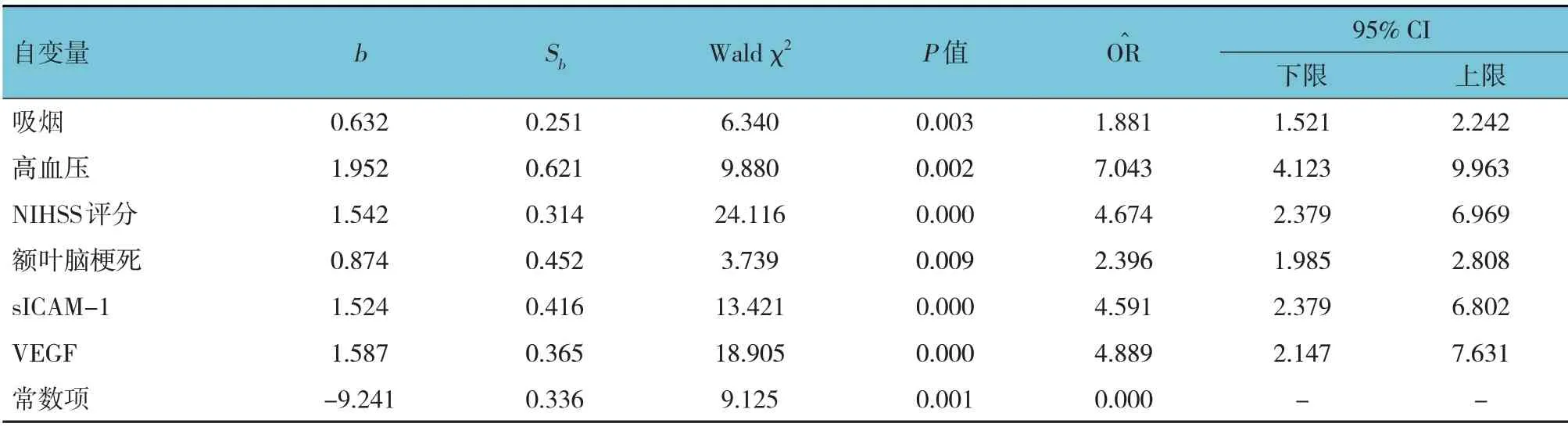
表3 缺血性腦卒中后發生VD影響因素的多因素逐步Logistic回歸分析參數
2.4 血清sICAM-1、VEGF 單獨及聯合檢測對缺血性腦卒中后發生VD的預測效能分析
ROC 曲線顯示,血清sICAM-1、VEGF 預測缺血性腦卒中后發生VD 的最佳截斷值為365.41 ng/L 和216.52 pg/mL,兩者單獨及聯合檢測缺血性腦卒中后發生VD 的AUC 分別為0.754(95% CI:0.664,0.830)、0.793(95% CI:0.706,0.864)、0.868(95% CI:0.791,0.925)。見表4和圖1。
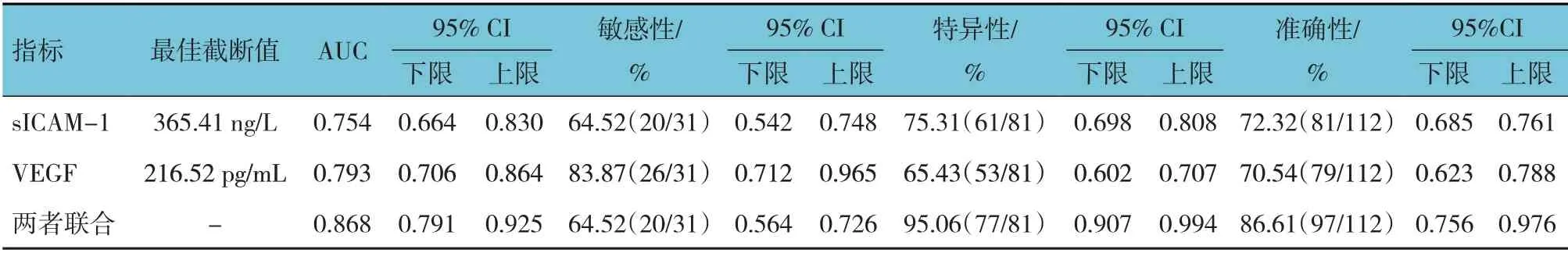
表4 血清sICAM-1、VEGF單獨及聯合檢測對缺血性腦卒中后發生VD的預測效能分析
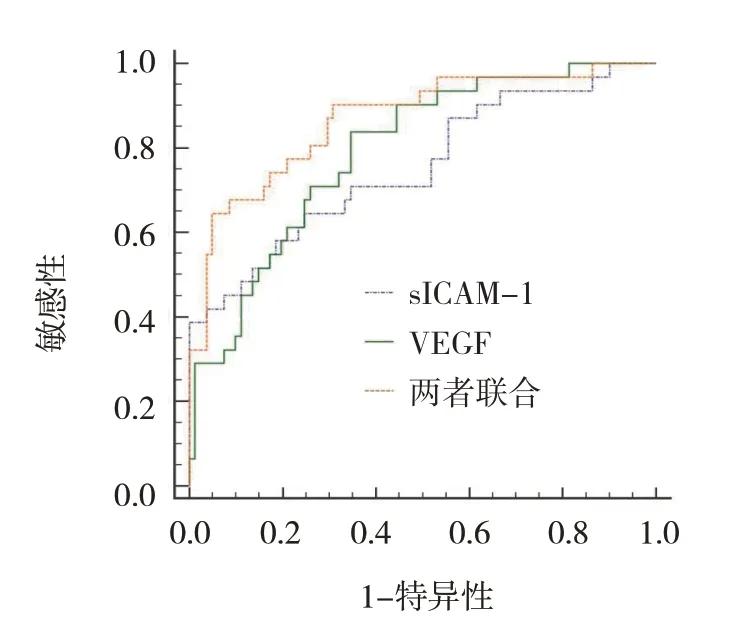
圖1 血清sICAM-1、VEGF單獨及聯合檢測預測缺血性腦卒中后發生VD的ROC曲線
3 討論
缺血性腦卒中后因再灌注損傷與供血、供氧障礙,往往伴有不同程度的神經損傷以及運動、認知及語言功能異常,特別是合并腦動脈硬化時組織血流量及神經元細胞供氧量減少,出現缺血性壞死及神經功能減退,從而誘發VD[9-10]。缺血性腦卒中后VD 主要表現為大腦皮層高級功能發生進行性衰退,腦組織容量變化導致大腦皮層與皮層下的聯系中斷,引發腦脊液循環障礙與神經遞質變化,損傷大腦優勢半球功能。研究發現[11],VD具有可預防性,早期干預可有效降低其發生率。
本研究結果顯示,與非VD 組比較,VD 組吸煙占比、高血壓、NIHSS 評分、血清sICAM-1 水平升高,血清VEGF 水平降低,且多因素逐步Logistic回歸分析顯示,吸煙、高血壓、額葉腦梗死,NIHSS 評分及血清sICAM-1、VEGF 水平均是缺血性腦卒中后發生VD 的危險因素。香煙中的一氧化氮與尼古丁不僅會損傷血管內皮細胞,而且會導致膽固醇升高,激活凝血因子,導致動脈硬化;煙霧將對肺部氧氣交換造成影響,增加血漿中紅細胞濃度,阻礙腦部微循環,增加VD 發生風險[12]。高血壓損傷腦血管內皮細胞,使血液長期處于高凝狀態,加劇動脈硬化,進而導致血管壁厚度增加、管腔狹窄嚴重時閉塞,腦部血流及腦細胞血氧供應減少,能量代謝功能降低,導致神經元丟失及腦萎縮,最終引發VD。JIA 等[13]在研究中國60 歲及以上成年人癡呆和輕度認知障礙的患病率及危險因素時發現,高血壓患者發生VD 的風險明顯升高。腦梗死部位與VD 的發生密切相關。有研究認為[14],額葉纖維分布、走行密集,當其發生缺血性腦卒中時纖維被阻斷,正常代謝功能受到影響,引發額葉為主的腦循環障礙,扣帶回皮層功能被抑制,促進認知功能障礙及VD 發生。此外,大腦前動脈血循受阻通常發生在額葉內側受累患者,進而誘發邊緣系統病變,損傷丘腦、內囊、皮層及皮層下白質發生,導致認知功能障礙。也有學者認為[15],除額葉外,丘腦、顳葉等部位梗死也易導致VD,但是本研究結果并未發現,需要增加樣本量進一步探討。NIHSS 評分可全面評價缺血性腦卒中患者的意識、感覺、反應等,其分數越高缺血性腦卒中患者卒中程度及腦損傷越嚴重,發生VD 的風險更高。sICAM-1 是免疫球蛋白超家族成員,主要表達于血管內皮細胞表面,是白細胞整合素CD11a/CD18、CD11b/CD18 的配體,故可牢固黏附白細胞與血管內皮細胞。在正常狀態下,sICAM-1 穩定低表達,缺血性腦卒中后經活化的血小板與炎癥因子誘導大量生成,并自血管內皮細胞脫落至血液循環[16]。因炎癥反應與缺血性腦卒中后繼發性神經炎損傷的關系密切,sICAM-1 又在白細胞滲出至損傷區域、白細胞與內皮細胞黏附中起重要作用,在缺氧、再氧合的刺激下腦微血管上皮細胞中sICAM-1 的表達明顯增加[17]。此外,缺血性腦卒中患者通常合并長期的動脈粥樣硬化,動脈內膜上沉積大量頸動脈斑塊,斑塊位置的sICAM-1 表達明顯高于其他部位,且其表達越高,斑塊穩定性越差、脫落風險越高,缺血性腦卒中病情加重及發作頻率增加,導致VD[18]。血管因素是缺血性腦卒中后VD 的重要致病因素之一,其中VEGF 作為血管新生的關鍵性活性因子,可通過誘導內皮細胞增殖,促進側支循環的建立,增加腦缺血區域血流量、促進血管新生發揮神經保護作用;維持血管內皮的完整性,參與、誘導新生血管重建;誘導血管內皮細胞釋放組織蛋白酶,加快細胞外基質的降解,從而增加毛細血管的通透性,有助于血管損傷的修復;與血管生成素2 共同作用,促進內皮細胞通過出芽的形式加快血管生成,維持血管可塑性并加快其重構;促進一氧化氮釋放,維持血管舒張及正常的內皮功能。缺血性腦卒中后VEGF 大量表達,可有效減少神經元細胞凋亡,促進神經再生,減輕缺血、缺氧引發的損傷,并具有長期修復功能,避免腦細胞退化及萎縮[19]。
本研究ROC 曲線結果顯示,血清sICAM-1、VEGF 預測缺血性腦卒中后發生VD 的最佳截斷值分別為365.41 ng/L 和216.52 pg/mL,兩者單獨及聯合檢測缺血性腦卒中后發生VD 的AUC 分別為0.754、0.793、0.868,提示兩者聯合檢測預測缺血性腦卒中后VD 發生的效能高于單獨檢測。盡管血清sICAM-1、VEGF 作為神經功能損傷的相關標志物對VD 的發生具有預測作用,但檢測結果易被外界因素干擾,準確性有待提升,兩者聯合可減少外界因素干擾,提升整體預測價值。
綜上所述,缺血性腦卒中致VD 患者血清sICAM-1 高表達,VEGF 低表達,兩者單獨及聯合檢測對缺血性腦卒中后VD 的發生具有較高的預測價值。本研究仍然存在一定不足,所選樣本量較少,樣本來源有一定局限性,僅納入住院患者,無門診患者,可能會導致選擇偏倚。在今后研究中需擴大樣本量及患者來源,提高研究結果的可信度。

