趨化因子CXCR7/CXCL11/CXCL12 生物軸在狼瘡腎炎患者外周血中表達研究
祖蓓蓓 馬倩倩 饒詠梅 李美榮 劉 琳 張 麗
1.江蘇省徐州市醫學科學研究所,江蘇徐州 221009;2.江蘇省徐州市中心醫院風濕免疫科,江蘇徐州 221009;3.江蘇省徐州市中心醫院腎內科,江蘇徐州 221009
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種慢性多系統受累的自身免疫疾病,臨床表現具有高度異質性、復雜性。發病機制尚不清楚,主要與免疫功能異常有關[1-2]。其中趨化因子可通過對免疫細胞調控,參與自身免疫病的發病[2-3]。
CXC 型趨化因子受體(CXC chemokine receptor,CXCR)7 屬于7 次跨膜G 蛋白偶聯受體超家族中一員,其與CXC 型趨化因子配體(CXC-type chemokine ligand,CXCL)12、CXCL11 雙配體結合,發揮對免疫細胞遷移、促進炎癥、增強血管生成和白細胞外滲等免疫調節作用[4-7]。近年來有研究報道CXCL11、CXCR7 在骨關節炎、銀屑病、皮肌炎、類風濕關節炎、干燥綜合征、系統性硬皮病、自身免疫性甲狀腺炎、炎癥腸病等免疫相關疾病中高表達[6-12]趨化因子CXCL11、CXCL12及其受體CXCR7 在狼瘡腎炎(lupus nephritis,LN)患者中表達情況,目前國內外尚無統一的研究結論。本研究擬通過檢測LN 患者及健康者外周血中CXCL11、CXCL12、CXCR7 表達水平,探討CXCR7/CXCL11/CXCL12 生物軸在LN 發病中的作用。
1 資料與方法
1.1 一般資料
本研究獲得江蘇省徐州市中心醫院(以下簡稱“我院”)倫理委員會批準及入組受試者簽署知情同意書。依據SLE 分類標準(美國風濕病協會修訂)[13-14],入組40 例我院風濕免疫科2018 年10 月至2020 年10 月就診SLE 患者,再根據LN 必須滿足尿蛋白>0.5 g/24 h或紅細胞管型尿>5 個/幽門螺旋桿菌的要求[13-14],將入組的SLE 患者分為LN 組24 例,平均年齡(36.8±12.6)歲;男2 例,女22 例。無腎損害SLE 患者組(非LN 組)16 例,平均年齡(37.4±11.3)歲;男1 例,女15 例。對照組:20 名健康對照組為我院健康體檢者,平均年齡(37.2±11.8)歲;男2 例,女18 例。三組性別、年齡比較,差異無統計學意義(P >0.05),具有可比性。
1.2 檢測指標
各組外周血中CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 表達,及SLE患者24 h 尿蛋白定量、ANA、ANA 譜、免疫球蛋白、補體、紅細胞沉降率臨床指標檢測。
1.3 檢測方法
1.3.1 標本采集 分別采集研究對象空腹外周靜脈血共8 ml,分2 管(4 ml/管)。其中1 管(肝素抗凝管)4 ml 血標本行流式細胞術檢測,另一管(分離膠促凝管)4 ml 血標本離心,離心半徑10 cm,3000 r/min,離心10 min,收集血清,-80℃凍存,用于酶聯免疫吸附試驗法檢測。
1.3.2 流式細胞術 依次取熒光抗體CD3FITC 10 μl+CD19PE 10 μl+IgG2αAPC 10 μl+抗凝全血50 μl 加入1 支流式管中,取熒光抗體CD3FITC 10 μl+CD19PE 10 μl+CXCR7APC 10 μl+抗凝全血50 μl 熒光抗體加入第2 支流式管中(美國BD 公司,批號:9151960、7299982、8339984、9229185,FACS Calibur 流式細胞儀),混勻、室溫避光孵育、溶血、孵育10 min、離心半徑10 cm,1000 r/min 離心5 min,離心去上清液、1 ml PBS 離心洗滌2 次,去上清液、500 μl PBS 混勻、3 h內上機檢測、軟件獲取數據及分析。
1.3.3 酶聯免疫吸附試驗法檢測 嚴格按照試劑盒的說明書操作,將檢測待測樣本、標本品儲存液稀釋備用,分別加入檢測孔、孵育、洗滌、吸干、加入樣本結合物、孵育、洗滌、吸干、加底物溶液、反應、加入反應終止液、靜置30 min 后測定吸光度,繪制標準曲線,計算待測樣本中CXCL11、CXCL12 的濃度(美國R&D System 公司,貨號:DCX110/891030、DSA00/890813)。
1.4 統計學方法
采用SPSS 25.0 對所得數據進行統計學分析,正態分布計量資料采用均數±標準差()表示,采用方差分析,非正態分布計量資料采用中位數(四分位)[M(P25,P75)]表示,采用非參數Kruskal-Wallis H 檢驗。相關分析數據為非正態分布資料,采用Spearman 相關分析。以P <0.05 為差異有統計學意義。
2 結果
2.1 三組外周血中CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 表達情況
三組CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 表達水平比較,差異均有統計學意義(P <0.05)。其中LN 組CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 表達水平均高于非LN 組、健康對照組,差異均有統計學意義(P <0.05)。非LN 組CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 表達水平高于健康對照組,差異均有統計學意義(P <0.05)。見表1。
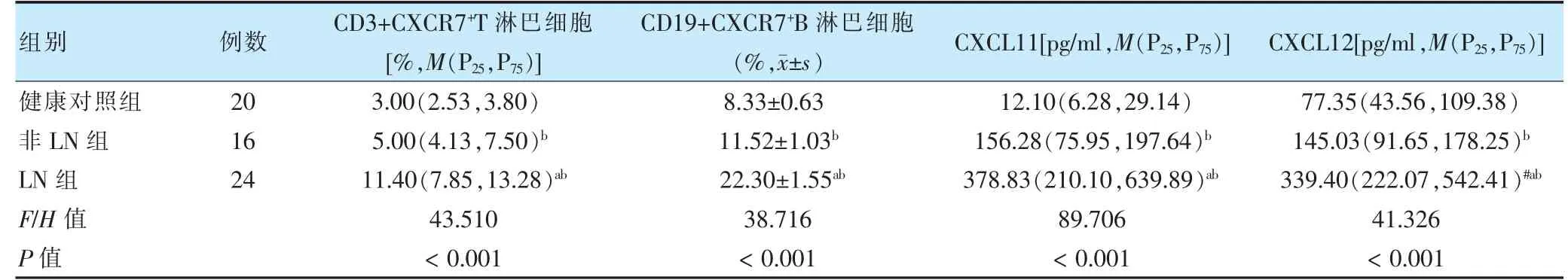
表1 三組外周血中CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞、CXCL11、CXCL12 比較
2.2 狼瘡腎炎患者外周血中CXCL11、CXCL12、CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞與24 h 尿蛋白定量的相關性分析
狼瘡腎炎患者外周血中CXCL11、CXCL12、CD3+CXCR7+T 淋巴細胞、CD19+CXCR7+B 淋巴細胞表達水平與24 h 尿蛋白定量呈正相關關系(r=0.860、0.853、0.740、0.816,P <0.001)。
3 討論
SLE 是一種慢性、多系統多臟器受累的自身免疫疾病[1],臨床表現具有高度異質性、復雜性和多樣性。發病機制尚不清楚,主要的免疫異常表現為先天和適應性免疫異常、免疫細胞異常活化或功能異常,導致異常抗體、細胞因子、趨化因子生成,進一步引起組織臟器損傷[1-2]。
趨化因子是一組小分子量(7~12 kD)蛋白家族,是細胞因子家族中唯一作用于G 蛋白偶聯受體的超家族的成員,趨化因子可以通過對免疫細胞時間和空間定位調控,發揮對免疫系統的發育、免疫監視、免疫啟動、免疫調節等作用[5]。即可通過受體誘導吞噬細胞和淋巴細胞等效應細胞的游走和活化,保護機體防御外來致病物,同時趨化因子可在特定的環境中異常表達,過度活化免疫細胞進而攻擊正常組織,導致自身免疫性疾病,故趨化因子和自身免疫性疾病密切相關[14-17]。
根據趨化因子N 端保守的半胱氨酸基序,趨化因子可分為4 個亞家族(XC、CC、CXC 和CX3C),相應結合受體分別命名(XCR、CCR、CXCR 和CX3CR)[16]。典型的跨膜趨化因子受體與配體結合,通過G 蛋白依賴途徑向胞內傳遞信號,發揮趨化效應[16]。除了18 個典型的趨化因子受體外,趨化因子受體家族還包括4 種非典型趨化因子受體(Atypical chemokine receptor,ACKR),即ACKR1、ACKR2、ACKR3、ACKR4[18-20]。其中ACKR3 又命名為CXCR7,與CXCL11 和CXCL12雙配體結合,通過非G 蛋白依賴性信號的β-arrestin通路途徑,不具有經典的趨化性,但能調節趨化因子的趨化性、可用性和效應性,故又稱為清道夫受體或誘騙受體[20-21]。
趨化因子CXCL12 是表達最廣泛的趨化因子,其主要由單核細胞、中性粒細胞、活化的T 細胞、B 細胞表面及樹突細胞表達[22]。CXCL11 為γ 干擾素誘導,白細胞、內皮細胞和成纖維細胞在內的多種細胞系產生[23]。CXCL11、CXCL12 共受體為CXCR7,其中CXCL11 依賴于CXCR7 的N 端和一些細胞外環位置進行初級結合,細胞外環殘基介導次級結合和β-arrestin招募。而CXCL12 與CXCR7 結合需要關鍵殘基Asp-1794.60 和Asp-2756.58,沒有明顯的N 端殘基參與,提示CXCL11 與CXCR7 結合、CXCL12 與CXCR7 結合模式不同,其趨化效應、免疫學效應也有所不同[24-25]。
有文獻報道,趨化因子CXCL11 在皮肌炎患者肌肉中的表達增加[6]。CXCL11 在正常的唾液腺中幾乎不存在,在干燥綜合征的唾液腺病變中高表達CXCL11mRNA,提示CXCL11 參與干燥綜合征的唾液腺免疫損傷病理過程[11]。CXCL11 參與系統性硬化癥毛細血管病變,并與系統性硬化癥的嚴重程度呈正相關[9]。在類風濕關節炎中,CXCR7 在滑膜內皮細胞和未受刺激的人臍靜脈內皮細胞上表達,CXCL12 在類風濕關節炎滑膜成纖維細胞表達升高,血管生成和促炎因子增強[10]。另外,CXCL11 在骨關節炎滑膜中上調,通過激活破骨細胞與脾細胞的分化,發揮促炎作用[12]。本課題組前期研究結果提示CXCL12 與其另一受體CXCR4 在SLE、LN 患者外周血T 細胞上高表達,且CXCL12、CXCR4 與SLE 疾病活動評分和腎損害、血液系統損害正相關[26-27]。
本研究結果顯示,LN、非LN 的SLE 患者外周血中T、B 細胞表面CXCR7 和血清中CXCL11、CXCL12表達水平均高于健康對照組,差異均有統計學意義(P <0.05)。上述指標表達,LN 患者高于非腎損害SLE 患者,差異均有統計學意義(P <0.05),LN 組患者外周血中CXCR7、CXCL11、CXCL12 表達水平與24 h尿蛋白定量呈正相關,提示CXCR7、CXCL11、CXCL12在LN 患者體內有意義的高表達,與腎損害嚴重程度相關,CXCR7/CXCL11/CXCL12 生物軸參與LN 發生發展過程。筆者推測LN 患者體內高表達的CXCL11、CXCL12,可與T、B 細胞表面趨化因子受體CXCR7 結合,通過β-arrestin 途徑,發揮趨化因子清除、內化、降解、胞吞及自我雙向表達調控,誘導自身反應性B 細胞、T 細胞分化和活化,促進免疫復合物沉積在腎臟,促進補體活化和腎臟組織損傷[23-25]。
總結,本研究提示趨化因子CXCR7、CXCL11、CXCL12 高表達與SLE 合并腎臟損害有關聯,CXCR7/CXCL11/CXCL12 生物軸可能是LN 發病過程中一種重要的免疫介質,CXCR7/CXCL11/CXCL12 生物軸可能成為LN 治療的新靶點或有針對性地進行藥物干預的關鍵因子,這也為LN 的臨床治療開辟了新的思路和視野。CXCR7/CXCL11/CXCL12 生物軸與LN 患者腎臟組織結構中的病理特點相關性如何?以及其參與腎損害的下游信號機制為何?本課題組將進一步探討和研究。

