酸性礦山廢水微生物組時空演變特征及微生物-礦物互作機制
馮乙晴,郝立凱,郭圓,徐緋,徐恒
1. 中國科學院地球化學研究所/環境地球化學國家重點實驗室,貴州 貴陽 550081;2. 中國科學院第四紀科學與全球變化卓越創新中心,陜西 西安 710061;3. 中國科學院大學, 北京 100049;4. 四川大學,四川 成都 610065
酸性礦山廢水(Acid Mine Drainage,AMD)是以硫鐵礦為主的礦石和尾礦暴露于空氣、水等介質中,在由微生物主導作用下反應產生的低pH、高SO42?且富含各種重(類)金屬的廢水(Akcil et al.,2006;Moncur et al.,2009)。AMD會對受納環境系統產生十分嚴重的危害,如加重巖溶含水層的污染(Ren et al.,2021),改變有毒金屬的賦存形態并影響區域土壤微生物群落(Pan et al.,2021),是世界范圍內最嚴重的環境問題之一(Simate et al.,2014)。
微生物是 AMD形成過程的主要驅動者,對AMD元素環境地球化學循環、生物成礦和污染修復具有重要作用(Johnson et al.,2003;Nordstrom et al.,2015)。盡管AMD酸度極高,但使用傳統的培養方法和高通量組學方法,已鑒定出了多種多樣的微生物,包括細菌、古菌和真核生物(主要是真菌和藻類)(Olsson et al.,2015;Chen et al.,2016;Abinandan et al.,2019;Abinandan et al.,2020)。近年來,微生物組學技術(基因組學、轉錄組學、蛋白組學、代謝組學、表型組學)的快速發展為原核微生物、真核微生物的群落多樣性特征和時空演變特征研究打開了廣闊視角(Edwards et al.,2000)。該技術能夠識別微生物群落的基因、功能和代謝特征(Schloss et al.,2005;Sahoo et al.,2021),為AMD微生物群落、功能和代謝多樣性的時空演變特征研究提供了技術支持,也為AMD生物處理系統的工程應用提供了理論支撐(Hallberg,2010;Villegas-Plazas et al.,2019)。
本文系統綜述了微生物組學技術在AMD系統研究中的應用及其在不同時間序列(尾礦酸化過程、生物膜發育過程和生物處理過程及季節演替)和空間尺度(地理隔離、局部空間中的縱橫分布、精細尺度)上的演變特征,分析了微生物群落在AMD系統鐵硫生物地球化學循環和水體自凈中的重要作用,進一步梳理了AMD系統中微生物-礦物相互作用的可能機制,最后提出了整合微生物組學技術和礦物學分析技術在AMD微生物生態演替、進化和應用研究中的展望,以期從生態學、地球化學和礦物學等多學科角度為AMD污染修復提供科學依據。
1 組學技術在AMD微生物學研究中的應用
1998年,Handelsman et al.(1998)首次將“宏基因組”定義為特定環境中全部微生物及其遺傳信息的集合。自 2006年以來,隨著高通量測序和質譜等技術的飛躍發展,以“DNA—RNA—蛋白質—代謝物”為中心法則的多組學技術(圖1)徹底改變了微生物學領域。Stulberg et al.(2016)將微生物組定義為在特定環境下的多物種微生物群落,強調運用宏基因組技術對微生物從群落到功能、代謝等層面進行全面分析。此后,隨著微生物生態研究的深入,轉錄組學、蛋白組學、代謝組學和表型組學等技術逐步發展并得到廣泛應用。
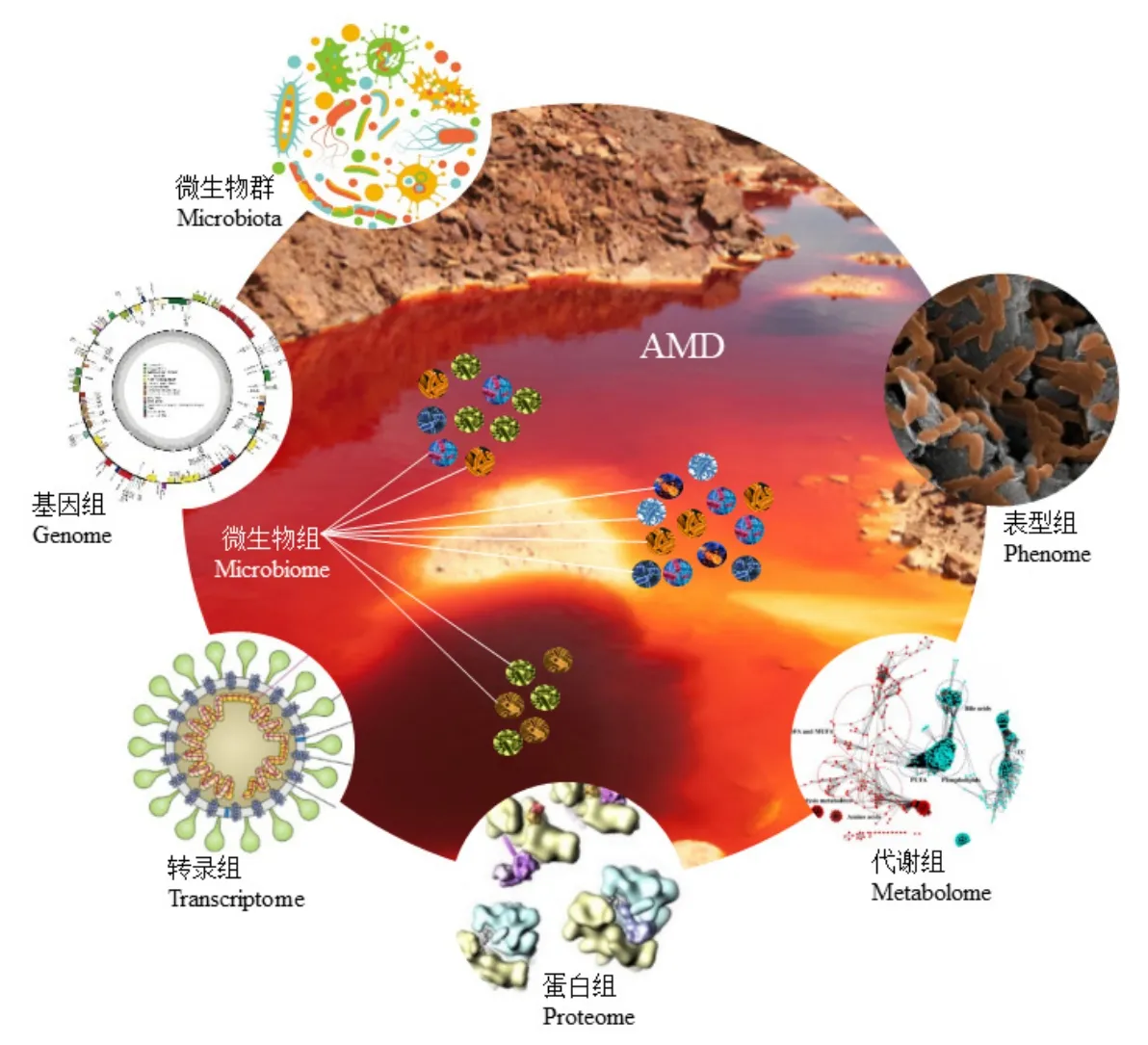
圖1 多組學技術在AMD微生物生態學研究中的應用Figure 1 Application of multi-omics techniques in microbial ecology of AMD
宏基因組學有助于確定AMD系統中關鍵的微生物過程及其群落組成在不同的生態位之間的相互作用,并可指導AMD生物處理中的微生物群落組裝以高效去除或提取水體中的金屬元素(Allen et al.,2005;Desoeuvre et al.,2016;Liu et al.,2019c;Liu et al.,2019a;Liu et al.,2019b;Grettenberger et al.,2021;Pan et al.,2021)。2004 年,Tyson et al.(2004)運用宏基因組學技術從AMD生物膜中獲得了完整的LeptospirillumⅡ和Ferroplasmatype Ⅱ基因組序列,以及LeptospirillumⅢ、FerroplasmatypeⅠ和G-plasma的部分基因組序列。此后,研究人員進一步發現變形菌門(Proteobacteria)、硝化螺菌屬(Nitrospira)、放線菌門(Actinobacteria)、厚壁菌門(Firmicutes)、酸桿菌門(Acidobacteria)、產水菌門(Aquificae)和候選糖桿菌(Candidate saccharibacteria)代表了 AMD微生物群落的主要譜系,其中鐵硫氧化細菌——Acidithiobacillus(γ-Proteobacteria)、Leptospirillum(Nitrospirae)和Ferrovum(β-Proteobacteria)為優勢屬(Hua et al.,2015;Méndez-García et al.,2015;Chen et al.,2016)。
轉錄組學研究識別了可以解釋極端微生物功能特征的基因序列,其中部分序列可能是通過水平基因轉移獲得的,如已被確定的Galdieria suluraria(Sch?nknecht et al.,2013)和嗜酸Chlamydomonas eustigma(Hirooka et al.,2017)的基因組序列。此外,該組學研究還揭示了嗜酸微藻在酸性和富金屬環境中生存的獨特基因,強調采用多組學方法(圖1)進行系統研究的必要性,以明確重金屬毒性和微生物適應性反應之間的分子機制(Olsson et al.,2015;Long et al.,2016;Puente-Sánchez et al.,2016;Olsson et al.,2017;Tripathi et al.,2021),以及AMD系統中常見和稀有原核生物的生態作用(Hua et al.,2015)。
蛋白質組學研究證明了AMD系統中金屬抗性和耐酸性蛋白的重要性,表明與特異性功能相關的基因片段和與某種功能相關的蛋白質組分之間存在差異,這可能是微生物在極端酸性、富金屬環境中適應特定生態位的關鍵機制(Tyson et al.,2004;Ram et al.,2005;Lo et al.,2007;Zhang et al.,2019),而代謝途徑和基因表達譜重建分析揭示了其潛在的生理機制(Anantharaman et al.,2016;Long et al.,2016)。例如,Whitaker et al.(2006)發現了AMD生物膜群落中的單核苷酸多態性,揭示了極端條件下微生物群落的種群動態和進化;Xie et al.(2011)通過分析微生物對AMD金屬脅迫的代謝特性,發現菌株對高濃度 Cu的耐受性響應是下調氨基酸代謝途徑,以此作為其在AMD中的一種生存機制;還有研究發現,微生物可通過調節膜脂質成分來應對極端酸性環境脅迫(Dean et al.,2019)。
運用表型組學可進一步直觀揭示AMD環境中微生物-礦物作用(Microbial-mineral Interaction,MMI)特征,研究發現MMI是驅動AMD表型性狀(如離子強度、pH、pO2、ORP等)演化的主要作用力,促使其積累異質性較大的次級產物或中間產物,以及形成時間和空間序列上的離子和pH梯度(Xia et al.,2020),最終導致AMD系統微生物群落、功能、代謝等的演化。
組學技術在 AMD系統微生物生態學研究中的廣泛應用為 AMD生物處理中微生物菌群組裝提供了理論指導,同時有助于生物浸礦技術的開發和應用。
2 AMD微生物組時空演變特征
微生物群落的形成過程取決于空間、時間及系統發育尺度,不同的生態過程可能在不同規模的生態系統上占主導地位,研究AMD微生物組的時空演變特征有助于明確哪些生態過程對微生物群落的構建具有重要作用(Ladau et al.,2019)。基于生態位的微生物群落形成過程由環境的多樣性模式和 pH、氧化梯度等環境化學梯度變化主導(Lozupone et al.,2007),而基于尾礦酸化過程(圖2a①)、生物膜發育過程(圖2c)、生物處理過程(圖2d)和水熱驅動的季節演替(圖2a、b)的不同時間序列及基于局部(圖2a②、③、④)和精細空間尺度的AMD系統所提供的生態位獨特多樣,適應極端酸性和有毒金屬環境的微生物能夠在這些獨特的生態位上進行活躍的代謝。AMD生物處理是一個多尺度的復雜問題,借助微生物組學技術可以充分理解其復雜的微生物群落結構是如何發揮作用的,及其組分在各自的生態位上的作用規律,從而為AMD生物處理提供生態學理論指導。
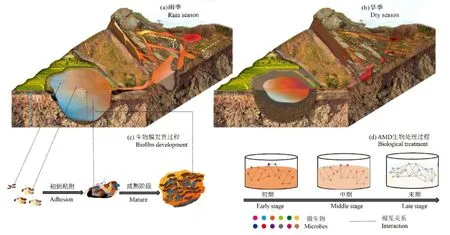
圖2 AMD微生物群時空演變特征Figure 2 Spatio-temporal evolution characteristics of microbiota in AMD
2.1 AMD微生物組在不同時間序列上的演變特征
2.1.1 不同尾礦酸化過程
礦山尾礦酸化是AMD的主要成因。研究人員大多采用空間替代時間(圖2a①)的方法對與尾礦酸化相關的微生物多樣性和群落功能的動態變化進行研究(Huang et al.,2011;Chen et al.,2013;Liu et al.,2014;曹子敏等,2019),結果表明,大多數優勢菌系的α多樣性和相對豐度與pH值具有顯著相關性,pH在調節嗜酸微生物群落結構和功能方面具有重要性(Belnap et al.,2011a),尾礦酸化的不同階段具有不同的微生物群落組成特征(Tan et al.,2008;Belnap et al.,2010;Belnap et al.,2011b;Chen et al.,2013;Dean et al.,2019;Abinandan et al.,2020)。例如,未發生酸化的尾礦中的微生物種群與中酸性或極酸性尾礦中的微生物種群具有顯著差異,古菌、A. ferrooxidans和Leptospirillumspp.的豐度在黃鐵礦發生氧化前很低(Huang et al.,2011);而在極酸性尾礦中,Ferrovum成為優勢種群,其在鉛鋅礦尾礦的生物地球化學過程中具有重要作用(Tan et al.,2008;Huang et al.,2016)。也有研究表明,AMD微生物多樣性在體系pH 低于3.0時才出現顯著下降(Chen et al.,2014)。值得注意的是,AMD系統微生物群落Simpson多樣性指數的結果符合中期物種豐富度假說(Howard et al.,2003),即尾礦酸化中期微生物物種最豐富。最后,在AMD自然衰減過程中,由于酸脅迫程度降低,產酸鐵硫氧化菌和(類)金屬相關菌群以及特定菌群的豐度呈上升趨勢(Liu et al.,2019c)。
2.1.2 不同生物膜發育過程
AMD系統中微生物群落結構、代謝過程和功能表達均以生物膜為發生場所(Denef et al.,2010)。生物膜發育一般經歷初始粘附階段(低發育)、成熟階段(高發育)和分離階段,而不同基因型微生物群體在生物膜發育的不同階段占主導地位(圖2c)(Wilmes et al.,2009a;Liu et al.,2020),表明這種群落分化可能引發不同的生態策略(Denef et al.,2010)。在生物膜中觀察到的微尺度上的異質性反映了AMD生態系統中微生物群落的高度多樣性(Simmons et al.,2008;Yelton et al.,2013;R?der et al.,2019;Pandey et al.,2021),證明了 AMD細菌和古菌在相對較短的時間尺度(幾年)上通過突變、遷移和基因重組(包括質粒或噬菌體的水平基因轉移)發生進化(Yelton et al.,2013)。在生物膜低發育階段,來自嗜鐵氧化的LeptospirillumⅡ細菌的蛋白質占據蛋白質組的絕大多數;而在成熟階段,生物膜定植體蛋白質豐度較高,古菌占據優勢地位(Mueller et al.,2010),此時生物膜上的微生物具有更多樣的異養代謝過程(Wilmes et al.,2009b;Justice et al.,2012)。快速的適應性進化促使LeptospirillumⅡ 種群成為成熟生物膜中的主要初級生產者和最活躍的鐵氧化菌,從而推動了AMD的形成(Denef et al.,2012)。
2.1.3 不同生物處理過程
微生物是AMD生物處理器的主導者,而生物處理效率的提高有賴于對其群落組成、功能和基因的深入探析。在 AMD生物處理過程中,系統 pH逐漸上升,微生物群落的結構和豐度都發生了變化(圖2d)(彭玙萍等,2020),其中,古菌總數量在不同生物處理階段之間波動,真菌群落豐度則隨著處理時間的推移出現波動或下降,而細菌豐度呈先上升后下降趨勢(Drury,1999;Deng et al.,2016;Coral et al.,2018)。在連續攪拌槽式反應器中,由于厭氧環境不適合某些微生物生存,微生物豐度在生物處理過程中呈逐漸下降趨勢(Akinpelu et al.,2021)。此時,嚴格厭氧和兼性厭氧的厚壁菌門微生物之間表現出協同作用,從而成為AMD生物處理器中的優勢菌群(Kamika et al.,2014;Méndez-García et al.,2015;Teng et al.,2017),尤其是芽孢桿菌(Bacilluspp.),對AMD的極酸性具有較高的適應能力,是對受污染環境進行生物修復的理想材料(Coral et al.,2018;Akinpelu et al.,2021)。隨著AMD生物處理進程的推進,攜帶關鍵功能基因的微生物種群豐度和多樣性不斷增加,尤其是硫酸鹽還原菌(Lin et al.,2021)。
2.1.4 季節演替
水熱驅動的干濕季變化導致 AMD環境條件(溫度、養分、水量補給等)出現季節性變化(圖2a、b)(Fonyuy et al.,2008),其微生物群落多樣性、優勢種群一般也隨之發生相應的季節性變化(Baker et al.,2009;Tan et al.,2009;Hao et al.,2017;Xin et al.,2021)。雨季AMD生物膜易被雨水沖洗,依附生物膜生長的特定菌群的多樣性可能會下降(Denef et al.,2012)。例如,加利福尼亞州鐵礦AMD生物膜中細菌種群比例以1月份的最高(95%),真核生物幾乎不存在;而古菌群落比例以7月和9月的最高(50%),冬季幾乎不存在。研究揭示了細菌和古菌種群變化與電導率和降雨量存在相關關系(Edwards et al.,1999)。對安徽省南山受AMD污染湖泊的研究也證實了原核生物群落和真核生物群落均表現出強烈的季節性變化,其中真核生物群落季節變化比原核生物群落變化更劇烈;光自養藻類(初級生產者)與原生動物或鞭毛蟲(頂級消費者)為適應四季更替形成了獨特的食物網,溫度是主導這些微生物群落季節性變化的環境因子;棕鞭藻和衣藻(導致冬季高水華)因生長溫度不同,分別出現在秋夏季和冬春季(Hao et al.,2017;Xin et al.,2021;裴理鑫等,2016;曹子敏等,2019)。Lake Paitu的原核生物組成存在明顯的季節變化,但在大多數季節,Ferrovum是主要的鐵氧化細菌;衣藻是該湖泊主要的真核生物,在 12月底高度繁殖,為異養細菌提供了豐富的營養物質(Xin et al.,2021)。而在樊口尾砂氧化帶和氧化鋒中,以嗜酸Ferroplasma acidiphilum為主的古菌是該礦區土著原核微生物的優勢物種,季節變化雖未導致土著微生物群落組成發生顯著變化,但春季微生物多樣性指數顯著高于冬季,且優勢物種豐度也發生了一定變化(Huang et al.,2011)。
2.2 AMD微生物組在不同空間尺度上的演變特征
2.2.1 地理隔離
AMD系統微生物生態學的相關研究表明,pH是主導AMD微生物群落組成、功能和代謝的決定性因素(Sul et al.,2011;Kuang et al.,2013;Huang et al.,2016)。盡管地理距離較遠且基質類型不同,AMD系統微生物主要群體均為嗜酸菌(Sul et al.,2011;Huang et al.,2016)。從尾礦(Gupta et al.,2017)、礦坑(Gonzalez-Toril et al.,2013)、地表水(Villegas-Plazas et al.,2019)、沉積物(Jin et al.,2022)、土壤和孔隙水(Pan et al.,2021)等不同的AMD環境中分離出的微生物,其16S rRNA序列具有高度相似性(Edwards et al.,2000;Golyshina et al.,2000;Kuang et al.,2013;謝學輝等,2009),主要類群均為變形菌門、酸桿菌門、厚壁菌門、硝化螺旋菌門(Nitrospirae)、放線菌門和廣古菌門(Euryarchaeota)等,參與這些類群的能量生產、營養代謝和生物反應的基因是該微生物群落結構的主導基因。而來自世界各地的AMD系統的微生物群落的16S rRNA基因測序數據表明,AMD水體及生物膜中的微生物群落多樣性通常低于受其影響的土壤/沉積物及生物反應器中的(Villegas-Plazas et al.,2019)。地理隔離導致的不同AMD空間類型對微生物群落異質性的貢獻有限(Kuang et al.,2013)。然而,AMD環境中的微生物譜系并不是隨機分布的,而是在更小的空間尺度上呈現出更強的系統聚類趨勢。
2.2.2 局部空間
2.2.2.1 水平分布
在AMD特定地點的連續性空間中(圖2a②),其環境地球化學條件常沿水平方向存在多個梯度分布,如河流上游—下游、梯田下層—上層(劉帆等,2019),導致其微生物群落結構和功能基因,如異化亞硫酸鹽還原酶基因(Moreau et al.,2010)、砷相關基因(Desoeuvre et al.,2016),沿環境化學梯度呈多樣性分布。研究人員采集了AMD單向徑流上游和下游兩個位點(相距約140 m)的生物膜進行研究,發現LeptospirillumⅢ 基因型在上游生物膜中占據主導地位,在下游采集的3個生物膜中僅有1個出現同類現象,而即使上下游位點都存在LeptospirillumⅢ,其基因組也是不同的(Denef et al.,2012)。在鈾濃縮廠的入口和出口處,氧化還原梯度變化塑造了原生含水層厭氧、微氧生境中的微生物群落結構,AMD的注入使這些微環境中的微生物群落結構發生了劇烈的變化,細菌豐度和多樣性都出現大幅下降(Coral et al.,2018)。在受AMD污染梯田中,上層田土壤微生物種群以酸桿菌占優,而下層田以廣古菌占優,金屬桿菌(Metallibacterium)、鉤端螺桿菌(Leptospirillum)和微古念珠菌(Candidatus microrarchaeum)顯著富集于下層田中,富集在較低層區域的細菌類群具有不同的代謝策略,其固碳和硫氧化過程相對活躍(Xu et al.,2020;Sun et al.,2020b)。在 AMD 匯入河流中,從上游站點的樣本中鑒定出的操作分類單元(Operational Taxonomic Unit,OTU)數量更多,微生物多樣性也更高(Pan et al.,2021)。
2.2.2.2 垂直分布
在受AMD污染的水體(圖2a③)和土壤(圖2a④)/沉積物中,通常存在多個環境化學條件的垂直分布梯度,這種垂直環境梯度驅動了微生物群落多樣性和結構的分化,而pH值是影響該垂向空間微生物分布格局的關鍵驅動因素(Gao et al.,2020;She et al.,2021a;Zhou et al.,2022)。相關研究表明,與自然水體的分層相比,AMD湖泊中pH、重金屬和硫酸鹽濃度等的化學分層通常較顯著。底層水體由于環境選擇壓力較小,微生物群落多樣性和豐度較高(Torres et al.,2015;Salmon et al.,2017;She et al.,2021a)。原核微生物群落結構在AMD湖泊水體垂直梯度上存在顯著變化,微生物多樣性隨深度增加而增大,其中變形菌門在表層水中占主導地位,厚壁菌門和廣古菌門則富集于底層,這是由于上層水體承受的酸脅迫較強,導致微生物的環境選擇壓力突出,故微生物多樣性顯著降低,物種共現頻率升高。這種由酸脅迫主導的環境效應驅動了湖泊AMD微生物群的聚集和共存,奠定了AMD湖泊微生物群落功能的垂向分布格局(Espa?a et al.,2009;Cerón et al.,2014;Falagán et al.,2014)。此外,光強度、溶解氧和有機質含量的垂直變化亦對 AMD水體微生物的群落的分布具有重要影響(Grettenberger et al.,2020;She et al.,2021b)。同樣地,在AMD污染土壤中,酸性水在土壤垂直剖面上引起的地球化學梯度改變了有毒金屬形態,并富集了適應不同環境化學條件的土壤微生物群落(Li et al.,2019;Pan et al.,2021)。
2.2.3 精細尺度
在精細尺度上研究微生物群落組成和物種豐度的變化有助于準確判定驅動群落結構變化的決定因素(Doney et al.,2012;Stocker,2012)。目前,在AMD系統中進行精細尺度上的微生物群落研究鮮有報道,以Liang et al.(2017)研究為代表,其將采樣量定義為不同的獨立空間尺度,研究了不同精細空間尺度(1 mL—10 L)下AMD微生物群落組成的變化。結果表明,在門水平上,大尺度樣品中廣古菌門的相對豐度明顯高于小尺度樣品中的,而厚壁菌門的相對豐度則呈現相反的趨勢;在屬水平上,γ-Proteobacteria和Nitrospira的相對豐度在不同空間尺度上存在顯著差異,而α-Proteobacteria的豐度在不同空間尺度上保持相對穩定。微生物群落組成具有明顯的空間體積依賴性,空間尺度差異越大,樣品間微生物群落組成差異越顯著。研究推測,群落組成在精細尺度上的異質性可能是共存物種之間相互作用的結果(Stocker,2012),生物和生態相互作用驅動細菌群落重組的速率比水體本身的物理運動速率更快(Yannarell et al.,2004;Yannarell et al.,2005;Lear et al.,2009)。
3 微生物驅動的AMD系統Fe-S生物地球化學循環
在AMD生態系統中,鐵和硫的微生物氧化是產生 Fe3+和 SO42?的重要地球化學過程,且在特定環境條件下,鐵還原菌(IRB)和硫酸鹽還原菌(SRB)可以還原Fe3+和SO42?,完成該生態系統的鐵硫循環(Baker et al.,2003;Schippers et al.,2010;Sahoo et al.,2021)。在pH<3的AMD中,鐵硫元素的氧化以微生物作用為主,如氧化亞鐵鉤端螺旋桿菌(Leptospirillum ferrooxidans)(Vera et al.,2013)、氧化亞鐵硫桿菌(Acidithiobacillus ferrooxidans)(Feng et al.,2022)等均能加速金屬硫化礦的氧化,該微生物氧化速率比化學氧化速率高30—300倍(Nordstrom et al.,2018)。AMD酸度沿水流方向逐漸衰減,水體中的 Fe3+和 SO42?在該衰減過程中極易發生再沉淀,形成多種鐵硫次生礦物。此過程消耗了水體中部分O2和H+,致使AMD水體出現局部相對厭氧和中性環境,為Citrobactersp.、Geobacter、Acidiphilium、Desulfovibrio、Thiomonas和Halethiobacillus等IRB和SRB的生長、代謝創造了生存條件(Garcia-Rios et al.,2021;汪涵,2018;姜夢戈,2020)。這些次生礦物的穩定性差,而Fe-S功能微生物群的存在使得AMD中的次生礦物極易發生礦相轉變,形成結晶度更高的赤鐵礦、針鐵礦等(Bao et al.,2018)。此外,在AMD生物修復過程中,鐵氧化菌可充分將 Fe2+及其他重金屬元素氧化,進而通過吸附、沉淀去除AMD系統中的金屬元素;在外源有機物支持下,AMD水體SRB可高效還原SO42?,促進金屬硫化物沉淀從而凈化 AMD(方迪等,2010);同時,該過程產生的堿度(HCO3?)可提高處理水體 pH(Senko et al.,2009;Deng et al.,2016;Singh et al.,2022;方迪等,2010)。
近些年來,研究人員對硫化礦的地球化學和微生物學進行了大量研究,以了解AMD生態系統中微生物群落和功能多樣性的形成機制(Moreau et al.,2010;Giloteaux et al.,2013;Méndez-García et al.,2015;Quatrini et al.,2018;Sun et al.,2020a;Qian et al.,2021)。研究表明,影響AMD污染梯田微生物多樣性和相互作用的主要環境因子是pH、Fe(Ⅲ)和硫酸鹽(Xu et al.,2020)。在受AMD長期影響的水體中,鐵和硫代謝微生物占主導地位,是介導硫酸鹽礦物轉化的功能微生物(Bao et al.,2018),同時不同的嗜酸性微生物群在極端酸性環境中占據不同的生態位,進而通過對鐵和硫的代謝作用反作用于酸性環境(Xin et al.,2021)。例如,β-Proteobacteria中的Ferrovum在AMD環境中具有重要的生物地球化學循環作用,主要是促進鐵的快速氧化(Hallberg et al.,2006;Havig et al.,2017),常與異養嗜酸菌或其他鐵氧化菌共存(Kipry et al.,2013);Leptospirillum也可能參與金屬和硫代謝,一般認為其為攜帶異化硫酸鹽還原基因的鐵氧化菌(Goltsman et al.,2009)。特定AMD系統的不同位點中總S和 SO42?含量的顯著變化可能導致硫代謝微生物群落和功能的差異。隨著 SO42?濃度的降低,與S循環有關的功能基因dsrAB和aprAB的豐度也相應降低,表明較高的 SO42?濃度可能促使硫酸鹽發生生物還原反應(Sun et al.,2020a)。總Fe和 Fe(Ⅲ)均與 S氧化、SO42?還原顯著相關,表明鐵代謝相關微生物對S的地球化學循環具有影響(Valente et al.,2008;Chen et al.,2014;Liu et al.,2014;Sun et al.,2020a;Pan et al.,2021)。
綜上所述,AMD系統Fe-S生物地球化學梯度對微生物群落結構和功能具有顯著的影響,而鐵和硫的相關微生物種群對環境梯度變化的響應又驅動Fe-S生物地球化學循環。
4 微生物對AMD生物成礦的控制機制
4.1 礦物在AMD系統中的演變特征及環境效應
AMD環境中礦物的種類、賦存狀態、理化性質決定了其污染潛力和環境危害性(Gomes et al.,2006;Valente et al.,2009),其性能由其所處環境的地球化學條件決定(Valente et al.,2013;Meng et al.,2014),如離子濃度、酸度、水含氧量等。微生物介導了AMD硫化礦物溶解(McGuire et al.,2001),同時,原生礦物再沉淀形成次生礦物的過程也與微生物作用密切相關(Clarke et al.,1997;Sanchez-Espana et al.,2011;Caraballo et al.,2019)。鐵元素廣泛存在于金屬硫化礦中,因此鐵氧化物礦物是最普遍的次生礦物,主要包括赤鐵礦、施氏礦物、黃鉀鐵礬和針鐵礦等。這些次生礦物具有巨大的比表面積、豐富的表面官能團、較強的吸附能力和良好的沉淀作用,可在不同pH條件下吸附、絡合、共沉淀AMD系統中的金屬元素,實現水體自凈(Burgos et al.,2012;Ayora et al.,2016;Baleeiro et al.,2018;Zhang et al.,2021;周立祥,2008)。
近年來,對AMD系統鐵相次生礦物的類型、特征、形成條件和環境響應等方面進行了大量研究,發現IRB和SRB都能介導施氏錳礦石和黃鉀鐵礬的轉化(Senko et al.,2009;Coggon et al.,2012;Carbone et al.,2013),微生物活性是驅動AMD河流沉積物中施氏礦物、黃鉀鐵礬轉化為針鐵礦的主要作用力(Bao et al.,2018),針鐵礦的沉淀和相變過程在控制AMD有毒微量金屬的環境化學行為中發揮著重要作用(Jiang et al.,2013;Kim et al.,2014;Baleeiro et al.,2018;Hajji et al.,2019;Kim et al.,2021)。然而,在多變的地球化學條件下,某些相變是可逆的,如施氏礦物可能轉化為針鐵礦或黃鉀鐵礬,黃鉀鐵礬可能被針鐵礦或施氏礦物取代(Samborska et al.,2013)。若環境中缺乏足夠的鉀,則可能形成黃銨鐵礬或草黃鐵礬等;若環境中含有較多的 PO43?,可能形成紅磷鐵礦等磷酸鹽礦物(Lu et al.,2019)。pH<3時,富含Na+、K+、NH4+等一價陽離子的 AMD,在微生物誘導下容易形成黃鐵礬類礦物;當AMD中一價陽離子濃度較低時,則易形成施氏礦物(Zhu et al.,2012;Vithana et al.,2015;周立祥,2008)。微生物促使 AMD鐵硫次生礦物發生礦相轉變的第一步是Fe(Ⅲ)的還原(Bao et al.,2018),在pH較高和相對厭氧環境中,IRB和SRB直接將次生礦物中的Fe(Ⅲ)還原為 Fe(Ⅱ)(Jones et al.,2006;Ouyang et al.,2014)。第二步是穩定相礦物的形成(Ouyang et al.,2014),微生物還原產生的Fe(Ⅱ)極易被吸附在不穩定相礦物表面,在厭氧條件下與礦物中的Fe(Ⅲ)發生電子轉移,從而催化針鐵礦的形成(Burton et al.,2007)。
微生物作用類型及環境化學微環境決定了生物成礦的終點物質的類型、形態和性質(Rodriguez-Navarro et al.,2007;Baumgartner et al.,2013;Hasiotis et al.,2019),同時,MMI驅動了AMD礦物的演變過程、相變平衡及金屬元素賦存形態的動態變化,對AMD污染水體凈化具有重要作用(Liu et al.,2018;Lu et al.,2021;劉奇緣等,2017)。
4.2 AMD微生物-礦物相互作用機制
AMD微生物成礦作用是生物和非生物反應相互作用的結果(Melton et al.,2014)。AMD系統元素地球化學行為受次生礦物的反應(如氫氧化鐵的溶解)的強烈控制(Elghali et al.,2021),而微生物可以通過直接或間接氧化還原反應參與 AMD鐵生物地球化學循環(Melton et al.,2014)。大部分可溶性Fe(Ⅱ)和Fe(Ⅲ)與溶解有機物絡合充當電子穿梭體極大地促進了微生物鐵循環,加速了微生物介導的整個氧化還原過程(Kügler et al.,2019)。
目前的共識是鐵氧化微生物在無氧和微氧環境中通過鐵氧化過程獲取能量,分泌帶狀胞外有機物(生物大分子)作為“模板”,調控礦物的生長(Banfield et al.,2000;Chan et al.,2011;徐軼群等,2013)。這些有機物主要是由一些含有高比例酸性氨基酸(特別是天冬氨酸)和磷酸化酶組分的蛋白質、多糖和糖蛋白組成的大分子群,能有序調節參與形成生物礦物所必需的組分。微生物細胞通過細胞膜主動泵吸胞內陽離子或通過胞內囊泡富集陽離子,然后將陽離子運輸至“模板”的某個區域,構成“就地”成礦點,在特定酶的催化下連續不斷地進行礦化作用,導致AMD局部環境中的pH-Eh發生變化(Elghali et al.,2021;Lee et al.,2022;賈蓉芬等,2009)。鐵還原菌在厭氧環境中與Fe(Ⅲ)礦物接觸時,通過菌毛等特殊結構直接將自身代謝產生的帶有特殊官能團(?SH、?OH、?NH2、?COO等)的生物大分子傳遞至礦物表面,或將由胞內外的有機基質產生的電子梭傳遞至礦物表面,從而還原 Fe(Ⅲ)礦物,Fe(Ⅱ)又在礦物表面與 Fe(Ⅲ)發生電子轉移,催化穩定相鐵礦物的合成(Burton et al.,2007;Luef et al.,2013)。
在微生物成礦過程中,一方面,生物大分子攜帶的特殊功能團的鍵能決定了礦化產物的類型,另一方面,生物大分子的結構決定了礦物成核的位置和形態(賈蓉芬等,2009),特定晶型的出現遵循能量最小化原則,即有機物調控下生長的礦物晶體消耗生物體最少的能量(Pacella et al.,2018)。微生物-礦物結構是一個高度動態的系統(Lower et al.,2001;Shi et al.,2016),在此復雜系統中,微生物細胞-有機質-礦物三者之間相互作用、相互影響,導致產生復雜的環境-生物地球化學過程異質性(Benzerara et al.,2011;Zhu et al.,2015b)。
由上可知,含鐵礦物質的形成受微生物群落結構、功能和代謝作用及環境化學條件共同控制(Johannessen et al.,2017),且生物礦化中的生物質礦物形態受分子模板、礦物-微生物界面性質等因素的影響(Gilbert et al.,2005)。微生物膜與礦物界面是一個化學梯度大、反應活性分子集中、氧化還原作用活躍的微觀界面,是礦物發生表面侵蝕和氧化分解的活躍界面(Mielke et al.,2003;Zhu et al.,2014)。通過挖掘礦物-微生物界面表面微觀結構、組成、形態和功能的演變,可以得到相關的微觀表型性狀,該性狀可由礦物和微生物胞外聚合物(Extracellular Polymeric Substances,EPS)的表面性質定義(Zhang et al.,2014;Hao et al.,2016)。由 EPS介導的細胞和礦物之間的接觸促進了礦物的溶解,為礦物的化學行為提供了反應空間(Sand et al.,2006)。其中,表面反應控制是AMD微生物-礦物相互作用的關鍵機制(Su et al.,2020;Xia et al.,2020),而接觸機制則是礦物發生微生物氧化的主導機制(陸現彩等,2019)。首先,細胞粘附礦物表面,形成 AMD生物膜雛形(Zhu et al.,2015a;Li et al.,2016);其次,嗜酸性微生物(如Ferroplasmaspp.)在酸性環境中分泌的大量膜脂(Macalady et al.,2004)極大地促進了生物膜的形成,微生物得以快速繁衍;最后,隨著時間的推移,細菌胞體在與其接觸的礦物表面覆蓋了一層致密的生物膜,通過多層吸附實現其與礦物之間的表面相互作用,直至將礦物侵蝕(Su et al.,2020)。
此外,AMD礦物的微生物還原遵循電化學過程,胞外電子傳遞(Extracellular Electron Transfer,EET)是該作用過程的一個關鍵步驟(Lovley,2008;Rozendal et al.,2008;Ni et al.,2018)。這是由于 EET過程是微生物胞外呼吸作用的重要組成部分,影響著AMD環境中的物質轉變和能量交換;而胞外呼吸又是微生物的主要能量代謝方式,是微生物與胞外受體間進行電子傳遞的主要方式(陳丹丹等,2017;張多瑞等,2018)。具體表現為內層生物膜上的微生物通過鞭毛(如Geobacter sulfurreducens的Ⅳ型鞭毛是一種納米導線)搭建導電網格,形成多級電子躍遷機制,而外層細胞膜上豐富的 c-型細胞色素直接與礦物表面接觸,進行直接電子傳遞(Malvankar et al.,2014)。值得注意的是,含鐵礦物是AMD系統微生物胞外呼吸最重要的電子受體之一(張玉龍等,2021),微生物鐵呼吸過程伴隨大量 H+的消耗,改變了AMD系統碳、氮、硫元素循環,同時耦合多種重金屬的遷移轉化,從而改變微生物的生長與競爭關系,導致AMD系統微生物群落、功能和代謝等的演化。
5 結論與展望
預測AMD微生物群落組成和功能性狀隨環境變化的動態過程是AMD系統生態學研究的一個重要目標,目前仍是一個重大挑戰。微生物組學研究獲得的微生物群落結構、功能、代謝等信息為在系統水平上理解AMD微生物生態學的時空演變提供了豐富的科學證據。AMD微生物群落組成和功能性狀在不同時空尺度和地球化學梯度上的演替特征研究將有助于闡明微生物群落及其生態功能對極端酸性環境變化的響應,有助于揭示優勢物種和稀有物種在 AMD生物處理中的生態作用。AMD極端環境中的微生物多樣性模式與Fe-S生物地球化學循環過程緊密聯系,微生物群落功能控制AMD金屬離子的生物地球化學過程,同時微生物群落與地球化學條件的相互作用驅動了其自身的生態適應性進化。未來仍可通過整合微生物組學技術探索AMD微生物組對極端環境脅迫的響應機制及其對AMD生物成礦的控制機制,為AMD生物處理系統的優化和維護提供進一步指導。
雖然目前研究人員已掌握了AMD微生物成礦的基本過程,但是其微生物-礦物相互作用的具體機制尚不明確,尤其在不同的AMD環境化學梯度下,微生物-礦物互作關系如何演化,主導其演化的基因如何編碼Fe轉運蛋白、細胞色素、細菌鞭毛等的機制研究匱乏。現代環境分析顯微鏡技術被廣泛應用于生物質礦物的高分辨率結構和組成分析,可直觀呈現微生物-礦物聚合體的微觀晶體化學特征(Mann,1987;McLaren,1991)。光譜學分析可以表征微生物介導的生物質礦物晶型轉變(Geesey et al.,2002)、界面電子轉移(Williams et al.,2004)以及光譜誘導礦物極化特征(Zhang et al.,2012)等。此外,大型同步輻射科學設備和超級計算中心的發展(Xia et al.,2020),為AMD微生物-礦物聚合體的表型組學研究提供了技術支撐。未來可通過整合微生物組學方法和礦物學分析技術(XPS、FTIR、FIB-SEM、TEM、XRD等),系統地探索AMD不同環境地球化學條件下的微生物組-礦物組的表型關系,從而揭示生命和礦物在極端酸性環境中協同演化的微觀機制。

