新教材DNA片段的擴增及電泳鑒定實驗的問題探討
盧燕梅



摘 要 探討2019年人教版高中生物學教材《選擇性必修3.生物技術與工程》“DNA片段的擴增及電泳鑒定”探究實驗中的引物設計、退火溫度估算、延伸時間計算、電泳介質選擇、緩沖液作用等內容。
關鍵詞 PCR 電泳 生物學教學
中圖分類號Q-49
文獻標志碼E
2019年人教版高中生物學教材《選擇性必修3.生物技術與工程》(以下簡稱“新教材”)中的“DNA片段的擴增及電泳鑒定”探究實驗在老版教材(2007年版)的基礎上增加了PCR實驗及電泳鑒定的方法等步驟。由于高中一線教師和學生很少能有實際操作的機會,且對實驗過程中的具體細節及對應原理了解有限,因此在教學及學習過程中存在各式各樣的疑惑。下文將結合文獻資料和實驗經驗,對該實驗中常見的問題進行剖析。
1 設計引物的原則
特異性引物的設計理論上應依據目的基因兩端的己知堿基序列,遵循堿基互補配對原則進行。但實際應用過程中,DNA的部分區域是不能進行引物設計的。在科研過程中,研究者經常利用親緣關系較近的生物的保守序列設計引物,擴增未知序列。因此,實際操作中設計的引物不能夠與模板完全配對。有效引物的獲得應遵循以下原則:
①應與同一基因組中其他核酸序列無明顯相似。
②引物長度一般設計在20-25 bp。以引物長度為20 bp為例,420 ≈1.099 5xl0 12,己遠大于哺乳動物單倍體基因組3x109 bp,因此可防止引物的隨機結合。
③(G+C)堿基含量占比40%-60%為宜。(G+C)堿基含量會影響退火溫度,最終影響實驗結果。同時,應避免出現相同堿基多次連續排列。
④引物本身避免出現發夾結構(避免4 bp以上的回文序列)以及兩條引物間形成較長的互補配對情況。若是引物間3’端反向互補,則會增大引物二聚體的形成概率,降低特異性擴增的效率。
⑤引物3’端的末尾堿基需完全與目標序列配對,否則易導致退火失敗。
⑥引物的3’端的堿基最好設計成T或G。因為Taq DNA聚合酶(以下簡稱Taq酶)對T或G比對C或A的識別度(親和性)更高。
⑦引物中帶有合適的酶切位點。有些擴增出的目的基因后續要進行酶切分析或連接到載體上。
通常實驗室的引物設計借助引物設計軟件進行,如Primer Premier (6.0版)、Oligo 7、NCBI的primerBlast,可按照實驗者需求進行設計。
2 估算退火溫度的方式
退火溫度的設定是影響PCR是否成功的重要因素之一。新老教材的PCR實驗過程將退火溫度均設置為55℃,使得眾多教師與學生誤認為退火溫度只能是55℃。由于反應體系中引物濃度遠高于模板濃度,且模板DNA遠比引物復雜,因此退火過程是由引物驅動的。針對不同的引物,退火溫度要依據其長度、堿基組成等條件來設定。一般情況下,可借助以下公式預判退火溫度:Tm=4(G+C)+2(A+T)(其中Tm即解鏈溫度,是指在此溫度下DNA雙螺旋結構解鏈一半)。為保證引物和模板的有效結合,退火溫度需低于計算出的Tm值,一般情況下退火溫度為Tm - 5℃因此,若退火溫度設置過高,則引物與模板鏈不易結合,導致實驗無法獲得特異性產物或特異性產物量過低;若溫度過低,則又會增加引物與模板非目的片段隨機結合概率,而獲得非特異性產物。
3 計算延伸時間的規律
延伸溫度取決于使用的Taq酶的最適溫度,一般為70-75℃,通常設定為72℃。實際實驗的延伸時間需參考設定延伸溫度下Taq酶活性和目的片段的長度。目前,眾多實驗室使用的Taq酶在72C下堿基延伸速率可達到1 kb/min。因此,當擴增大小1 kb及以內的DNA片段時可延伸1 min;當擴增大小2 kb及以內的DNA片段時延伸2 min,以此類推。而當擴增片段小于150 bp,則可省略延伸步驟,因為在退火溫度下的Taq酶活性己足以完成目的序列的延伸。通常在最后一輪循環完成后,實驗應將反應體系在72C下保溫5 min,以保證所有片段的延伸完成。
4 選用瓊脂糖的原因
瓊脂糖(圖1)是由D-吡喃半乳糖和3,6-脫水一L-吡喃半乳糖兩個單位交替組成的線性多糖聚合物。D-半乳糖單位以B取向與3,6-脫水-L-半乳糖單位的C4位相連,后一單位以α取向與D-半乳糖單位C3位相連。瓊脂糖因不含負電荷的硫酸根和羧基,在電泳過程中不會吸附離子,因此是電泳實驗的良好介質。因瓊脂糖對DNA片段的分辨能力由其濃度決定,在實際操作中要注意對瓊脂糖濃度的選擇。瓊脂糖凝膠分辨DNA片段的范圍為0.2-50 kb,凝膠濃度的高低會影響最終形成膠體的孔隙大小,濃度越低,孔隙越大,其分辨能力就越弱;反之則孔隙減小,分辨力增強(表1)。
電泳實驗使用的瓊脂糖與微生物實驗中制備培養基的瓊脂同樣具有凝固作用,二者是否為同一物質在不同實驗中的表述?對瓊脂進行化學分析,可分離出瓊脂糖和瓊脂膠兩個組分。瓊脂糖是瓊脂的主要組分,而瓊脂膠又是瓊脂糖的衍生物,是由丙酮酸基、甲氧基、硫酸基等不同程度地取代瓊脂糖上的羥基的產物,如3-D-半乳糖殘基C6被硫酸酯化(圖2)。因此,二者并不是同一種物質。而正因瓊脂帶有電荷,不如瓊脂糖適合作為電泳介質。
5 添加緩沖液的目的
5.1 擴增緩沖液
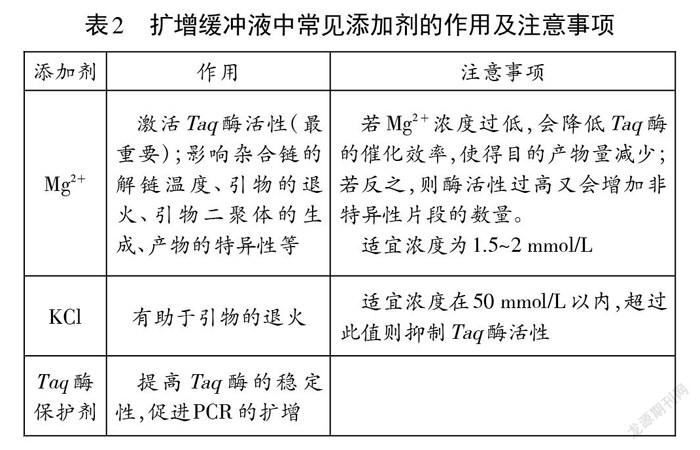
擴增緩沖液為PCR反應體系提供所需的pH環境和添加劑。目前最常用的緩沖液是10-50 mmol/L的Tris-HCl,能夠為整個反應體系提供適宜的pH。添加劑包括Mg2+、K+、Cl、Taq酶保護劑等(表2)。擴增緩沖液有不同的濃縮倍數,實際實驗中需要進行稀釋。以10倍濃縮(10X)的擴增緩沖液為例,若整個反應體系總體積為50 uL,則擴增緩沖液只需添加5 uL。
5.2 電泳緩沖液
電泳緩沖液在維系電泳體系pH的同時,因帶有一定的導電能力而影響DNA的遷移速率。實驗室中最常見的DNA電泳緩沖液有TAE與TBE,二者各有優勢,前者可用于做切膠回收實驗,后者可承受更長時間的電泳。實驗室通常一次性配制一定量(常以升為單位)的儲存液,待到使用時將儲存液用超純水稀釋一定倍數即可。以TAE緩沖液為例分析其各成分作用,見表3。
5.3 上樣緩沖液
上樣緩沖液又稱載樣緩沖液,實驗時需將其與待測產物混合。因緩沖液中含有甘油,使得混合物的密度大于電泳緩沖液,點樣時便會沉積在點樣孔的底部。此外,上樣緩沖液因含有溴酚藍和二甲苯氰FF而呈深藍色,可以幫助實驗者觀察DNA所處的位置,防止因電泳時間過長導致DNA跑出凝膠。
參考文獻:
[1]朱圣庚,徐長法.生物化學(下冊)[M].北京:高等教育出版社,2016.
[2]朱圣庚,徐長法.生物化學(上冊)[M].北京:高等教育出版社,2016.
[3]朱玉賢,李毅,鄭曉峰等.現代分子生物學[M].北京:高等教育出版社,2019.
[4]王廷華,劉佳,夏慶杰.PCR理論與技術[M].北京:科學出版社,2013.

