1-辛烯-3-醇對HT22細胞的神經毒性
任麗圓,胡秋輝,劉建輝,謝旻皓,蘇安祥,徐 輝,楊文建
(南京財經大學食品科學與工程學院,江蘇省現代糧食流通與安全協同創新中心,江蘇高校糧油質量安全控制及深加工重點實驗室,江蘇 南京 210023)
天然芳香揮發性化合物擴散至空氣中呈現出獨特的氣味,常用于防御昆蟲和病原的攻擊。近年來食用菌的消費量明顯提升,這與其獨特的風味有很大的聯系。食用菌的特征風味主要由揮發性呈香物質和非揮發性呈味物質組成,八碳類化合物為最主要的揮發性化合物來源,其中1-辛烯-3-醇(又名蘑菇醇)是食用菌的典型風味物質,其含量不同時會呈現出不同的風味,包括蘑菇、泥土、濕木頭的氣味。1-辛烯-3-醇單獨研究時多被當作蚊蟲引誘劑,對于動物大腦神經系統有一定的損傷。有研究表明低劑量(體積分數0.1%)的1-辛烯-3-醇能通過降低多巴胺水平而導致黑腹果蠅的神經元變性,進一步的實驗探究發現蛋白激酶B和應激活化蛋白激酶都可以防止與1-辛烯-3-醇暴露相關的多巴胺活性喪失,且與胱天蛋白酶3(caspase-3)的激活有關;另外當大鼠暴露于0.5 mg/L 1-辛烯-3-醇時,觀察到一氧化氮和其他炎癥標志物水平上調,表明揮發性1-辛烯-3-醇具有一定的神經毒性。急性暴露實驗表明1-辛烯-3-醇能通過刺激眼部、上呼吸道并導致頭痛惡心的癥狀。進一步的細胞實驗表明1-辛烯-3-醇能引起胚胎干細胞及肺癌細胞株的活力下降。但相關神經系統疾病缺乏深入研究,具體的影響機制尚不明確。
隨著生活節奏的加快,越來越多的人患有神經系統疾病,并且患病人群趨于年輕化。目前,關于神經毒性作用機制尚未明確,其可能與細胞凋亡、氧化應激、抑制神經軸生長等有關,其中氧化應激學說方面的研究占有重要地位。腦組織對氧化應激極其敏感,由于大腦代謝需要大量的氧氣,這一耗氧代謝會產生更多的自由基。其中線粒體是產生氧自由基的最主要部位,參與調節細胞氧化還原電位和信號轉導,調控細胞凋亡,甚至導致中樞神經系統疾病發生。另外大量研究表明,神經系統和免疫系統緊密相連,中樞神經系統中存在特有的免疫監管體系,通過炎癥反應的發生來應對各種的大腦損傷。炎癥發生在大腦中會促進急性或慢性大腦疾病的病程發展,且大腦中的神經元會通過調節神經營養因子、細胞因子和蛋白酶的分泌,對抗炎癥的負面影響從而發揮神經保護作用。
基于此,本研究利用細胞計數試劑盒(cell counting kit-8,CCK-8)法檢測不同劑量的1-辛烯-3-醇對小鼠海馬神經元細胞的活力影響,確定合適的劑量并進行后續的研究;觀察細胞形態、腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)基因水平的表達;測定細胞凋亡率、凋亡基因表達水平、活性氧(reactive oxygen species,ROS)水平、超氧化物歧化酶(superoxide dismutase,SOD)活力及丙二醛(malondialdehyde,MDA)含量的變化;測定線粒體膜電位、細胞色素c氧化酶(cytochrome c oxidase,COX)質量濃度;測定炎癥因子腫瘤壞死因子(tumor necrosis factor,TNF)-α和白細胞介素(interleukin,IL)-6的mRNA相對表達水平,以探究其影響神經功能的途徑,以期為1-辛烯-3-醇的神經毒性研究提供理論依據。
1 材料與方法
1.1 材料與試劑
1-辛烯-3-醇(純度98%) 北京索萊寶科技有限公司;小鼠海馬神經元細胞系HT22細胞 湖南豐暉生物科技有限公司。
胎牛血清、Dulbecco’s改良Eagle培養基(Dulbecco’s modified eagle medium,DMEM)高糖培養基、胰蛋白酶(質量分數0.25%)、青鏈霉素 美國Gibco公司;二甲基亞砜(dimethyl sulfoxide,DMSO)、磷酸鹽緩沖液(phosphate buffered saline,PBS)(1 mol/L、pH 7.2~7.4) 北京索萊寶科技有限公司;CCK-8試劑盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白濃度測定試劑盒(增強型)、裂解液、SOD活力測定試劑盒、MDA含量測定試劑盒、細胞凋亡檢測試劑盒、ROS相對含量測定試劑盒、線粒體膜電位(mitochondrial membrane potential,MMP)檢測試劑盒 上海碧云天生物技術有限公司;RNA提取試劑盒、cDNA逆轉錄試劑盒、熒光定量聚合酶鏈式反應(polymerase chain reaction,PCR)試劑盒 南京諾唯贊生物科技有限公司;小鼠COX測定試劑盒 江蘇酶免實業有限公司。
1.2 儀器與設備
HH-2恒溫水浴鍋 國華電器有限公司;Allegra冷凍離心機 美國Beckman Coulter有限公司;HERACell 240i二氧化碳培養箱、NanoDrop?超微量分光光度計、Tadvanced 96G梯度PCR儀、7500實時熒光定量PCR儀美國Thermo Fisher公司;ELX800多功能酶標儀 美國Molecular Devices公司;XD 30倒置式生物顯微鏡 北京普瑞塞斯儀器有限公司;FACSCalibur流式細胞儀美國Becton Dickinson公司。
1.3 方法
1.3.1 細胞活力測定
1-辛烯-3-醇培養液的配制:先將1-辛烯-3-醇樣品加入DMSO中配制為體積分數為10%的母液,之后使用含10%(體積分數,下同)DMEM的培養液進行梯度稀釋。
細胞傳代:將HT22細胞接種至含6 mL 10% DMEM培養液(含10%(體積分數)胎牛血清和1%(體積分數)青鏈霉素)的25 cm細胞培養瓶中,并置于37 ℃、5% CO細胞培養箱中培養。待細胞鋪滿約80%時進行細胞傳代。吸棄培養液,加入2 mL PBS沖洗2~3 次,然后加入約1 mL質量分數0.25%胰蛋白酶溶液消化,待細胞脫落后加入1 mL培養液以終止消化,將培養瓶中溶液轉移至離心管后以1 000 r/min離心3 min,棄去上清液。然后加入1 mL培養液將細胞重懸,轉移至盛有5 mL新鮮培養液的25 cm細胞培養瓶中,8字法搖晃均勻,置于37 ℃、5% CO細胞培養箱中培養。
采用CCK-8法測定1-辛烯-3-醇對HT22細胞的活力影響。具體操作如下,用10% DMEM培養液將對數生長期的HT22細胞配制成單個細胞懸液,并調整細胞濃度為5×10個/L,按照每孔100 μL接種于96 孔板進行培養,約24 h后吸棄培養液,分別加入100 μL 0(對照,后同)、0.025%(體積分數,后同)、0.050%、0.075%、0.100%、0.125%、0.150% 1-辛烯-3-醇培養液,于37 ℃培養24 h后按照CCK-8試劑盒說明書測定細胞活力,以對照組細胞活力為100%。
1.3.2 細胞形態觀察
將800 μL對數期細胞(濃度為1×10個/ mL)接種于24 孔板中,孵育24 h后棄去培養液,每孔加入800 μL 1-辛烯-3-醇培養液(作用劑量分別為0、0.025%、0.050%、0.075%、0.100%、0.125%)孵育24 h后于顯微鏡下觀察細胞形態,放大倍數為100 倍。
1.3.3 細胞凋亡的檢測
將1.5 mL濃度為2×10個/mL的HT22細胞接種于6 孔板內,37 ℃孵育24 h,之后棄去培養液,按照1.3.2節分組加入1.5 mL的1-辛烯-3-醇培養液孵育24 h。收集上層培養液至離心管中,用PBS(1 mol/L、pH 7.2~7.4)進行清洗并用500 μL質量分數0.25%胰蛋白酶溶液消化1~2 min,待細胞消化后加入離心管內的培養液以終止消化,1 000 r/min離心3 min后棄去上清液。加入195 μL Annexin V-異硫氰酸熒光素(fluorescein isothiocyanate,FITC)試劑輕輕重懸細胞,再加入5 μL Annexin V-FITC與10 μL PI試劑混勻。參考文獻[18]進行室溫避光孵育,采用流式細胞儀進行檢測,各組每次分析1×10個細胞,使用FlowJo軟件測定細胞凋亡率。
1.3.4 活性氧相對含量的測定
實驗分組同1.3.2節,參考ROS相對含量測定試劑盒說明書檢測細胞活性氧相對含量。
1.3.5 超氧化物歧化酶活力檢測
實驗分組同1.3.2節,1.5 mL濃度為2×10個/mL的細胞接種于6 孔板,經不同劑量1-辛烯-3-醇培養液孵育24 h,之后棄去培養液加入200 μL裂解液,12 000 r/min離心5 min后取上清液作為待測樣品,并使用BCA法測定蛋白質量濃度,按照SOD試劑盒說明書通過黃嘌呤氧化酶偶聯法測定HT22細胞內SOD活力,單位為U/mg(以蛋白質量計)。
1.3.6 丙二醛含量測定
取1.3.5節收集得到的上清液作為待測樣品,通過硫代巴比妥酸法測定細胞內MDA含量,單位為μmol/mg(以蛋白質量計)。
1.3.7 線粒體膜電位的測定
實驗分組同1.3.2節,參考文獻[22]利用熒光探針JC-1法檢測細胞線粒體膜電位。當線粒體膜電位正常時,JC-1熒光探針可進入線粒體基質中形成聚合物,產生紅色熒光,即Q2區;當線粒體膜電位較低時,JC-1不能進入線粒體基質中,表現為單體形式,產生綠色熒光,即Q3區。用紅、綠熒光強度的比值(Q2/Q3)表征線粒體膜電位,JC-1從紅色熒光到綠色熒光的轉變即表明線粒體膜電位的下降。
1.3.8 細胞色素c氧化酶質量濃度的測定
取1.3.3節收集得到的上清液作為待測樣品,參照試劑盒說明書測定COX質量濃度,單位為ng/L。
1.3.9 BDNF、凋亡、炎癥因子相關基因的相對表達量測定
采用RNA提取試劑盒提取細胞總RNA,后用cDNA逆轉錄試劑盒將其轉錄為cDNA。之后采用聚合酶和SYBR熒光染料,以稀釋后的cDNA為模板擴增目標基因,引物序列見表1。以為內參基因,對照組作為相對定量組,所有PCR數據均采用2相對定量法進行分析,計算BDNF、凋亡、炎癥因子相關基因的相對表達水平,結果表示為相對于對照組的基因表達倍數。

表1 基因引物序列Table 1 Primer sequences used for gene amplification
1.4 數據處理與分析
實驗中各指標進行3 次重復,測定結果以平均值±標準差表示。采用Origin 2019軟件作圖,采用SPSS 21.0軟件進行單因素方差分析,采用Duncan檢驗進行顯著性分析,<0.05表示有顯著性差異。
2 結果與分析
2.1 不同劑量1-辛烯-3-醇對HT22細胞活力的影響
用0、0.025%、0.050%、0.075%、0.100%、0.125%、0.150% 1-辛烯-3-醇培養液處理HT22細胞24 h,測定細胞活力并觀察細胞形態,由此來評價細胞的狀態。實驗結果如圖1所示,與對照組相比,除0.025%劑量下細胞活力無明顯變化,隨著1-辛烯-3-醇劑量的增大,各組細胞活力顯著下降(<0.05),且呈現明顯的劑量依賴性。1-辛烯-3-醇體積分數為0.050%時,細胞活力為(86.68±19.40)%;當樣品體積分數增至0.075%時,細胞活力急劇降至(30.05±9.08)%。由此可見,0.050% 1-辛烯-3-醇處理對神經細胞有明顯的損傷作用。
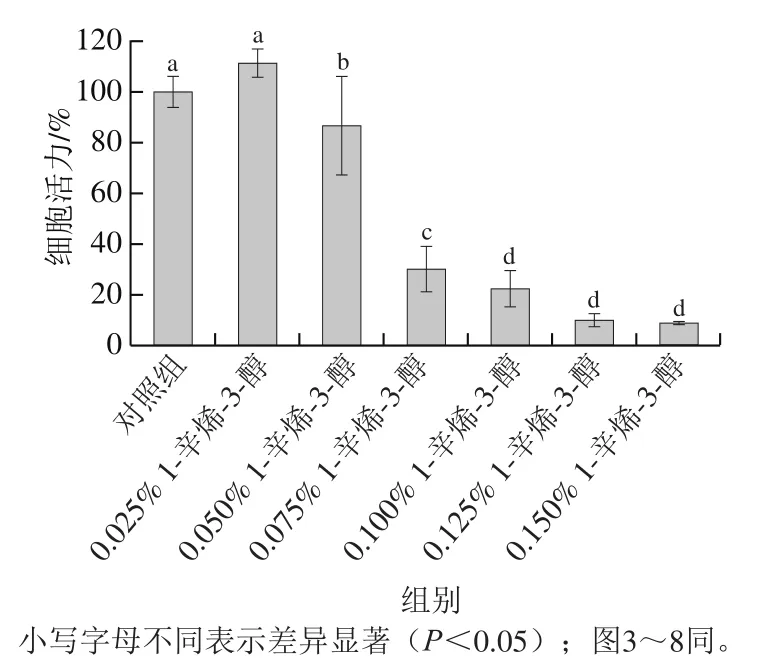
圖1 不同劑量1-辛烯-3-醇處理24 h條件下 HT22細胞的活力Fig. 1 Effect of different concentrations of 1-octen-3-ol for 24 h on viability of HT22 cells
進一步在顯微鏡下觀察HT22細胞在不同劑量1-辛烯-3-醇作用24 h后的形態及數量變化,結果如圖2所示。對照組細胞形態為星狀形,細胞密度大,有明顯的細胞團簇在一起,表現出明顯的活力狀態。經過1-辛烯-3-醇處理的細胞數量明顯減少,形態偏向于圓形,箭頭指示的細胞表現出明顯的形態變化,典型的星狀形變成圓形,有大量漂浮狀態出現,且出現大片的死細胞。其中0.100%樣品處理組的細胞形態表現明顯,細胞全部呈現出圓形,細胞數量明顯減少,這與上述的CCK-8實驗結果相互印證。

圖2 不同劑量1-辛烯-3-醇處理24 h條件下HT22細胞的形態(100×)Fig. 2 Effect of different concentrations of 1-octen-3-ol for 24 h on morphology of HT22 cells (100 ×)
2.2 不同劑量1-辛烯-3-醇對HT22細胞BDNF的影響
BDNF在神經元的生存、分化、生長和維持中有重要作用,可以影響中樞神經系統的穩定性。2.1節結果表明1-辛烯-3-醇對HT22細胞活力有極大的損傷作用,因此進一步通過測定mRNA相對表達水平來研究其對神經系統的影響。結果如圖3所示,當1-辛烯-3-醇處理劑量高于0.025%時,隨著1-辛烯-3-醇劑量的增加,mRNA相對表達水平呈逐漸下降趨勢,其中0.075%、0.100%、0.125% 1-辛烯-3-醇處理組與對照組有顯著性差異(<0.05),分別為對照組的0.65、0.31、0.08 倍。上述結果表明1-辛烯-3-醇對神經系統穩態有一定的損傷。
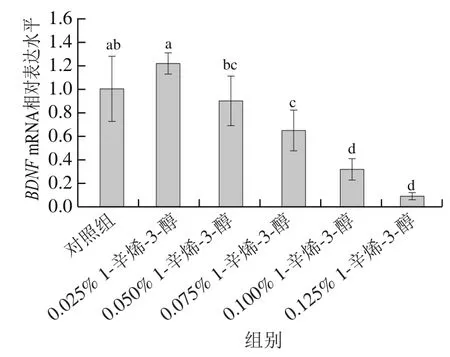
圖3 不同劑量1-辛烯-3-醇處理HT22細胞的BDNF mRNA相對表達水平Fig. 3 Effect of different concentrations of 1-octen-3-ol on relative mRNA expression level of BDNF in HT22 cells
2.3 不同劑量1-辛烯-3-醇對HT22細胞凋亡的影響
細胞凋亡是指由基因控制的細胞為穩定內環境穩態而主動死亡的過程。如圖4A、B所示,隨著1-辛烯-3-醇劑量的增加,細胞凋亡率呈明顯上升趨勢,各劑量樣品處理組與對照組均表現出顯著性差異(<0.05),其中0.075%和0.100%處理組的細胞凋亡率分別達到了(45.26±5.79)%、(64.09±8.81)%,由此可以推測,當1-辛烯-3-醇劑量在0.075%~0.100%時,便導致細胞凋亡率達到50%。這些結果表明,1-辛烯-3-醇處理可以顯著誘導HT22細胞凋亡,且呈現出明顯的劑量依賴性,表明1-辛烯-3-醇觸發了HT22細胞凋亡從而導致細胞活力下降。
基因能夠抑制細胞的凋亡,而有拮抗基因抑制細胞凋亡的作用,兩者能夠在細胞凋亡中起關鍵作用,因此進一步在mRNA水平探索1-辛烯-3-醇的抗細胞凋亡機制。如圖4C所示,當1-辛烯-3-醇處理劑量高于0.025%時,/的mRNA相對表達水平呈上升趨勢,其中0.100% 1-辛烯-3-醇處理組與對照組有顯著性差異(<0.05),為對照組的1.4 倍。這些結果表明,1-辛烯-3-醇的細胞凋亡作用與促進Bax/Bcl-2通路激活有關。

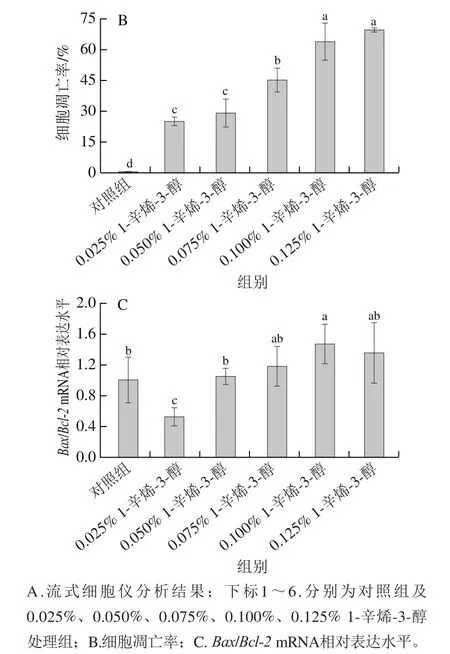
圖4 不同劑量1-辛烯-3-醇處理HT22細胞的凋亡情況Fig. 4 Effect of different concentrations of 1-octen-3-ol on apoptosis rate of HT22 cells
2.4 不同劑量1-辛烯-3-醇對HT22細胞內ROS相對含量的影響
有研究顯示ROS與細胞增殖密切相關,而且當ROS水平過高時會誘導細胞發生氧化應激反應,從而造成氧化損傷,因此檢測細胞內ROS水平可以反映生物體氧化損傷的強度。結果如圖5所示,劑量高于0.025%的1-辛烯-3-醇處理能夠增加ROS的相對含量,且呈現劑量依賴性,其中0.100%和0.125% 1-辛烯-3-醇處理組與對照組有顯著性差異(<0.05),分別為對照組的1.9、2.5 倍。上述結果表明1-辛烯-3-醇處理能夠增加ROS相對含量。

圖5 不同劑量1-辛烯-3-醇處理HT22細胞的ROS相對含量Fig. 5 Effect of different concentrations of 1-octen-3-ol on ROS levels in HT22 cells
2.5 不同劑量1-辛烯-3-醇對HT22細胞內SOD活力、MDA含量的影響
作為抗氧化系統中的重要組成部分,SOD活力通常被用于評價抗氧化活性。由圖6A可知,0.075%、0.100%和0.125%處理組SOD活力顯著高于對照組(<0.05),分別為對照組的1.2、1.5、1.7 倍。MDA是脂質氧化的終產物之一,其含量主要反映細胞過氧化的程度,也間接反映細胞的損傷程度。如圖6B所示,0.075%、0.100%和0.125%處理組MDA的含量顯著性高于對照組(<0.05),分別為對照組的1.8、1.9、2.2 倍。上述結果表明,經過1-辛烯-3-醇處理的HT22細胞SOD活力和MDA含量均得到提高,且呈現一定的劑量依賴性。
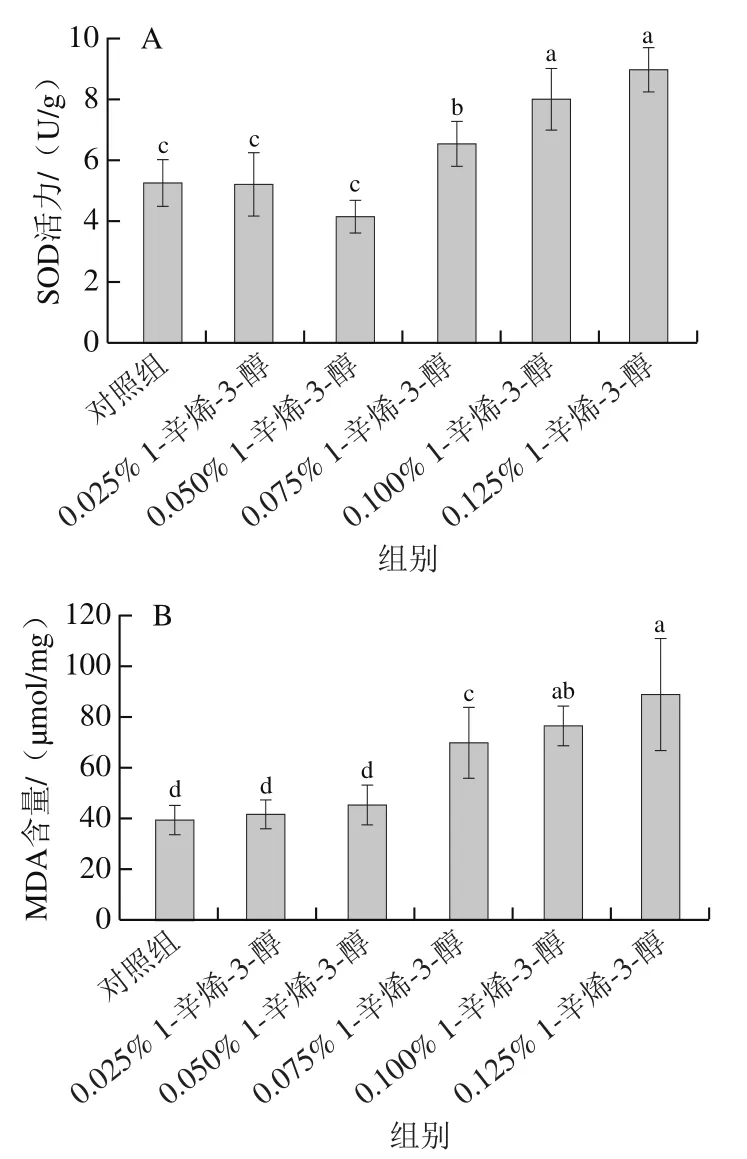
圖6 不同劑量1-辛烯-3-醇處理HT22細胞的SOD活力(A)和MDA含量(B)Fig. 6 Effect of different concentrations of 1-octen-3-ol on SOD activity (A)and MDA content (B) in HT22 cells
2.6 不同劑量1-辛烯-3-醇對HT22細胞能量代謝的影響
線粒體在細胞凋亡中發揮著中央調控的作用,線粒體膜電位是指線粒體呼吸鏈質子跨膜過程中內膜兩側離子濃度不同所產生的電位差,膜電位的喪失被認為是細胞凋亡的早期標志之一。本研究以JC-1染色分析1-辛烯-3-醇對HT22細胞的線粒體膜電位的影響,結果如圖7A、B所示。當劑量高于0.025%時,線粒體膜電位開始逐漸下降,且呈現出一定的劑量依賴性,其中0.100%和0.125%處理組的線粒體膜電位分別為對照組的55%和49%,與對照組有顯著差異(<0.05)。這些結果表明1-辛烯-3-醇誘導的細胞凋亡可能是線粒體膜通透性增強導致的。
線粒體呼吸鏈是線粒體能量轉化的核心與基礎,由4個跨膜蛋白復合體(呼吸鏈膜蛋白復合體I、II、III、IV)、泛醌以及細胞色素c組成,本研究選擇COX的質量濃度作為特異性指標來反映線粒體呼吸作用的變化。COX質量濃度結果如圖7C所示,與對照組相比,0.050%、0.075%、0.100%和0.125%處理組COX質量濃度顯著上升(<0.05),且有一定的劑量依賴性,分別為對照組的2.0、2.2、2.8、3.0 倍。以上結果表明1-辛烯-3-醇的暴露會影響COX的分泌進而影響線粒體呼吸作用。

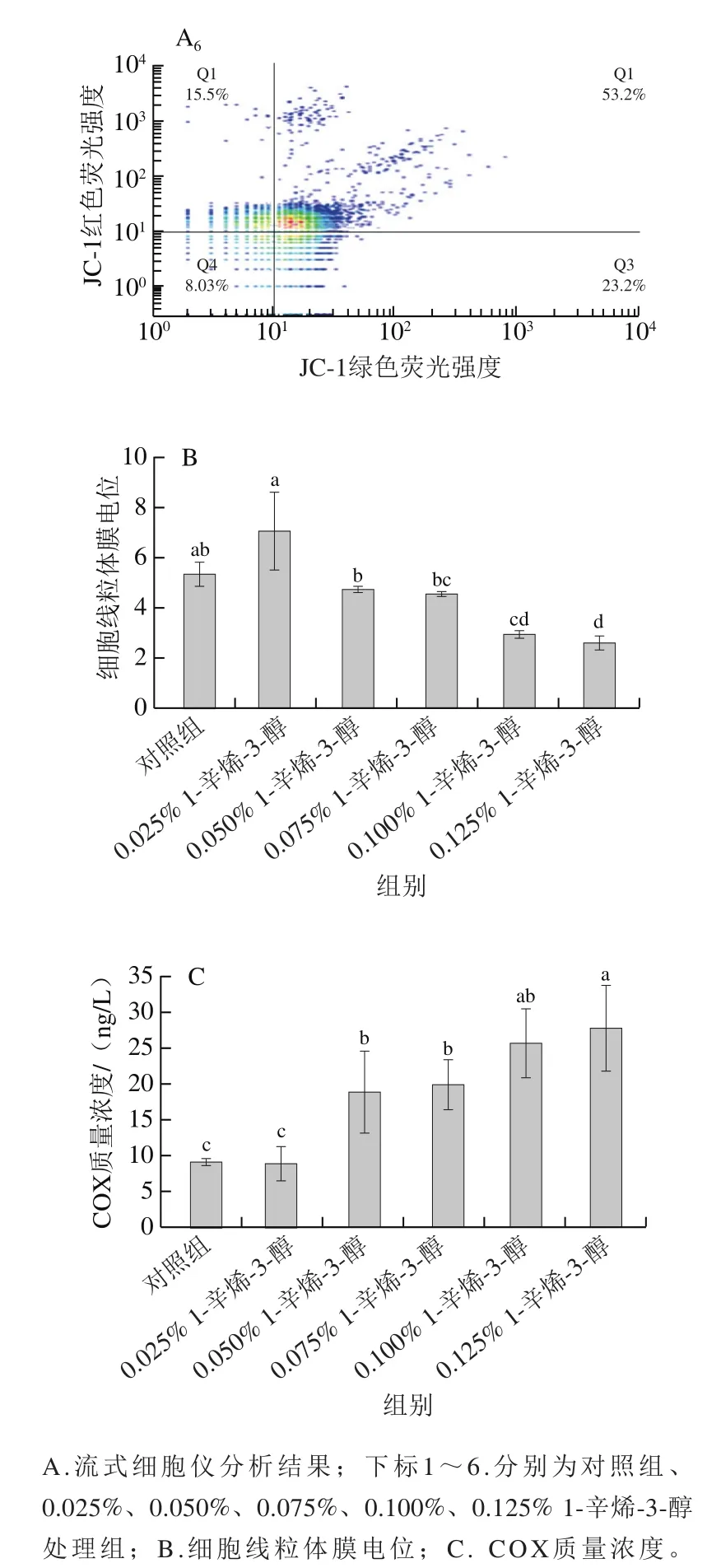
圖7 不同劑量1-辛烯-3-醇處理對HT22細胞能量代謝的影響Fig. 7 Effect of different concentrations of 1-octen-3-ol on energy metabolism of HT22 cells
2.7 不同劑量1-辛烯-3-醇處理對炎癥因子TNF-α和IL-6 mRNA相對表達水平的影響
中樞神經系統的穩態與炎癥水平是緊密相連的,因此進一步通過實驗探究1-辛烯-3-醇作用下HT22細胞的炎癥水平變化。TNF-α和IL-6是兩種促炎性細胞因子,當神經炎癥發生時會導致其表達量增加。如圖8所示,隨1-辛烯-3-醇劑量的增加,和mRNA相對表達水平均呈增加趨勢。與對照組相比,0.100%、0.125%1-辛烯-3-醇處理組mRNA相對表達水平顯著增加(<0.05),分別約為對照組的25.9、30.1 倍;與對照組相比,0.075%、0.100%和0.125% 1-辛烯-3-醇處理組mRNA相對表達水平顯著上升(<0.05),分別為對照組的9.6、10.1、14.5 倍。以上結果表明,1-辛烯-3-醇通過提高促炎因子和基因的表達對HT22細胞造成炎癥損傷。

圖8 不同劑量1-辛烯-3-醇處理HT22細胞的TNF-α(A)和IL-6(B)mRNA相對表達水平Fig. 8 Effect of different concentrations of 1-octen-3-ol on relative mRNA expression levels of TNF-α (A) and IL-6 (B)
3 討 論
1-辛烯-3-醇是食用菌的特征揮發性物質,常被用作香料添加劑和蚊蟲引誘劑,研究表明其能夠通過作用于神經系統而對果蠅有損傷作用,而關于細胞方面的神經毒性影響缺少相關的研究,其具體的影響機制尚未明確。
中樞神經系統是神經系統的主要部分,是學習、記憶、語言和思維活動的結構基礎。目前研究表明,持久的氧化應激和長期神經炎性是導致中樞神經系統損傷的主要機制。氧化應激指在機體受到不利刺激時,體內會大量產生活性氧自由基,導致氧化還原系統失衡,造成細胞及組織損傷,這會引起細胞凋亡甚至病理損傷。線粒體是與氧化代謝關系最為密切的細胞器,線粒體的氧化呼吸作用是ROS產生的主要途徑,線粒體氧化呼吸鏈的損傷引起細胞內發生氧化應激反應,從而導致活性氧物質濃度升高,最終導致神經元的死亡,即表明氧化還原失衡時導致線粒體依賴性細胞凋亡。
本研究中高于0.025%的1-辛烯-3-醇作用導致HT22細胞活力顯著降低,表明1-辛烯-3-醇在HT22細胞中具有一定的毒性。BDNF是神經營養因子家族的主要成員,其在中樞神經系統功能調節中具有重要作用,當1-辛烯-3-醇劑量高于0.025%時,HT22細胞的mRNA相對表達水平低于對照組,表明1-辛烯-3-醇的神經損傷作用可能與mRNA表達的下降有關。接下來分析了細胞凋亡情況,結果表明,1-辛烯-3-醇能引起細胞凋亡率和/基因表達升高,其中,Bax和Bcl-2是凋亡途徑的典型控制蛋白,Bax水平的上升和Bcl-2水平的下降可以引起凋亡途徑的激活,推測1-辛烯-3-醇能通過促進/基因表達引起HT22細胞的凋亡。進一步分析1-辛烯-3-醇處理對HT22細胞氧化應激水平的影響,結果表明氧化應激水平得到了一定程度的升高,表現為ROS相對含量、SOD活力和MDA含量增加。這是由于ROS過量產生會導致脂質過氧化產物MDA的升高,而SOD作為抗氧化系統的主要組成,在1-辛烯-3-醇的毒性作用下,HT22細胞為保護機體而刺激SOD活力增加,但細胞活力的下降導致HT22細胞的抗氧化能力難以抵抗氧化損傷,從而使得機體仍維持氧化應激的狀態。本研究進一步驗證了1-辛烯-3-醇通過線粒體損傷誘導HT22細胞凋亡的可能性,1-辛烯-3-醇的作用導致HT22細胞線粒體膜電位的降低以及COX分泌增加,進而誘導的上調和的下調,從而引起凋亡途徑的激活。這與張亞瓊的研究結果一致,其發現丙烯酰胺可能是通過增加細胞內ROS和MDA水平,產生氧化應激損傷,降低線粒體膜電位,上調Bax和下調Bcl-2蛋白的表達,進而誘發HT22細胞的凋亡,誘導HT22細胞神經元損傷。神經炎癥被認為是引發多種神經系統疾病的關鍵,本研究中1-辛烯-3-醇的處理會導致和mRNA表達水平的增加,表明1-辛烯-3-醇介導的神經炎癥與細胞凋亡是共存的。
4 結 論
本實驗研究HT22細胞經過不同劑量1-辛烯-3-醇處理后活力變化及其相關的機制。結果表明,隨著1-辛烯-3-醇劑量的增大,細胞活力明顯降低,細胞呈現明顯的分散形態且神經營養因子表達受到抑制。進一步的實驗結果表明,1-辛烯-3-醇能通過增加ROS相對含量、SOD活力及MDA含量誘導細胞的氧化應激;并通過促進/的基因表達引起細胞凋亡,這可能是通過增加COX的分泌進一步降低線粒體膜電位所引起的;此外,1-辛烯-3-醇通過促進炎癥因子和的分泌誘導炎癥反應。綜上,1-辛烯-3-醇對海馬神經元細胞有明顯的毒性損傷作用,細胞凋亡、氧化應激、能量代謝、炎癥水平這幾個方面為其主要作用途徑,本實驗可為研究1-辛烯-3-醇的神經毒性作用提供理論參考。

