大分子蛋白界面修飾改善乳液特性研究進展
張維義,趙 雪,徐幸蓮
(南京農業大學食品科學與技術學院,肉品加工與質量控制教育部重點實驗室,江蘇高校肉類生產與加工質量安全控制協同創新中心,江蘇 南京 210095)
乳液是指一種液體(分散相)以液滴形式分散在另一種與其不相溶的液體(連續相)中形成的混合分散體系。根據分散相和連續相性質的不同,可將乳液劃分為水包油(O/W)型乳液和油包水(W/O)型乳液,其中O/W型乳液在食品行業中更為常見,如牛奶、蛋黃醬、稀奶油等。在乳液制備過程中,通常需要加入兩親性的乳化劑,使分散相穩定存在于連續相中。作為天然兩親性生物大分子,動/植物源蛋白質是一類高效的乳化劑。蛋白質分子表面既含有非極性的疏水基團,也含有極性的親水基團,因此可以在乳液制備過程中吸附于油-水界面,形成蛋白界面膜(protein interfacial film,PIF),降低界面張力。同時,蛋白質的帶電性質以及空間構象使得形成的PIF能提供有效的靜電斥力和空間位阻效應,進一步阻止油滴的聚集。
由于蛋白質穩定的乳液本身屬于熱不穩定體系,并且PIF對環境(如pH值、離子強度、溫度等)變化十分敏感,因此蛋白質穩定的乳液在貯藏過程中易發生絮凝、聚結、乳析、奧氏熟化等失穩現象,使體系向低自由能方向運動,最終導致兩相分離,乳液穩定性和理化性質隨之下降,進而影響界面介導的食品均一化和標準化,降低了相關產品品質價值。因此,需要采取手段有效提升蛋白質乳液的穩定性并改善其理化特性。
目前使用較為廣泛的提升乳液穩定性的方法是在乳化前對蛋白質進行預修飾,使其結構與分散程度發生變化,進而改善其乳化特性,如添加其他功能性成分(多糖、多酚、酶類等)、氧化修飾(金屬催化的氧化反應、肌紅蛋白催化的氧化反應等)以及采用新型食品加工技術(超聲波、高壓均質、脈沖電場等)。然而,許多經過預修飾的蛋白易形成高分子質量的多分支聚合物,使相互之間的空間位阻作用增強,因此在吸附過程中大量預修飾蛋白分子彼此相互排斥而無法直接與界面相互作用,從而導致界面覆蓋率降低。此外,預修飾蛋白在乳化過程中向油-水界面擴散及吸附的速率會下降,從而可能導致乳化活性降低。因此,蛋白預修飾技術雖然研究深入且應用廣泛,但仍具有一定局限性。與傳統的預修飾法不同,蛋白界面修飾直接作用于乳化后的界面蛋白,通過酶促交聯、多糖接枝、多酚結合等手段修飾界面蛋白結構并改變相鄰界面蛋白交聯程度,從而提高PIF黏彈性以及覆蓋率。經過界面修飾而形成的高機械強度PIF可更有效防止乳液絮凝、聚結等失穩現象的發生,同時可作為保護層進一步抑制油脂氧化,從而改善乳液的理化特性。并且蛋白界面修飾可有效規避上述預修飾法中存在的不利因素,因而作為一種新興技術得到研究者的廣泛關注。現階段,蛋白界面修飾相關研究尚缺乏系統性和完整性的闡釋。基于此,本文集中綜述了目前主要的蛋白界面修飾方法及其對O/W型乳液特性的改善效果,并對蛋白界面修飾領域的未來進行展望,以期為乳液特性的進一步改善提供新的思路。
1 酶促交聯修飾
目前應用于界面蛋白酶促交聯修飾的酶主要有轉谷氨酰胺酶(transglutaminase,TGase)和多酚氧化酶(polyphenol oxidase,PPO),其中后者包括漆酶、酪氨酸酶等。酶促交聯修飾的具體操作方式通常是向乳液中加入適量的酶,隨后在37 ℃條件下振蕩使體系充分反應,通過監測反應時間或體系內氧消耗量從而終止反應,最后將得到的界面修飾乳液在4 ℃條件下靜置20~24 h使體系穩定。該方法穩定性較好,反應過程易控制,因此使用較為廣泛。
1.1 轉谷氨酰胺酶
TGase是一種酰基轉移酶,它可以催化谷氨酰胺(酰基供體)上的-酰胺基團向游離氨基酸(酰基受體)轉移。在蛋白質中,賴氨酸殘基的-氨基通常作為酰基受體,從而形成谷氨酰胺-賴氨酸鍵,使蛋白質發生分子內或分子間共價交聯(圖1),從而對蛋白質的功能特性進行改善。因此,TGase可能主要通過以下方式在乳化后對乳液體系中界面蛋白進行修飾從而改善乳液特性:1)TGase能夠催化同一油滴界面蛋白之間通過共價鍵形成交聯,促進界面蛋白分子有序定向,形成更穩定的PIF;2)促進不同油滴界面上的吸附蛋白、吸附蛋白與未吸附蛋白之間形成共價交聯,增加PIF厚度,改善乳液空間結構均一性。在后者作用下,乳液還可轉化為乳液凝膠,進一步提升了乳液的穩定性。因此TGase在對食品級乳液體系中大分子蛋白進行界面修飾,從而改善乳液的功能特性方面有極大的應用潛力。同時,TGase誘導形成的乳液凝膠也在生產靶向遞送、定點釋放的功能性乳液載體方面得到了應用。
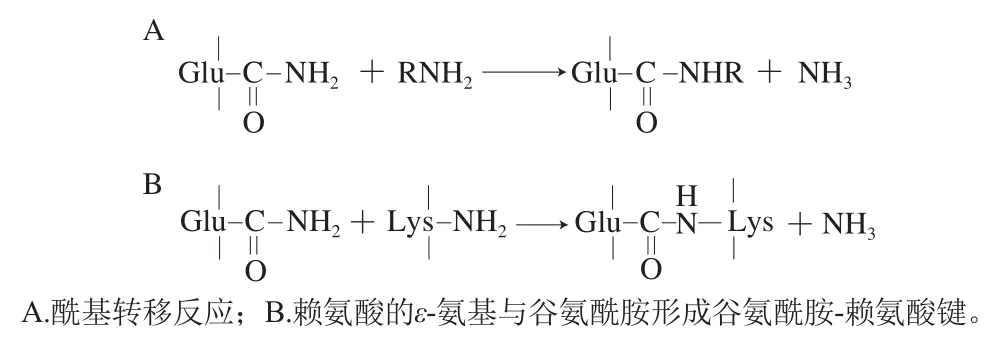
圖1 TGase催化的反應Fig. 1 Reactions catalyzed by transglutaminase
Noriki等于1986年首次發現,酪蛋白、11S大豆蛋白和7S大豆球蛋白穩定的乳液體系與TGase一起孵育時,乳液黏度增加,并將這一現象歸因于油-水界面蛋白分子內和分子間谷氨酰胺-賴氨酸鍵的形成。研究表明,乳化后階段中TGase界面修飾大豆球蛋白/-伴大豆球蛋白乳液后,雖然部分油滴發生了絮凝,但相比于未修飾乳液,界面修飾乳液形成了機械強度更高的PIF,穩定性顯著提升。此外,乳液中油相比例增加時界面區域相應增加,使得TGase能更高效地催化相鄰油滴界面上的蛋白發生共價交聯,形成厚且完整的PIF,從而提升乳液穩定性。Alavi等在乳化后階段利用TGase處理熱變性雞蛋白蛋白(thermal denatured egg white protein,TD-EWP)乳液時發現油-水界面上的TD-EWP在TGase作用下發生了高效的交聯作用,并且這種交聯作用隨著TGase濃度升高而提升,界面修飾顯著提升了乳液的機械特性和流變特性。TGase還可通過修飾界面蛋白提高乳液消化特性,這是由于TGase能夠催化界面乳清分離蛋白(whey protein isolate,WPI)形成共價交聯,防止乳液在模擬胃腸液中出現絮凝和聚結,降低界面蛋白水解程度,從而有利于包埋活性成分的有效釋放。研究人員對界面鷹嘴豆蛋白(chickpea protein,CP)進行修飾時也得出相同的結論,在TGase的共價交聯作用下,胰蛋白酶底物——賴氨酸殘基受共價聚合物保護,避免乳化后界面CP在胰液素中被胰蛋白酶水解,乳液的穩定性與包埋性質顯著提升。綜上所述,乳液體系中的界面蛋白經TGase修飾后,與相鄰界面蛋白或未吸附蛋白形成共價交聯,使得乳液結構更加均一并形成更加穩定的保護膜,改善了乳液的質構特性和功能特性。因此,TGase在蛋白界面修飾領域有著廣泛的應用前景。此外,TGase于1998年被美國食品藥品監督管理局(Food and Drug Administration,FDA)認證為一般安全(generally recognized as safe,GRAS)等級,其介導的蛋白界面修飾反應不會產生有毒副產物或造成營養成分的損失,并且對乳液的風味影響也較小。但是,由于TGase提取及純化的成本較高,因此將TGase介導的蛋白界面修飾應用于大規模商業生產仍有一定難度。
1.2 多酚氧化酶類
1.2.1 漆酶
漆酶是一種主要來源于柑橘類植物、原核生物或真菌的氧化還原酶,其活性位點處含有4個銅原子,可以催化多酚、甲氧基取代苯酚、苯胺等芳香型底物的氧化反應。近年來,漆酶作為蛋白質交聯劑被廣泛應用于蛋白界面修飾領域的研究中。由于蛋白質中的酚類基團并不是漆酶催化反應的最適底物,而有些結構緊密的球狀蛋白如-乳球蛋白(-lactoglobulin,-Lg)吸附在界面時不可直接被漆酶作用,因此通常需要向反應體系中加入酚類介質作為電子傳導載體。在氧作用下,漆酶將酚類底物轉化為初級氧化產物,這種氧化產物是一種不穩定的活性芳香自由基,可以攻擊界面蛋白中的酪氨酸活性殘基,使其與相鄰界面蛋白、未吸附蛋白或酚類介質發生交聯(圖2),從而對蛋白進行界面修飾。
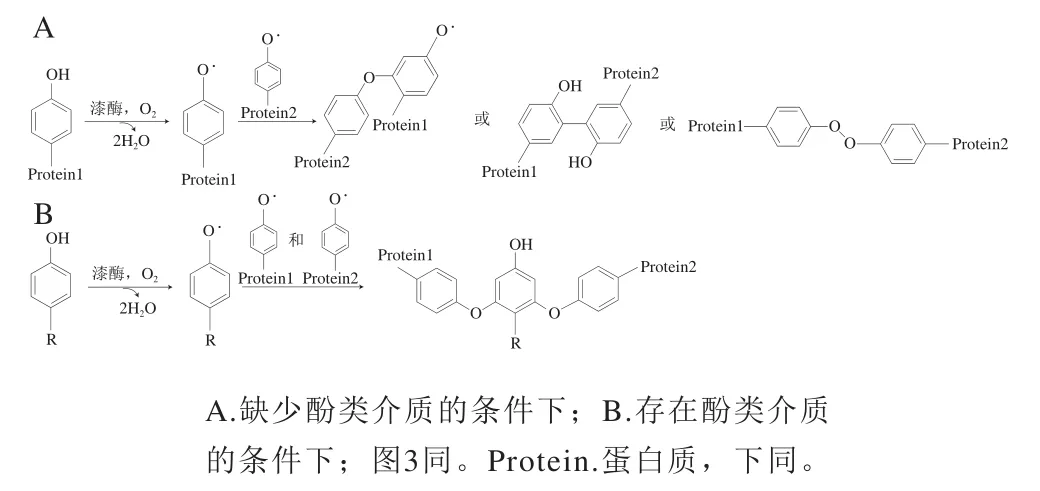
圖2 漆酶催化的蛋白質交聯反應Fig. 2 Crosslinking of proteins catalyzed by laccase
在酚類介質香草酸存在的條件下,乳化后形成的油-水界面WPI在漆酶作用下能夠與連續相中的未吸附蛋白形成共價交聯,使得乳液PIF變厚,提供了更強的空間位阻效應,阻礙了油滴的碰撞和絮凝,從而使整個體系在貯藏期間內始終保持穩定。通過界面修飾改善發酵奶的加工特性,能夠使脂肪液滴界面上的乳蛋白在漆酶作用下由酚類介質香草酸和咖啡酸介導形成共價交聯,使得酸奶的剪切黏彈性增加,這種改善效果隨著酶含量和酚類介質含量的增加而越發明顯。然而,Mokoonlall等發現漆酶處理發酵奶對其黏彈性和儲能模量均沒有顯著改善作用,這可能是因為乳液體系中乳蛋白在交聯前先發生了降解。Zeeb等結合層層靜電自組裝(layer-bylayer,LBL)技術和漆酶酶促交聯法在乳化后階段對明膠穩定的乳液進行界面修飾,首先使果膠(含有阿魏酸,一種酚類介質)通過靜電引力作用自動沉積在乳化后形成的界面明膠上,然后在漆酶作用下使果膠與明膠之間產生共價交聯,這種經過雙重界面修飾的明膠乳液在消化道內具有更高的穩定性,同時可以在小腸內定向釋放包埋的活性物質。Chen Pusen等也證明在甜菜果膠(sugar beet pectin,SBP)存在的條件下,界面修飾乳液的界面張力與Zeta-電位(負值)降低,黏稠度與穩定性增加,這是由于漆酶可誘導界面椰子肉蛋白與界面及連續相SBP產生共價交聯,形成均一的乳液網絡結構,防止油滴上浮而出現分層。因此,漆酶可以誘導界面蛋白交聯而改善乳液理化特性,并且酚類介質可以促進漆酶修飾效果。
利用漆酶對蛋白質進行界面修飾的優點之一是其對環境友好,漆酶誘導的氧化交聯反應以O為電子受體,并且副產物主要為HO,因此不會對環境造成過度污染。此外,漆酶修飾的第二個優點是其作用底物廣泛,如上文所述的香草酸、咖啡酸以及SBP等均可作為酚類底物,在漆酶催化下對界面蛋白進行修飾。但是,漆酶的活性易受pH值以及抑制劑的影響,如漆酶僅在酸性條件下穩定,同時Fe、Ag、Al等離子會抑制漆酶活性,這在一定程度上限制了其在蛋白界面修飾領域的適用范圍。
1.2.2 酪氨酸酶
酪氨酸酶是一類廣泛存在于大自然中的氧化酶,其活性位點處含有一對銅離子。酪氨酸酶的作用底物與漆酶相似,在酪氨酸酶的催化下,酚類物質被空氣中的氧氣氧化為鄰二酚,并進一步形成鄰二醌。活性鄰二醌可以與不同基團(如胺基、酰胺基、巰基)反應,形成分子內或分子間共價交聯。由于蛋白質在吸附過程中發生解折疊,酪氨酸殘基中酚類基團暴露,因此乳化后階段酪氨酸酶可以在不添加酚類介質的條件下直接作用于該位點,通過引入芳烷基、耦合芳氧基自由基或形成雙酪氨酸結構使界面蛋白交聯(圖3),能夠改善PIF強度與乳液空間結構,提升乳液理化特性。同時,由于體系中無需添加酚類介質,可以避免蛋白與酚類介質過度交聯而影響界面吸附或破壞乳液均一性。
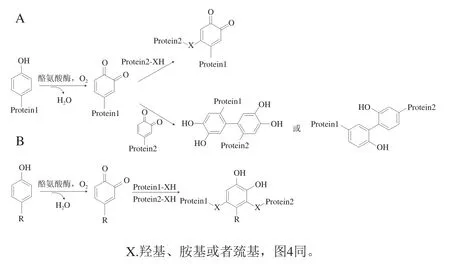
圖3 酪氨酸酶催化的蛋白質交聯反應Fig. 3 Crosslinking of proteins catalyzed by tyrosinase
Isaschar-Ovdat等在不含酚類介質條件下利用酪氨酸酶在乳化后修飾界面大豆球蛋白,發現酪氨酸酶誘導的界面修飾使更多未吸附蛋白與界面蛋白形成共價交聯,從而提升了蛋白界面吸附率,并且界面修飾乳液具有更高的黏性和更低的乳析速率,在48 h的貯藏期間內始終保持穩定,而經過乳化前預修飾的乳液在24 h內即出現了分層的現象。然而,部分研究認為酚類介質可以促進酶類的界面修飾作用,這是由于結構緊密的球狀蛋白在吸附前后結構變化不顯著,因此需要添加酚類介質誘導酶促界面修飾的發生。此外,酶的作用時間也會影響界面修飾乳液的最終品質,Glusac等在乳化后階段利用酪氨酸酶修飾界面馬鈴薯蛋白(potato protein,PP),發現PP穩定的乳液在與酪氨酸酶共同作用1 h內,相鄰油滴表面的PP之間產生共價交聯,使油滴相互靠近,乳液形成了自持型乳液凝膠結構,穩定性提升;但是隨著作用時間的繼續延長,乳液凝膠結構開始崩塌,黏度顯著降低。這表明在合適的作用時間內,酪氨酸酶可以通過對蛋白進行界面修飾而改善乳液理化特性,但作用時間過長會起到相反的效果,因為過度催化會破壞界面PP交聯聚集體和油滴聚集網絡結構,使乳液品質下降。
與漆酶相似,酪氨酸酶介導的蛋白界面修飾不會產生有害環境的化合物;并且其作用底物廣泛,可以誘導多種含酪氨酸殘基的蛋白質在界面上發生交聯,適用范圍較廣。但是,在反應體系存在鄰二醌的條件下,酪氨酸酶催化的界面修飾過程不易控制,易產生單體酚或低聚酚等復合物;并且酪氨酸酶在界面修飾過程中還易產生黑色素,造成乳液褐變,影響乳液的感官品質。
2 多糖修飾
多糖疏水性和黏性較高,具有相對穩定的結構,可通過非共價和共價作用力與界面蛋白相互交聯而改變蛋白結構和功能,因此多糖可應用于大分子蛋白界面修飾領域,改善乳液理化特性。
2.1 非共價交聯修飾
驅動多糖與蛋白之間形成非共價結合的作用力主要有靜電作用力、疏水作用力、氫鍵、范德華力等。目前在對大分子蛋白進行界面修飾方面研究最深入、應用最廣泛的技術是基于靜電作用力的LBL技術。LBL技術是指先使一種帶電乳化劑(如蛋白質)在乳化過程中吸附在乳液界面上作為初級吸附層(primary layer),此時的乳液稱為初級乳液(primary emulsion);然后再在乳液中加入一種與“初級吸附層”乳化劑帶有相反電荷的生物大分子(如多糖),利用兩者之間的靜電吸引作用,使得后者自動沉積在初級吸附層上,形成二級吸附層(secondary layer)與二級乳液(secondary emulsion)。以此類推,還可通過加入第三種帶電生物大分子,形成三級吸附層(tertiary layer),制備三級乳液(tertiary emulsion)。蛋白質是兩性電解質,在環境pH值與自身等電點pI相等的條件下,其分子表面所帶凈電荷為零;在環境pH<pI條件下,其分子表面帶正電荷;而在環境pH>pI條件下,其分子表面帶負電荷。因此,可以通過調整乳液體系pH值,使帶正或負電荷的蛋白質首先在乳化過程中吸附在油-水界面上,形成油滴外第一層保護膜;然后在乳化后體系中加入相反電荷的多糖,利用LBL技術使其通過靜電作用力自動沉積在先前吸附的界面蛋白上,從而形成第二層保護膜,對蛋白進行界面修飾。
目前基于LBL技術制備多糖界面修飾乳液的具體途徑有3種。1)浸潤法:根據經驗值(如以-電勢為判斷依據)向乳液體系中直接加入足量多糖以覆蓋油滴表面的蛋白吸附層。該方法中,加入的多糖量不易控制,易發生橋聯絮凝和損耗絮凝的現象。2)離心法:向乳液體系中加入過量多糖以確保油滴表面蛋白吸附層被浸潤,并通過離心除去連續相中的過量多糖。通過重復上述步驟以提升多糖在界面蛋白層的靜電沉積量。該方法的缺陷是乳液中油滴顆粒可能會在離心力的驅動下發生聚集。3)過濾法:不同于離心法,該方法通過膜過濾以除去連續相中的過量多糖。在該方法中,油滴顆粒不會在外力作用下相互碰撞,因此通過該法制備的界面修飾乳液不易發生絮凝或聚結等現象。
許多研究證實,相比于傳統的單吸附層乳液,多層乳液對不利環境因素有更好的抗性,在長期貯藏期間表現出更高的穩定性,這是因為蛋白-多糖聚合物既可以通過蛋白質表面的疏水基團穩定地錨定在油-水界面上,形成機械強度較高的保護膜,又可以通過多糖所帶的負電荷和各種分支側鏈分別提供的靜電斥力與空間位阻效應,防止油滴的絮凝和聚結。同時,蛋白-多糖復合層的形成增加了油-水界面膜的厚度與密度,從而能更有效地防止油滴在長期貯藏過程中相互碰撞而聚集,并可作為保護屏障抑制乳液體系中促氧化劑與油脂的接觸。此外,多糖與界面蛋白所形成緊密且低流動性的界面網絡結構增加了乳液的界面剪切黏性,提高了界面蛋白膜在外界環境變化條件下的穩定性。
由于自然界中存在的多糖大多是陰離子多糖,因此目前研究多集中于以正電荷蛋白質為初級吸附層,而將陰離子多糖作為二級吸附層與界面蛋白通過靜電作用力相結合,對其進行界面修飾從而改善乳液特性。研究表明,通過LBL技術結合高速剪切作用,利用高甲氧基果膠對乳化后油滴界面上的7S伴大豆球蛋白膜進行修飾,形成的多層乳液體系具有較厚的界面層結構,并表現出較好的長期貯藏穩定性。基于LBL技術利用黃芪膠對WPI進行乳化后界面修飾,發現相比于直接由WPI-黃芪膠穩定的預修飾乳液,前者具有更小的粒徑與更高的表觀黏度。這是因為在乳化前經過預修飾形成的WPI-黃芪膠復合物降低了乳化過程中的超聲效率,同時在超聲波的作用下該復合物易誘導油滴發生橋聯絮凝,使得乳化前預修飾乳液的穩定性降低。在-Lg乳液中,分別以-卡拉膠與明膠相繼對乳化后界面-Lg進行修飾制備二級和三級乳液,結果發現在反復的凍結-解凍過程中,僅三級乳液未發生油滴聚集和乳液分層的現象。這是由于三級乳液油滴外的界面層較厚,抑制了凍結-解凍過程中油滴的絮凝傾向,同時也保護了油滴不被冰晶所破壞。然而,Güzey等利用果膠與殼聚糖相繼對-Lg乳液進行界面修飾時發現,雖然二級乳液(-Lg-果膠)和三級乳液(-Lg-果膠-殼聚糖)相比于初級乳液都能在高溫下有效抑制油滴絮凝和乳液分層,但二級乳液有著更廣泛的熱穩定溫度范圍。這可能是因為三級乳液界面上的果膠-殼聚糖聚合物在高溫下發生了部分脫落,從而被相鄰油滴界面共享而產生了類似橋聯絮凝的現象,因而導致三級乳液高溫穩定性降低。綜上可知,經過界面修飾的二級乳液和三級乳液理化特性都有顯著改善,但是二級乳液與三級乳液之間的穩定性差異與多糖種類、濃度、相互作用和界面修飾順序等有關。
作為自然界中唯一存在的陽離子多糖,殼聚糖也可修飾乳液界面蛋白而改善乳液特性。在殼聚糖介導的界面修飾體系中,首先加入負電荷蛋白質使其吸附于乳液界面,隨后加入陽離子殼聚糖,后者通過靜電吸引作用對界面蛋白進行修飾。Liu Chang等發現殼聚糖與界面蠶豆蛋白通過靜電吸引作用相結合后,界面蛋白吸附量增加并且在界面上分布更加均勻,乳液界面層厚度與緊密性顯著提高,因此乳液的絮凝和聚結程度降低,貯藏穩定性相比于乳化前預修飾乳液顯著提升。同時,殼聚糖介導的界面修飾還可通過以下機制抑制乳液體系中油脂氧化,提高乳液化學穩定性:1)殼聚糖靜電沉積于界面蛋白層后可以促進后者在油-水界面穩定且均勻分布,進而阻止促氧化劑與油滴直接接觸;2)提高界面層的厚度與黏彈性,延緩O或促氧化劑向界面的擴散;3)通過提高蛋白質界面吸附量并減小油滴粒徑,從而降低油滴與O或促氧化劑接觸的表面積。此外,Liu Chang等在研究殼聚糖界面修飾對乳液特性的改善效果時還發現,殼聚糖可作為保護層降低界面蛋白氧化水平,進一步提高乳液的感官品質、化學穩定性與食用安全性。
2.2 共價交聯修飾
雖然多糖可以通過非共價靜電吸引力沉積在界面蛋白膜上,對蛋白進行界面修飾,改善乳液的特性,但這種靜電吸引力很容易受pH值、離子強度影響而減弱,使多糖層脫落,從而導致油滴聚集,使乳液再次失穩。與之相較,多糖與界面蛋白之間的共價交聯能在外界環境變化下保持穩定,進一步提高乳液穩定性。目前使用較為廣泛的是酶促共價交聯修飾,由1.2節內容可知,氧化酶類可以在乳化后階段作用于界面蛋白中的酚類基團,使PIF形成交聯。而當多糖中含有酚類基團時,其可作為酚類介質,在氧化酶類催化下與乳化后界面蛋白之間形成共價交聯,對蛋白進行界面修飾。如在漆酶和O存在條件下,多糖中的酚類基團被轉化為活性芳香自由基,從而與含酪氨酸殘基的界面蛋白相互交聯;而在過氧化物酶和HO存在條件下,多糖中的酚類基團被奪取單電子后形成酚氧自由基,隨后酚氧自由基通過偶聯反應形成醌類物質,進而與含有氨基或巰基基團的界面蛋白相互交聯。經過多糖共價修飾后,PIF厚度和黏彈性增加,界面蛋白吸附量提升,形成共聚性的界面保護層;并且經共價交聯修飾形成的多糖層不易脫落,使乳液在內、外界環境變化的條件下仍能保持穩定。
SBP含有阿魏酸,因此可作為酚類介質參與氧化酶類催化的界面蛋白交聯反應。Zeeb等以明膠作為乳化劑制備初級乳液,然后加入SBP使其通過LBL技術沉積在油滴界面的明膠保護膜上形成二級乳液,最后向二級乳液中加入漆酶,使SBP與明膠形成共價交聯,從而對界面蛋白進行共價多糖修飾。相比于初級乳液和二級乳液,經過共價交聯處理后的乳液對鹽離子、pH值、熱處理以及凍結-解凍循環處理有更好的穩定性,這是因為乳化后的界面明膠經過修飾與SBP形成了更加緊密的保護層,可防止油滴的絮凝和聚結。同時相關結果也進一步證實共價交聯發生在同一油滴外的兩層吸附層(明膠與SBP)之間,而非發生在相鄰油滴之間。也有學者在乳化后對WPI進行多糖共價界面修飾,并研究其對乳液特性的影響,如Li Jinlong和Zeeb等分別利用辣根過氧化物酶和漆酶的催化作用,使乳液界面WPI與SBP產生共價交聯,并得出相似的結論:經過共價交聯的WPI-SBP乳液,相比于僅通過LBL技術制備的二級乳液,能在更廣泛的pH值范圍內保持穩定。由此可見,在氧化酶的作用下,界面蛋白與多糖之間的非共價結合轉化為共價結合,防止多糖因pH值或離子強度變化而從界面蛋白層上解離,增加了界面吸附層的機械強度,乳液也因此表現出更好的穩定性。
3 多酚修飾
酚類物質是一類在植物中大量存在的次級代謝產物,其化學結構特征是苯環上連接有一個或多個酚羥基,其中后者又稱為多酚。在食品行業中應用較為廣泛的多酚有綠原酸、兒茶酚、阿魏酸、咖啡酸和姜黃素等。多酚可以在乳化后階段與界面蛋白以共價鍵和非共價鍵結合,從而提升界面膜厚度與強度,防止O滲透氧化油滴,并提供有效的空間位阻作用以防止油滴之間相互碰撞。同時,多酚還可促進界面蛋白解折疊而暴露出內部的疏水基團或帶電基團,增加界面蛋白與相鄰界面蛋白或未吸附蛋白之間的交聯程度以提升PIF共聚性。經多酚界面修飾后的乳液,黏度增加,且不易發生絮凝和聚結,物理穩定性顯著提升,油脂氧化程度顯著降低。此外,多酚本身也具有抗氧化活性,與多酚交聯后的PIF可進一步防止油滴氧化,提高乳液的品質。相比于在乳化前階段對蛋白質進行多酚預修飾,乳化后對PIF進行多酚界面修飾能更有效提升乳液穩定性。經過乳化前預修飾的蛋白質與多酚形成較大的聚集體,向界面擴散的速率降低,乳化特性受到一定程度的影響,貯藏過程中物理穩定性低于界面修飾乳液;而在界面修飾過程中,蛋白質首先吸附于界面,隨后在多酚的作用下相互交聯,形成更穩定的界面網絡結構,從而有效抑制乳液油滴聚結,減小乳液粒徑。
多酚主要通過酶促交聯法和自由基誘導法與界面蛋白形成共價交聯。酶促交聯是指多酚在PPO的催化下,被環境中的O氧化為鄰二酚,鄰二酚進一步轉化為活性鄰二醌,后者可以與界面蛋白親核氨基酸殘基(甲硫氨酸、賴氨酸、色氨酸以及半胱氨酸)共價結合,從而對其進行修飾(圖4),Ma Hairan等在乳化后階段通過PPO誘導多酚類物質香草酸與界面WPI共價交聯,增加了PIF厚度,有效防止了乳液油滴在貯藏期間內絮凝。自由基誘導法需要借助自由基攻擊界面蛋白,使其暴露出側鏈親核氨基酸殘基并與多酚共價交聯。Intarasirisawat等則直接以氧化多酚作為促氧化劑,引發自由基鏈式反應,使多酚在乳化后階段與界面蛋白形成共價交聯,賦予PIF更高的強度,降低了乳液的粒徑。同時,產生的適量自由基不僅沒有氧化油滴,反而進一步誘導界面蛋白與相鄰界面蛋白以及多酚交聯,形成更厚的PIF,阻止O滲透進入油滴,因此乳液的氧化穩定性顯著提升。

圖4 酶促交聯法誘導的蛋白-多酚共價交聯Fig. 4 Covalent conjugation of proteins and polyphenols catalyzed by enzymatic reactions
此外,多酚還可非共價作用于界面蛋白,從而改善乳液特性。多酚與界面蛋白間的非共價相互作用主要有疏水作用力、氫鍵、靜電作用力等。疏水作用力通常發生在界面蛋白疏水氨基酸殘基(色氨酸、酪氨酸、半胱氨酸、甲硫氨酸等)與多酚的非極性芳香環之間;氫鍵主要發生在多酚的羥基(—OH)與界面蛋白羧基(—COOH)以及氨基(—NH)之間;靜電作用力主要發生在界面蛋白帶正電荷的氨基酸(如賴氨酸的-氨基)與多酚帶負電荷的—OH之間。Fuhrmann等發現原花青素可促進界面WPI三級結構打開以暴露出疏水側鏈基團,從而與界面蛋白分子之間通過疏水作用力、氫鍵以及靜電作用相結合,增加PIF厚度;同時,相鄰界面蛋白分子之間也可通過疏水作用力相互交聯,形成更緊密的界面網絡結構。經過原花青素界面修飾后的WPI乳液,雖然油滴發生部分聚集,但是表觀黏度顯著提升,穩定性增加。
Intarasirisawat等發現在乳化后向魚卵蛋白水解物穩定的乳液中添加氧化單寧酸(oxidised tannic acid,OTA)進行界面修飾,乳液的粒徑顯著低于未修飾乳液和預修飾乳液,并在14 d內保持了良好的貯藏穩定性。OTA的加入可改善PIF的結構,有助于促進界面蛋白之間相互交聯,形成機械強度更高的保護膜,抑制油滴的絮凝和聚結并降低粒徑。然而,乳液體系中蛋白濃度過高時,多酚修飾會增加乳液粒徑。這是由于界面達到吸附飽和狀態,連續相中存在大量未吸附蛋白,此時多酚誘導的交聯不僅發生在界面蛋白之間,也發生在界面蛋白與未吸附蛋白之間,使得吸附層變厚,從而導致粒徑增大。由此可見,界面修飾乳液的粒徑與蛋白濃度有關。總體而言,界面修飾能顯著提升乳液貯藏穩定性,當蛋白濃度較低時,界面蛋白之間相互交聯,PIF機械強度提高,使PIF在外界環境條件變化時仍能保持完整,有效抑制油滴的絮凝和聚結;而當蛋白濃度較高時,界面蛋白與未吸附蛋白交聯,形成更厚、更穩定的PIF,提供了更有效的空間位阻效應,同樣能更好地抑制油滴絮凝和聚結,較厚的界面膜還能阻止O與油滴接觸,有效地抑制了油滴的氧化,延長了乳液貯藏期。
結合上述相關研究的結果和推論可以初步了解多酚修飾界面蛋白的途徑與機制。目前,多酚界面修飾的具體操作方式通常是向乳液中加入適量多酚,通過高壓均質等物理方式使體系充分混合,或通過酶、促氧化劑等誘導反應發生,并將最終的界面修飾乳液在室溫下靜置一段時間使體系穩定。但是,有關多酚對大分子蛋白界面修飾的研究仍然較少,多酚-界面蛋白相互作用影響乳液性質的機制還不明確,不同多酚與不同界面蛋白相互作用對乳液性質的影響尚未闡明,多酚濃度、界面蛋白濃度以及未吸附蛋白濃度與界面修飾的互作關系等科學問題都亟需繼續探索。
4 氧化修飾
近年來,氧化修飾對蛋白質功能性質的改善逐漸受到學者們的關注。蛋白質氧化是指活性氧簇(reactive oxygen species,ROS)直接誘導或在氧應激條件下產生的次級副產物間接誘導的蛋白質共價修飾現象,其中以ROS直接誘導的氧化反應為主。
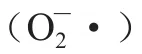
5 結 語
蛋白界面修飾在20世紀末受到一定的關注(如通過LBL技術制備多層乳液),但截至目前該領域仍缺乏深入研究和系統總結。本文綜述了目前使用較為廣泛的幾種蛋白界面修飾方法:酶促交聯修飾、多糖修飾、多酚修飾和氧化修飾,并介紹了以上方法的機制及對乳液特性的改善效果。乳液界面蛋白經過修飾后,可通過共價作用或非共價作用與相鄰界面蛋白、未吸附蛋白或其他修飾物質形成交聯,形成緊密度更強、吸附量更高的界面蛋白膜,通過防止油滴聚結、氧氣滲透等,提升乳液的貯藏穩定性、消化穩定性或氧化穩定性。但由上文所述內容可以發現,蛋白界面修飾領域仍有很大的發展空間。首先,未來需進一步優化各類界面修飾方法的具體操作方式與反應條件以提高該項技術在實際生產應用中的可行性。如對于酶促交聯修飾、多糖修飾、多酚修飾,需進一步研究體系中酶、多糖和多酚的適宜添加量,并進一步確定反應時間和反應終止條件,從而提升乳液特性的改善效果;而對于氧化修飾,需更精確測定界面蛋白發生修飾所需的自由基含量并通過優化反應時間加以控制,從而防止自由基過量對蛋白質和油相產生不利的影響。其次,目前界面修飾方法較為單一,主要集中于化學手段,未來需進一步研究如何將化學修飾法與物理修飾法(如超聲波、高靜壓、高壓均質等)相結合,以拓寬界面修飾應用范圍并進一步提升界面修飾效果。此外,經過界面修飾的乳液雖然各種理化特性得到改善,但其消化性仍需進一步驗證,以保證最終產品的安全性。鑒于乳液體系的復雜性,很難預測多相之間的互作機制,因此對蛋白進行界面修飾確實存在一定的困難,但是先前的研究成果為后續繼續探索提供了堅實的理論基礎,并證實大分子蛋白界面修飾改善乳液特性具有可行性,在未來必將有廣泛的應用前景。

