提高藥品不良反應上報率的措施研究
王琭琭,李淋
醫療機構是藥品不良反應(adverse drug reaction,ADR)發現、報告、處理和規范的主體[1]。我國醫療衛生機構ADR 的上報率暫無統一規定[2],本院統計的ADR 上報率參考劉學毅等[3-5]經德爾菲法調查研究后建議的參考值(≥0.01%)。本院為三級綜合醫院,2016 和2017 年平均年門急診109 萬余人次、出院患者2.4 萬余人次,衛生技術人員800 余人。而同年上報到國家藥品不良反應監測中心的ADR 數量逐年遞減,年平均報告量不足20 份,且臨床存在較多ADR 信息報告未能及時上報的情況。為改善本院ADR 上報問題,2018 年初本院采取多項舉措,對ADR 監測與上報工作進行改進,取得了階段性成效。本文總結了本院提高上報率的措施及研究分析方法,以期為醫療機構開展此項工作提供參考和借鑒。
1 資料與方法
1.1 研究對象
結合2018 和2019 年本院醫生、藥師、護士上報到國家藥品不良反應監測中心的481 例ADR 病歷情況,并與2016 和2017 年進行比較,重點研究本院ADR 監測體系的改進與實施,以及ADR 上報率的提高措施。
1.2 研究方法
1.2.1 改進ADR 報告管理體系
①完善組織機構:成立醫院ADR 監測領導小組。組內成員由臨床專家、護理專家以及藥學專家組成,主要負責重大ADR 的調查、會診和討論,并提出評價意見。② 建立ADR 監測評估體系:醫生、護士、藥師合作的ADR 監測評估體系,由各病區主任、護士長、藥劑科指定專人負責相關工作。③健全制度:在改進體系建設的基礎上,完善現有的《藥品不良反應報告制度》《藥品不良反應監測與報告獎懲辦法》《藥品不良反應監測工作考核制度》《藥品不良反應報告與監測培訓制度》等制度。
1.2.2 設定考核指標
①上報人群:在原有常態化上報人群醫生和護士的基礎上,增加3 名臨床藥師,要求其主動到責任病區收集ADR 病歷[1],上報數量≥5 例/人/年。② 上報率:各科室年度ADR 報告數量與診治患者人數比例相符,年度報告數量不少于年住院人次數的0.5%。③嚴重的、新的ADR 上報率:ADR 呈多樣化特點,嚴重的、新的ADR 報告比例不少于年上報例數的3%。④ ADR 報告規范性:為提高上報質量,要求報表的必填項(ADR 報表中項目前有*號的項目)100%完成。⑤ ADR 監測宣傳培訓工作開展情況:每年開展全院ADR 相關知識培訓不少于4 次,全年參加培訓人員占全院醫生、藥師、護士比例不低于80%。
1.2.3 研發ADR 在線上報系統
為了進一步方便臨床上報藥品不良反應,2018年本院在保留原有紙質版上報形式的同時,研發了ADR 在線上報系統。平臺具有下述功能:①醫生、護士和藥師在授權后均可通過該系統上報,上報完成后藥師端能及時接收信息,與上報人員進行溝通后進行評價、處置。② 提取信息:平臺支持ADR 報表全部信息導出,方便數據統計分析。
1.2.4 落實獎懲制度,提高上報積極性
制定本院《藥品不良反應監測與報告獎懲辦法》,成功上報ADR 病歷到國家藥品不良反應監測中心者,給予10 元/例的獎勵;超過規定數量上報ADR 病歷者,給予20 元/例的獎勵。
1.2.5 定期組織ADR 培訓班
定期開展監測員專項培訓和全院醫務人員培訓。培訓內容主要包括國家相關法律法規、ADR 概念的界定、ADR 的分類、與患者溝通的技巧、報表的填寫方法、ADR 因果關系分析方法等。
1.2.6 每月通報ADR
藥劑科每月統計分析 ADR 報表,對其進行匯總及評價分析。在醫院院務會上通報臨床科室 ADR上報情況,每季度將ADR 工作小結刊登在醫院內部刊物《藥訊》上,供臨床醫生、護士、藥師參考學習。
1.2.7 固定臨床科室聯絡員
由臨床科室內部自定一名責任心強的醫生或者護士負責ADR 上報、聯絡等工作,主要內容包括保證病歷的真實和完整性、檢查 ADR 報表填寫的規范性,并在規定時間內上報藥劑科。
2 結果
2.1 2016~2019 年ADR 報告數量對比
2018 年1 月重新構建并完善了本院ADR 監測上報管理體系,并落實了配套措施。本院ADR 上報率由2017 年的0.03%增長到2018 年的0.91%、2019 年的0.93%,上報率大幅提升。見圖1。
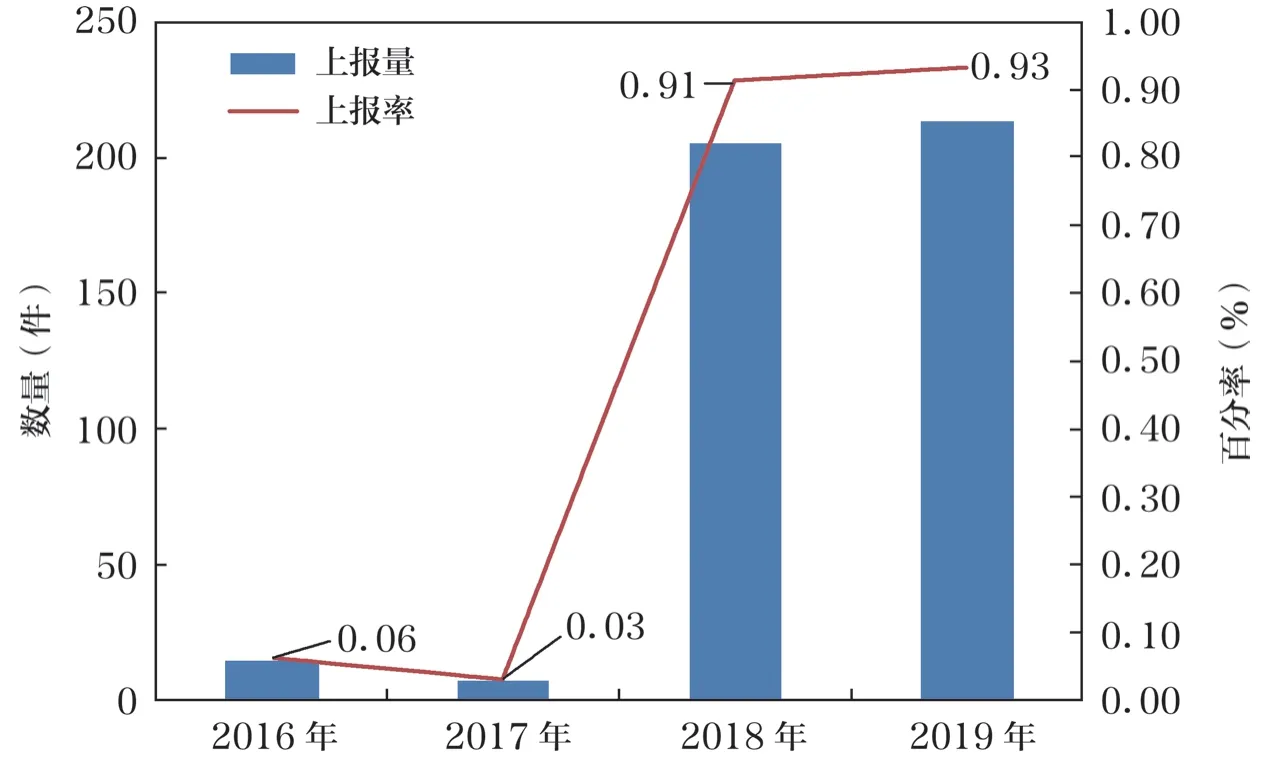
圖1 2016~2019 年ADR 報告數量對比
2.2 2016~2019 年ADR 報告質量對比
2018 年,嚴重的、新的ADR 報告例數實現了零的突破,且構成比高于《我國醫療衛生機構藥品不良反應上報指標研究》[2]中建議的參考值(≥1%)。2016~2019 年本院ADR 報告合格率分別為11(68.7%)、13(72.2%)、221(82.7%)、180(84.5%),與建議參考值(≥90%)還有一定差距[2]。見表1。
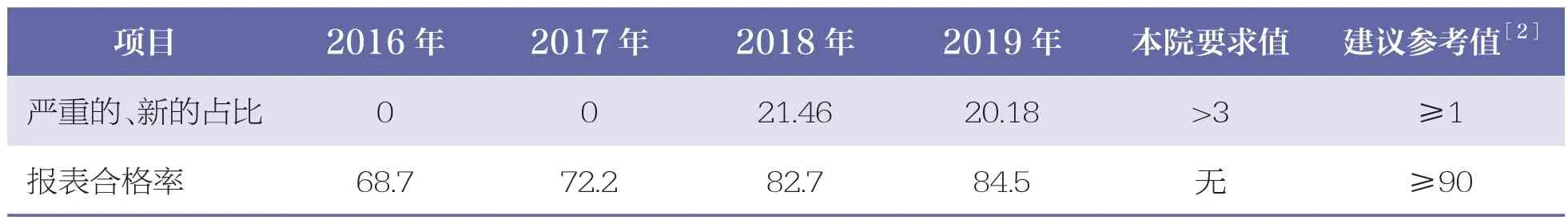
表1 2016~2019 年ADR 報告質量對比 %
2.3 上報途徑分析
自2018 年本院自主研發ADR 上報系統開始,醫生、護士基本能夠熟練掌握上報流程。但是,產科、急診科由于不熟悉上報系統,目前還是通過紙質版方式報告給藥劑科,提示本院ADR 上報系統仍需逐步推廣應用。
2.4 臨床藥師上報ADR 情況
本院ADR 監測體系改進并實施后,臨床藥師主動到責任病區收集病歷的積極性明顯提高。2018和2019 年ADR 報告數分別為8 和15 例,較2016年(0 例)和2017 年(0 例)大幅增加(見表1)。針對ADR 報表中患者信息填寫不完整、錯誤填寫關聯性評價、ADR 過程描述不詳細、懷疑藥品信息缺項等填報問題。臨床藥師積極在責任病區內開展專題培訓,在減少不合格報告的同時,提高了ADR上報率。
2.5 ADR 風險信號挖掘
2018 和2019 年本院利用ADR 監測信號來加強藥品風險管理[6],警惕潛在的藥品安全問題,及時發現問題并處置,最大程度降低了用藥風險。臨床藥師通過綜合分析ADR 報告,了解人群ADR 發生的特點及規律,匯總了發生過敏性休克ADR 及群體不良事件,發現了一些 ADR 發生率高的藥品,見表2。

表2 2018 和2019 年本院ADR 預警信號統計
3 討論
2018 和2019 年,通過采取一系列合理、有效的措施,ADR 上報率明顯提升。改進后通過定期分析對比數據,發現監測到多類型 ADR 及可疑藥品和多種給藥途徑的ADR。通過收集數據深入挖掘藥品風險信號,保障患者的用藥安全。提示在今后本院的ADR 監測工作中,還應加強以下幾項管理。
①預警信號:ADR 信號取決于病歷報告的嚴重程度和報告質量,ADR 報告在具有良好質量的情況下,嚴重的、新的ADR 報告才是有效預警信號的來源[7]。應以國家預警系統共享平臺中的預警規則[8]為依據,制定符合本院實際情況的預警規則,在保證報告質量的前提下,動態調整嚴重的、新的ADR 報告指標,從而提高預警信號發現藥品風險的靶向性。
② 群體不良事件:2018 年本院多次上報注射用硫辛酸引發的ADR 病歷至國家藥品不良反應監測中心,同年5 月國家藥品不良反應監測中心反饋該廠家生產的硫辛酸注射液(0.15 和0.3g)出現疑似ADR 聚集信號,涉事批次為3 批次。本院立即停用該藥,改用其他廠家生產的注射用硫辛酸,減少了ADR 病歷。通過此次事件,制定了《藥品召回制度和流程》,要求臨床出現聚集性病例和嚴重ADR,應立即上報;臨床藥師前往臨床科室查看情況,并對病歷進行分析。充分利用ADR 監測數據,結合以往文獻報道,查找ADR發生原因和影響因素,有效地促進了本院臨床合理用藥。
③觸發點跟蹤:臨床藥師在參與臨床工作中,發現存在ADR 病歷填報不及時和漏報的情況。針對此種情況,采用倒查相關藥物的方法,從發生可疑ADR 時選用的對癥處理藥物入手,每周查閱使用醋酸地塞米松注射液、葡萄糖酸鈣注射液、維生素C 注射液、氯雷他定片、馬來酸氯苯那敏片等藥物的病歷,通過監測上述幾種藥物的使用情況來檢查是否存在漏報,從而提高本院ADR 的上報率。但該方法也存在缺陷,如專人監測工作量大,還需努力提高醫務人員上報積極性,減少不報、漏報的現象。
醫療機構開展ADR 監測工作具有十分重要的意義[9]。本院2016和2017年上報的ADR數量較少、質量較低,通過上述措施明顯提高了上報率和報告質量,并且能夠捕捉到ADR 預警信號。今后本院將繼續開展對藥品風險預警的研究工作,提升信號發現風險的靶向性,以期為臨床安全用藥提供參考。

