信號蛋白3A對成肌細胞功能的影響及其轉錄調控機制
李上,徐子瑛,于子惠,馮韜錦,王中奇,李然,尹鵬濱,張里程,唐佩福*
1解放軍醫學院,北京 100853;2解放軍總醫院第四醫學中心骨科醫學部,北京 100048;3國家骨科與運動康復臨床醫學研究中心,北京 100853;4首都兒科研究所,北京 100020;5中國科學院北京基因組研究所(國家生物信息中心),北京 100101
骨骼肌干細胞又稱衛星細胞,貯存于肌纖維基底膜下,在生理條件下多保持靜息狀態[1]。當骨骼肌受到損傷時,衛星細胞被激活,增殖、分化為成肌細胞并向損傷部位遷移,融合形成肌管,進而修復受損的肌組織[2]。有研究發現,骨骼肌損傷后衛星細胞中信號蛋白3A(semaphorin 3A,Sema3A)自分泌水平明顯上調[3]。Sema3A是信號蛋白家族的一種分泌型信號蛋白,可作用于微管等細胞骨架結構,從而趨化導向神經軸突發育與再生,同時在腫瘤的發生發展、血管生成和通透性改變、免疫系統功能及骨代謝中承擔著重要角色[4-5]。既往研究顯示,Sema3A對于特定肌源性前體細胞亞群可發揮遷移導向作用,并調控肌纖維的類型,其表達缺失時成肌細胞功能狀態受到顯著影響[6-7]。本課題組前期研究表明,Sema3A對骨骼、血管及神經肌肉接頭等組織的結構與功能具有協同調控能力,是肌、骨損傷修復中極具潛力的研究對象,但目前外源性Sema3A影響成肌細胞功能的研究鮮見[8-9]。本研究探討Sema3A對成肌細胞功能的影響及其可能的轉錄調控機制,以期為后續骨骼肌損傷修復策略及相關材料學研究提供參考。
1 材料與方法
1.1 主要試劑及儀器 C 2 C 1 2 成肌細胞系(1101MOU-PUMC000099)購自中國醫學科學院基礎醫學研究所細胞資源中心;胎牛血清、馬血清、DMEM高糖培養基、胰蛋白酶、青-鏈霉素雙抗購自美國Gibco公司;重組Sema3A蛋白購自中國義翹神州公司;RNA提取試劑盒、反轉錄試劑盒HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)、實時熒光定量ChamQ Universal SYBR qPCR Master Mix試劑盒、VAHTS Universal V8 RNA-seq Library Prep Kit for Illumina、Ribo-off Globin & rRNA Depletion試劑盒購自南京諾唯贊生物科技股份有限公司。細胞計數儀購自美國Millipore Scepter公司;熒光定量PCR儀(CFX-96)購自美國Bio-Rad公司;IncuCyte ZOOM長時程動態活細胞成像及數據分析系統購自美國森西公司;Qubit 4.0熒光定量儀購自美國Thermo Fisher公司。
1.2 方法
1.2.1 細胞培養及分組 C2C12成肌細胞培養于含10%胎牛血清(FBS)、1%青-鏈霉素雙抗的DMEM高糖培養基中(增殖培養基),置于37 ℃、5% CO2細胞培養箱中,每24 h進行細胞傳代。根據文獻[10-12]的方法,各實驗組所用細胞培養基中重組Sema3A蛋白的終濃度分別為1.0 μg/ml、0.1 μg/ml、0.01 μg/ml,并設置對照組。
1.2.2 動態活細胞成像檢測細胞增殖能力 取生長狀態良好的成肌細胞,消化至細胞懸液,離心后重懸并使用Millipore Scepter細胞計數儀進行細胞計數,調整細胞濃度為2.5×103個/ml,接種于96孔板中,每孔200 μl。待細胞均勻貼壁后,依照實驗分組將細胞培養基分別更換為含有重組Sema3A蛋白的增殖培養基。將96孔板置入IncuCyte ZOOM長時程動態活細胞成像系統培養箱中,每2 h進行1次拍攝,持續24 h后終止拍攝。所得圖像數據使用IncuCyte Software中的Cell-By-Cell算法進行分析處理,對每孔中間區域進行四等分后計數并繪制增殖曲線。
1.2.3 劃痕實驗檢測細胞遷移能力 取生長狀態良好的成肌細胞接種于96孔板中(200 μl/孔,細胞濃度5×104個/ml)。待細胞生長密度達到100%后,使用IncuCyte細胞劃痕器對細胞進行標準化傷口劃痕,棄上清,用PBS清洗,依照實驗分組將細胞培養基更換為含有重組Sema3A蛋白的DMEM高糖培養基。將96孔板置入IncuCyte ZOOM長時程動態活細胞成像系統培養箱中,每2 h進行1次拍攝,持續24 h后終止拍攝。所得圖像數據使用IncuCyte Software進行分析處理,計算劃痕愈合率并繪制傷口愈合曲線。
1.2.4 RT-qPCR檢測成肌分化因子的表達 取生長狀態良好的成肌細胞,待細胞融合度達到80%~90%后,更換為含2%馬血清(HS)、1%青-鏈霉素雙抗的DMEM高糖培養基(分化培養基),誘導各組成肌細胞分化培養72 h。利用Trizol裂解法提取成肌細胞總RNA,使用Qubit 4.0測定RNA濃度,行瓊脂糖凝膠電泳評價RNA的完整度,IQ值達到5即可進行后續實驗。
取1 μg RNA樣本,使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)進行gDNA去除及cDNA合成,取相同cDNA模板量與2× ChamQ Universal SYBR qPCR Master Mix試劑及目標引物混勻進行RT-qPCR。使用Bio-Rad CFX Manager軟件進行處理分析,以2-ΔΔCt法計算目的基因相對表達水平。使用Primer Premier 6軟件進行引物設計,引物序列如表1所示。
1.2.5 RNA提取及轉錄組測序分析 誘導1.0 μg/ml Sema3A組及對照組成肌細胞分化72 h,利用Trizol裂解法提取細胞總RNA,使用Qubit 4.0測定RNA濃度,行瓊脂糖凝膠電泳評價RNA的完整度,IQ值達到8以上且濃度達到建庫標準即可用于后續RNA文庫構建。
利用Ribo-off rRNA Depletion kit去除rRNA。對剩余RNA進行定量后,利用VAHTS Universal V8 RNA-seq Library Prep Kit for Illumina進行鏈特異文庫構建;最終磁珠篩選400 bp左右片段,并進行文庫擴增。最終文庫進行2100及RT-qPCR實際文庫質量檢測,合格后借助Illumina測序平臺的Novaseq進行雙端150 bp的RNA測序,每個樣本10G數據量。
利用數據過濾軟件Trimmomatic對數據中的讀段進行處理,主要去除接頭(adapter)序列和低質量序列等。其余讀段使用HISAT2的小鼠參考基因組(mm10)進行基因組比對。對于每個樣本,僅保留比對質量分數≥20的唯一讀段用于后續分析。使用HT Seq Python (0.9.1)計算每個基因的唯一比對讀段。基因表達以FPKM(Fragments Per Kilobase per Million)進行量化,并用于相關性分析。采用R-package DEseq2分析1.0 μg/ml Sema3A組與對照組之間的差異表達基因,fold-change cut-off=1.0,Pvalue cut-off=0.05。利用R-package Cluster Profiler對基因進行GO(Gene Ontology)功能富集分析,保留顯著富集且P<0.05的GO通路。
1.2.6 RT-qPCR驗證差異基因的表達 誘導1.0 μg/ml Sema3A組及對照組成肌細胞分化72 h,采用RTqPCR對部分差異表達基因進行驗證,操作步驟同1.2.4。引物序列如表1所示。
1.3 統計學處理 采用GraphPad Prism 8.0軟件進行統計分析。計量資料以表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析(one-way ANOVA),進一步兩兩比較采用Turkey法。P<0.05為差異有統計學意義。
2 結 果
2.1 Sema3A對成肌細胞增殖和遷移能力的影響IncuCyte細胞成像計數顯示,成肌細胞計數隨著重組Sema3A蛋白濃度增高而增加,其中1.0 μg/ml Sema3A組細胞計數較對照組增加17.36%(P<0.001,圖1A)。培養24 h后,1.0 μg/ml Sema3A組成肌細胞計數[(1464.19±29.72)個]明顯高于0.1 μg/ml Sema3A組[(1397.69±49.50)個,P<0.001]、0.01 μg/ml Sema3A組[(1381.11±35.18)個,P<0.001]和對照組[(1247.58±26.55)個,P<0.001],0.1 μg/ml Sema3A組與0.01 μg/ml Sema3A組細胞計數均明顯高于對照組(P<0.001),但兩組間差異無統計學意義(P>0.05)。
劃痕實驗結果顯示,成肌細胞劃痕愈合率隨著重組Sema3A蛋白濃度增高而增高,其中1.0 μg/ml Sema3A組劃痕愈合率較對照組升高69.66%(P<0.001,圖1B)。劃痕24 h后,1.0 μg/ml Sema3A組劃痕愈合率(86.46%±3.09%)明顯高于0.1 μg/ml Sema3A組(78.51%±5.32%,P<0.001)、0.01 μg/ml Sema3A組(73.81%±3.54%,P<0.001)和對照組(50.96%±2.50%,P<0.001),0.1 μg/ml Sema3A組與0.01 μg/ml Sema3A組劃痕愈合率均明顯高于對照組(P<0.001),同時0.1 μg/ml Sema3A組劃痕愈合率高于0.01 μg/ml Sema3A組(P<0.05)。
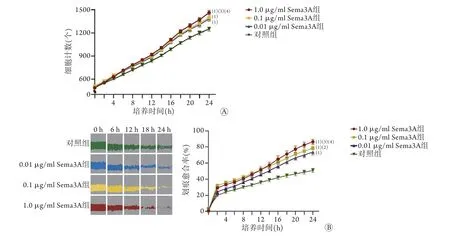
圖1 Sema3A對成肌細胞增殖與遷移能力的影響Fig.1 Effects of Sema3A on proliferation and migration of myoblasts
2.2 Sema3A對成肌細胞分化相關基因表達的影響 RT-qPCR檢測結果顯示,Sema3A可上調成肌分化相關基因Myf5、MyoG的表達(P<0.05,圖2)。與對照組比較,各濃度(0.01、0.1、1.0 μg/ml) Sema3A組Myf5mRNA相對表達量分別升高25.21%±1.89%、34.02%±5.78%、37.47%±11.67%(P<0.05或P<0.01),1.0 μg/ml Sema3A組MyoGmRNA相對表達量升高26.57%±11.31%(P<0.05)。各濃度(0.01、0.1、1.0 μg/ml)Sema3A組MyoDmRNA相對表達量呈上升趨勢,但與對照組比較差異無統計學意義(P>0.05)。

圖2 Sema3A對成肌細胞Myf5、MyoG和MyoD基因表達的影響Fig.2 Effects of Sema3A on the expressions of Myf5, MyoG and MyoD of myoblasts
2.3 Sema3A對成肌細胞基因轉錄組表達的影響為了進一步探索Sema3A影響成肌細胞功能狀態的機制,對1.0 μg/ml Sema3A干預24 h的成肌細胞與對照組細胞進行去核糖體鏈特異轉錄組測序(n=3),結果顯示,樣本轉錄組的組內相關性較好,組間差異較大(圖3A);與對照組細胞轉錄組比較,1.0 μg/ml Sema3A組有1101個基因表達上調,974個基因表達下調,兩組間總體表達譜差異較大(圖3B)。1.0 μg/ml Sema3A組上、下調基因見附加材料。

圖3 Sema3A對成肌細胞基因轉錄組表達的影響Fig.3 Effect of Sema3A on the transcription profile of myoblasts
GO功能富集分析結果顯示,1.0 μg/ml Sema3A組成肌細胞的上調通路顯著富集于調控肌細胞與肌纖維發育、細胞與解剖結構成熟等與骨骼肌發育顯著相關的功能通路,以及骨與軟骨細胞增殖、成骨分化及骨礦化成熟等骨形成相關的功能通路(圖4A);而下調通路主要富集于調控脂蛋白、乳糜微粒等脂代謝相關的功能通路(圖4B)。

圖4 Sema3A刺激成肌細胞后差異表達基因的GO富集通路Fig.4 The GO enrichment pathway of differentially expressed genes stimulated by Sema3A in myoblasts
基于生物信息學分析獲得的差異表達基因,對其中部分參與多個富集通路的Prox1、Myh11、IHH、LipC、ApoC2基因在轉錄水平進行驗證,結果顯示,與對照組比較,1.0 μg/ml Sema3A組Prox1、Myh11mRNA相對表達量升高22.48%±14.42%(P<0.05)、21.42%±5.81%(P<0.01),LipC、ApoC2mRNA相對表達量降低23.08%±15.38%(P<0.05)、55.97%±26.51%(P<0.05),而兩組IHHmRNA相對表達量差異無統計學意義(P>0.05) (圖5)。
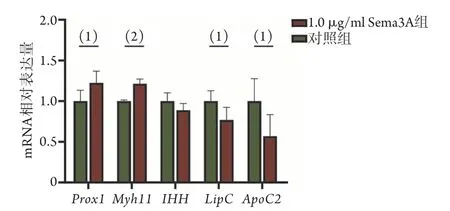
圖5 RT-qPCR檢測部分差異基因表達水平Fig.5 Expression levels of partial differentially expressed genes detected by RT-qPCR
3 討 論
骨骼肌承擔著機體運動與能量代謝等多種重要功能,結構表淺且力學負荷高,易受損傷[13-14]。損傷后骨骼肌纖維的再生修復主要依賴骨骼肌衛星細胞,其功能改變或缺失可使骨骼肌發生纖維化、脂肪沉積等一系列病理改變,嚴重損害骨骼肌的收縮、代謝等功能,導致肌力下降、衰弱,嚴重時可致殘,導致社會勞動力損失[15-16]。有研究發現,Sema3A與衛星細胞功能和骨骼肌損傷之間存在密切聯系[6]。Sema3A在成肌細胞早期分化階段表達上調,且對于特定的衛星細胞亞群具有遷移導向作用[7,17-18];當骨骼肌發生損傷時,衛星細胞受局部微環境調控可上調Sema3A的表達及自分泌水平,并進一步參與再生骨骼肌纖維類型的分布等[3,19];Sema3A對骨骼與骨骼肌內血管、神經和免疫細胞等組織均具有調控能力,可能是促進肌、骨損傷后結構再生與功能恢復的重要潛在靶點[20-22]。
本研究使用重組Sema3A蛋白在體外刺激成肌細胞,發現Sema3A蛋白可促進成肌細胞的增殖與遷移,且在0.01~1.0 μg/ml濃度區間呈濃度依賴性。既往研究發現,衛星細胞微環境中的肝細胞生長因子(hepatocyte growth factor,HGF)、成纖維細胞生長因子2(fibroblast growth factor 2,FGF2)均可促使衛星細胞激活后Sema3A表達上調,而轉化生長因子-β(transforming growth factor-β,TGF-β)可抑制成肌細胞融合與肌纖維再生,同時下調衛星細胞中Sema3A的表達[23-24]。使用Sema3A-siRNA轉染后成肌細胞增殖能力下降,而Sema3A過表達可使Pax7+/MyoD+增殖型成肌細胞增多[25],與本研究結果趨勢相符。Sema3A由于可調控細胞骨架的解聚而影響多種細胞的遷移能力,如腫瘤細胞轉移、樹突狀細胞遷移和血管通透性等[26-28]。既往研究發現,Sema3A對特定骨骼肌前體細胞亞群具有遷移導向作用[7]。Sema3A在Ⅰ、Ⅱa型肌纖維中呈高表達,并可作為排斥因子使扭曲蛋白2陽性(Twist2+)骨骼肌干細胞亞群避免與Ⅰ、Ⅱa型肌纖維相融合,發揮與在神經系統中相似的排斥功能[7]。
為探討Sema3A對成肌細胞分化能力的影響,本研究使用含有梯度濃度重組Sema3A蛋白的分化培養基誘導培養成肌細胞,發現成肌細胞中Myf5、MyoG基因表達較對照組明顯升高,MyoD基因表達呈上升趨勢,但與對照組無明顯差異。Myf5、MyoD及MyoG的基本結構相同,均屬于成肌調節因子家族(myogenic regulatory factor family)中的轉錄因子成員,在胚胎發生過程中及出生后協同調控骨骼肌的發育,且各轉錄因子間相互調節[29]。既往研究顯示,特異性敲除Sema3A可使衛星細胞中部分分化相關基因表達下調,但不影響成肌細胞的融合;過表達Sema3A可使Myf5表達上調,但不影響MyoD的表達[19]。在肌細胞分化過程中,成肌調節因子可被順序激活,其中MyoD在分化中晚期表達上調而發揮轉錄調節作用[30],因此,本研究在成肌細胞體外培養過程中未發現Sema3A對其表達水平的顯著影響。
本研究生物信息學分析發現,Sema3A可使成肌細胞轉錄表達譜發生明顯改變,其中上調基因顯著富集于肌細胞與肌纖維發育、細胞與解剖結構成熟等相關通路,與細胞增殖實驗結果相符;下調基因主要富集于調控脂蛋白、乳糜微粒等脂代謝相關通路。有研究發現,脂肪細胞在肌肉中異位沉積可干擾骨骼肌的再生質量并使其功能受損[31]。
本研究對部分富集通路中的差異表達基因在mRNA水平進行驗證,結果顯示,1.0 μg/ml Sema3A組Prox1、Myh11基因表達上調。在小鼠及人類骨骼肌中,Prox1基因是成肌細胞分化和Ⅰ型肌纖維形成的重要因子,在衛星細胞Sema3A特異性敲除小鼠骨骼肌中Ⅰ型肌纖維比例減少且衛星細胞成肌分化受損[32]。由此可見,Prox1可能作為Sema3A干預成肌細胞后激活的轉錄因子,參與調控成肌細胞的分化及骨骼肌纖維類型的分布。不同于Prox1,Myh11主要在平滑肌中表達,參與血管、尿道等器官中肌組織的形成[33]。MYH家族參與機體所有肌肉組織的形成及再生,但Myh11基因對骨骼肌功能的影響鮮見報道,其在1.0 μg/ml Sema3A組中表達升高可能與骨骼肌血管再生存在聯系。
本研究發現,ApoC2、LipC基因在1.0 μg/ml Sema3A組中表達下調。ApoC2基因編碼一種脂質結合蛋白,可促進三酰甘油水解以為細胞提供游離脂肪酸,有研究報道,ApoC2基因表達水平與骨骼肌質量呈負相關[34];在二甲雙胍促進脂肪酸氧化的過程中,成肌細胞中ApoC2表達呈下調趨勢[35]。LipC基因編碼肝三酰甘油脂肪酶,在乳糜微粒及脂蛋白代謝中起重要作用,參與骨骼肌脂肪酸的代謝[36]。損傷骨骼肌中脂肪累積可嚴重損害再生骨骼肌的結構與功能[31]。Sema3A下調成肌細胞中ApoC2、LipC基因的表達或可減少游離脂肪酸的形成,從而避免再生骨骼肌中的脂肪異位沉積[37]。間充質干細胞及肌源性前體細胞均具有成脂分化的潛能,脂代謝相關通路及ApoC2、LipC基因表達下調是否與再生肌組織中干細胞的成脂分化減少相關尚有待進一步探索。
IHH是一種重要的骨源性因子,在骨骼代謝穩態中不可或缺。作為骨骼的附著組織,肌肉在其發生及發育過程中依賴骨骼,而當IHH過表達時,肌肉質量明顯增高而不影響長骨長度,表明IHH可獨立于骨骼長度的變化而調節肌肉質量[38]。在胚胎發生過程中,肌肉與骨骼發育的時間和空間接近,當IHH表達缺失時,骨骼肌發育在胚胎期約第14天出現異常,至胚胎期約第21天后肢體肌肉發生明顯缺失[38]。也有研究發現,IHH在損傷骨骼肌的血管再生中發揮重要功能,高度參與肌骨運動系統的功能穩態[39]。本研究轉錄組測序分析發現IHH基因表達上調,這可能是Sema3A參與調控成肌細胞功能的重要機制,但后續RT-qPCR檢測未觀察到1.0 μg/ml Sema3A組與對照組間存在轉錄水平的差異,需要進一步研究加以驗證。此外,《自然》等雜志多次發文揭示Sema3A通過調控感覺神經長入、促進成骨細胞趨化及活性、抑制破骨細胞分化與成熟等機制發揮骨保護作用[40-42]。本研究發現,Sema3A可上調成肌細胞中與骨細胞增殖、分化及骨礦化成熟相關的功能通路,與本課題組前期研究結果一致[20,43]。既往有研究提出,Sema3A可能通過延遲損傷骨骼肌的早期神經再支配而調節骨骼肌神經、血管等組織的協調再生,促進骨骼肌損傷修復[44],為Sema3A在骨骼肌中的相關研究提供了新的思路。
綜上所述,本研究發現,Sema3A可提高成肌細胞的增殖、遷移能力且呈濃度依賴性,并能上調部分成肌分化相關基因的表達。Sema3A可上調肌、骨細胞發育及成熟等相關功能通路,下調部分脂蛋白代謝相關通路,表明外源性Sema3A可能通過促進肌纖維修復,調節損傷局部組織結構微環境,以及減少損傷骨骼肌的脂質異位沉積而改善再生骨骼肌的質量。但目前Sema3A調控成肌細胞功能關鍵基因的具體機制及其在體內的具體作用仍有待進一步探索。

