腎積水患兒血清胱抑素C 與術后并發癥的關系及其預測模型的構建
王雷波,許可濤,何建華
小兒腎積水是臨床上一種較為常見的先天性疾病[1]。據相關流行病學統計報道,全球小兒腎積水的發病率約為0.15%[2]。目前,手術是中、重度腎積水的主要治療手段,對改善患兒患側腎尿液排泄狀況及腎功能的恢復有著較好的效果[3]。然而,由于小兒免疫功能尚未成熟,病情變化較快,加之術后經常需要放置雙J 管以及引流管,術后并發癥的發生風險較高,嚴重影響預后[4-5]。因此,探討與重度腎積水患術兒后并發癥相關的危險因素,對于完善治療策略、改善預后并降低相關醫療費用有著至關重要的作用。血清胱抑素C(Cys-C)是反映腎小球濾過率的敏感指標,其已被證實能較準確的診斷評估泌尿系統疾病的嚴重程度[6-7]。本研究探討腎積水患兒Cys-C 與術后并發癥的關系并基于Cys-C構建一種可以預測術后并發癥的Nomogram模型,報道如下。
1 資料與方法
1.1 一般資料 回顧性收集于寧波大學醫學院附屬醫院2016年1月至2021年8月行手術治療的249例腎積水患兒的臨床資料。納入標準:(1)年齡≤3歲;(2)經超聲、ECT及磁共振尿路造影成像等影像檢查,并符合重度腎積水診斷標準[8];(3)梗阻性單側腎積水且接受腎初次手術;(4)監護人同意參加本研究并知曉研究目的;(5)臨床資料完整。排除標準:(1)尿道發育畸形或需II 期手術;(2)除輸尿管、腎盂外其他原因所致的腎積水;(3)心、肝以及腎功能嚴重受損;(4)合并嚴重感染或慢性感染;(5)合并凝血功能異常或自身免疫性疾病;(6)嚴重的心臟、肺、肝和腎功能不全疾病;(7)合并惡性腫瘤;(8)中途退出本研究。本研究通過了醫院倫理委員會審查并按照《赫爾辛基宣言》的相關要求進行研究。
1.2 方法 回顧性收集并審查納入患兒的病歷信息。基本資料:年齡、性別、包莖、美國麻醉師協會(ASA)分級、分腎功能(DRF)分級、腎積水部位、腎積水量、腎實質厚度以及腎盂前徑;術前實驗室指標:白蛋白(Alb)、血紅蛋白(Hb)、C-反應蛋白(CRP)、紅細胞(RBC)、白細胞(WBC)、淋巴細胞、中性粒細胞、單核細胞、血小板(PLT)、血尿素氮(BUN)、肌酐(Cr)、腎小球濾過率(GFR)以及Cys-C;手術相關指標:手術方式、術中生命體征[血氧飽和度(SpO2)、心率(HR)、平均動脈壓(MAP)]、手術時間、術中出血量以及術后雙J 管留置情況。
術后并發癥定義為腎盂輸尿管吻合口梗阻、腎盂輸尿管扭轉、滲血或滲尿、尿路感染、肺部感染、切口感染以及黏連性腸梗阻。如出現多種并發癥,則記錄首次出現的并發癥。根據患兒術后是否出現并發癥分為研究組與對照組。
1.3 統計方法 采用SPSS 23.0 及R語言4.0 進行統計分析。計量資料以均數±標準差表示,組間比較采用獨立樣本t檢驗;計數資料采用2 檢驗;采用受試者工作特征曲線(ROC)分析有差異的連續性變量,根據最佳截斷值,并以此轉化為二分類變量進行后續分析;采用多因素Logistic 回歸分析術后并發癥發生的獨立危險因素;采用R 軟件“rms”包構建Nomogram 模型及內部驗證,模型性能由一致性指數(C-index)和校準曲線進行評價,模型臨床凈收益由決策曲線分析(DCA)進行評估。P <0.05 為差異有統計學意義。
2 結果
2.1 術后并發癥發生率及Cys-C 水平比較 249例腎積水患兒中,86例(34.54%)發生術后并發癥,其中腎盂輸尿管吻合口梗阻20例(8.03%),腎盂輸尿管扭轉8例(3.21%),滲血或滲尿24例(9.64%),尿路感染21例(8.43%),肺部感染5例(2.00%),切口感染5例(2.00%),黏連性腸梗阻3例(1.20%)。研究組Cys-C 水平顯著高于對照組[(1.44±0.26)mg/L vs(1.17±0.21)mg/L,t=11.550,P <0.05)]。
2.2 兩組臨床資料的比較 研究組腎積水患兒ASA分級(Ⅲ~Ⅳ)比例、DFR(1 ~2 級)比例、CRP、BUN、Cr、手術時間以及術中出血量均高于對照組(均P<0.05);而年齡、腎實質厚度、GFR 及Alb均低于對照組(均P<0.05),見表1。
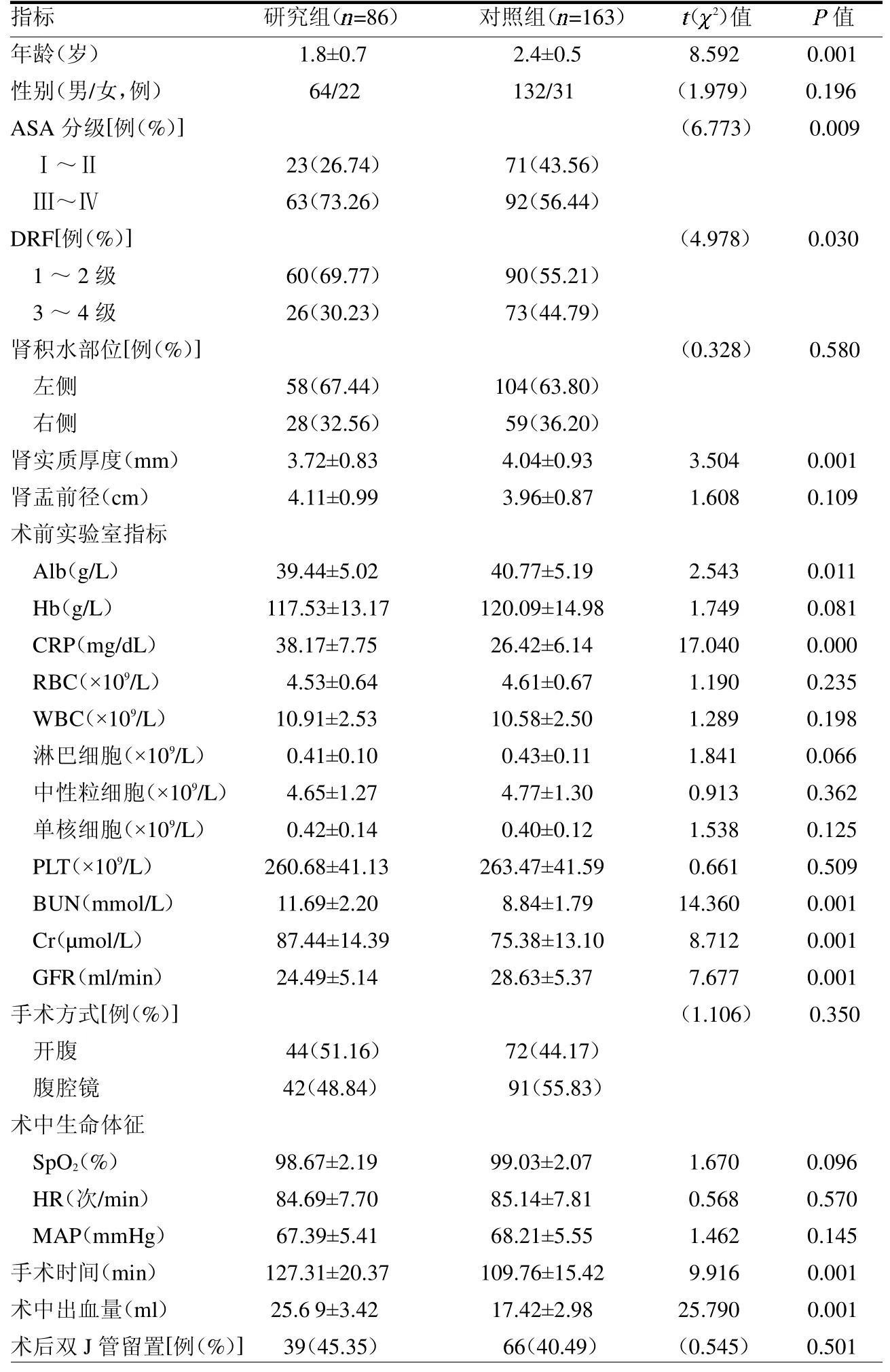
表1 研究組與觀察組腎積水患兒臨床資料的比較
2.3 兩組術后并發癥相關連續性變量ROC 分析 Cys-C、年齡、腎實質厚度、Alb、CRP、BUN、Cr、GFR、手術時間及術中出血量的最佳截斷值分別為>1.45 mg/L、≤4歲、≤3.60 mm、≤38.76 g/L、> 39.17 mg/dL、> 12.03 mmol/L、≤88.63 mol/L、≤23.86 ml/min、>130min 及>28 ml,AUC 分別為0.747(0.691 ~ 0.826)、0.628(0.596 ~0.751)、0.612(0.581 ~0.736)、0.564(0.427 ~ 0.703)、0.573(0.439 ~0.720)、0.668(0.593 ~0.726)、0.623(0.576 ~ 0.700)、0.665(0.590 ~0.721)、0.605(0.572 ~0.713)及0.625(0.586 ~0.709),見圖1。

圖1 兩組術后并發癥相關連續性變量ROC 曲線
2.4 多因素Logistic回歸分析 多因素Logistic 回歸分析結果顯示,Cys-C >1.45 mg/L 、年齡≤4歲、ASA 分級(Ⅲ~Ⅳ級)、DFR(1 ~2 級)、GFR≤23.86 ml/min 及手術時間>130 min 是腎積水患兒術后并發癥發生的獨立危險因素(均P <0.05),見表2。

表2 多因素Logistic 回歸分析
2.5 構建腎積水患兒術后并發癥發生風險的Nomogram 模型 將Cys-C、年齡、ASA分級、DFR、GFR及手術時間作為預測腎積水患兒術后并發癥發生風險的Nomogram 模型預測指標,見圖2。
2.6 Nomogram 模型內部驗證及DCA分析 內部驗證結果顯示,Nomogram模型預測腎積水患兒術后并發癥發生風險的C-index 為0.793(95%CI:0.720 ~0.859)。校準曲線結果顯示,Nomogram模型的預測值與真實值之間保持較好一致性,見圖3。Nomogram 模型預測腎積水患兒術后并發癥發生風險的AUC 為0.817(95%CI:0.738 ~0.871),見封三彩圖2。
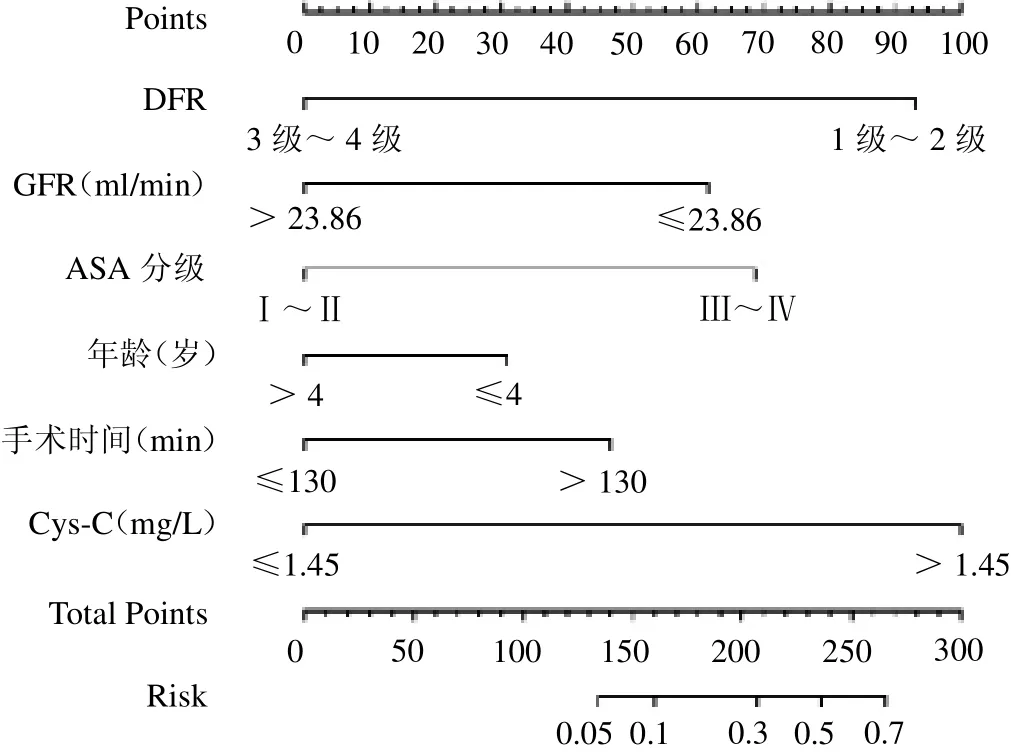
圖2 腎積水患兒術后并發癥發生風險的Nomogram 模型
DCA 結果顯示,Nomogram 模型預測腎積水患兒術后并發癥發生風險閾值>0.11,此Nomogram 模型可提供額外的臨床凈收益;Nomogram 模型臨床凈收益均高于Cys-C、年齡、ASA 分級、DFR、GFR 及手術時間,見封三彩圖3。
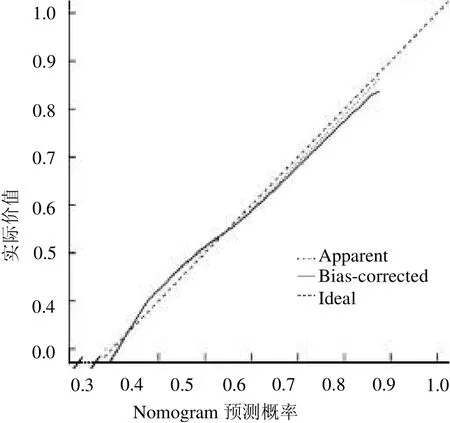
圖3 Nomogram 模型的校準曲線
3 討論
近年來,腎積水患兒術后并發癥的防治已成為臨床圍術期重點關注的焦點。因此,盡早預測腎積水患兒術后并發癥的發生風險,甄別高危患兒,對完善術后醫護方案具有重要的臨床意義。Cys-C 半胱氨酸蛋白酶抑制劑Cystatin超家族的成員,腎小球過濾后幾乎完全被近端小管重吸收[9]。不僅如此,Cys-C 水平不受種族、性別及年齡等因素影響,并且較Cr 更加靈敏[10-11]。本研究研究組Cys-C 顯著增加,而Cys-C 亦是腎積水患兒術后并發癥發生的獨立危險因素,提示患兒術前腎功能不佳可能與術后并發癥的發生風險有關。此外,本研究結果顯示年齡、ASA 分級、DFR、GFR 及手術時間也是其發生的獨立危險因素。
本研究249例腎積水患兒中有86例(34.54%)發生術后并發癥,需引起臨床醫務工作者們的注意。由于術后留置管道較多,年齡較小的患兒其控制意識較弱,亦導致管道向體內移動,造成污染,加之免疫功能尚未完善,增加術后感染等并發癥的風險[12]。研究顯示[13],患者的ASA 分級與術后不良并發癥率密切相關,分級越高,術后并發癥的發生風險就越大。另外,DFR 與GFR 等反映腎積水疾病嚴重程度的指標以及手術時間也是增加并發癥發生風險的關鍵因素,提示術前改善患兒的分腎功能及安排熟練的醫生進行手術以減少手術時間將有助于降低腎積水患兒術后并發癥的發生率。
本研究基于Cys-C并聯合其余獨立風險因素,開發了一種可以可視化預測腎積水患兒術后并發癥發生風險的Nomogram 模型。內部驗證結果顯示,Nomogram模型預測腎積水患兒術后并發癥發生風險的C-index 為0.793(95%CI:0.720 ~0.859)。校準曲線結果顯示,Nomogram 模型的預測值與真實值之間保持較好一致性。Nomogram 模型預測腎積水患兒術后并發癥發生風險的AUC 為0.817(95%CI:0.738 ~0.871)。DCA 結果顯示,Nomogram 模型預測腎積水患兒術后并發癥發生風險閾值>0.11,此Nomogram 模型可提供額外的臨床凈收益;此外,Nomogram模型臨床凈收益均高于Cys-C、年齡、ASA 分級、DFR、GFR 及手術時間。以上結果均提示該Nomogram 模型在預測術后并發癥風險方面具有良好的準確度與區分度。除此之外,本Nomogram模型中的評估指標簡單易得,更加利于臨床推廣與運用。
然而,本研究依舊存在著一定的局限性:(1)本研究為單中心回顧性研究,并且術后并發癥的不同定義均會對結果產生偏差;(2)本研究所構建的Nomogram模型性能未進行外部數據集驗證,未來需納入外部樣本數據進行更為深入的研究。
綜上所述,腎積水患兒Cys-C 水平與術后并發癥相關,基于Cys-C、年齡、ASA 分級、DFR、GFR 以及手術時間所構建Nomogram模型可用于臨床識別術后并發癥發生的高風險患兒。

