人參皂苷Rg3現代藥理作用及作用機制的研究進展
劉倩倩,樊官偉,2
天然產物在治療各種疾病方面具有獨特的治療效果。人參作為一種傳統的中草藥,對多種疾病都有防治作用。人參皂苷是人參的天然產物,具有良好的藥理作用[1]。由于人參皂苷的化學結構和物理化學性質的多樣性,不同皂苷具有不同的藥理作用。最常被研究的是Rb1、Rg1、Rg3、Re、Rd和Rh1。在這些人參皂苷中,Rg3已被證明具有廣泛的藥理活性,包括抗腫瘤[2]、抗心血管疾病、抗炎、抗病毒、抗疲勞、抗抑郁和神經保護作用[3-7]。因此,本研究綜述近年來關于Rg3的臨床和實驗研究,并總結Rg3現代藥理作用及其作用機制。
1 人參皂苷Rg3的化學結構
人參皂苷Rg3是一種人參二醇四環三萜皂苷。根據氫在碳20(C20)上的定位,人參皂苷有兩個立體異構體:20(S)和20(R)。由于構型不同,兩種結構的抗腫瘤活性也不同。
1.1 抗腫瘤 癌癥的特點是增殖不受控制、抵抗凋亡、組織浸潤和轉移,以及持續的血管生成[8]。近年來,人參皂苷Rg3已被證實可以抑制腫瘤血管生成,誘導腫瘤細胞凋亡,選擇性抑制腫瘤細胞轉移,提高機體免疫功能。總結通過體內和體外實驗獲得的人參皂苷Rg3的抗癌活性,根據現有研究,概述Rg3對腫瘤的具體作用機制如下。
1.1.1 抑制腫瘤增殖 正常體細胞的增殖能力有限,但最終細胞老化為非增殖狀態。另一方面,腫瘤細胞可以避免衰老,并具有無限增殖的潛力。大量研究表明,Rg3可以抑制腫瘤細胞的生長。通過上調活性氧(ROS)水平來抑制前列腺癌細胞系前列腺癌PC3細胞的生長來誘導細胞周期阻滯[9]。此外,Rg3能夠降低組蛋白去乙酰化酶3(HDAC3),增加p53的乙酰化作用,從而阻止A375黑色素瘤的增殖[10]。Rg3通過抑制CCAAT增強子結合蛋白β(C/EBPβ)/核轉錄因子-κB(NF-κB)信號通路,對3種人結直腸癌細胞系(HCT116、HT29、SW480)的癌細胞增殖和裸鼠移植瘤生長均有抑制作用[11]。Rg3在體內異種移植模型中抑制腫瘤生長,并在體外中對結腸癌細胞系HCT116細胞的增殖有明顯的抑制作用[12]。并通過改變凋亡相關基因(Bcl-2、Caspase-3)和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳動物雷帕霉素靶蛋白(mTOR)信號通路,誘導骨肉瘤細胞系(MG-63、U-2OS和SaOS-2)的增殖[13]。另一項實驗證實,Rg3通過減少胰島素樣生長因子-1(IGF-1)的分泌和調節Akt/mTOR通路來抑制多發性骨髓瘤細胞(U266、RPMI8226和SKO-007)的增殖并誘導細胞凋亡(Bcl-2相關蛋白失衡和Caspase激活)[14]。說明Rg3可能通過靶向PI3K/AKT/mTOR信號通路和蛋白修飾來抑制腫瘤增殖。
1.1.2 抑制腫瘤的轉移和侵襲 腫瘤轉移是指腫瘤從原發部位擴散到遠端,是導致腫瘤治療失敗和病人死亡的主要原因。Rg3對多種癌癥具有抑制侵襲和轉移的作用[15]。研究表明,Rg3可以通過抑制LncRNA結腸癌相關轉錄本1(CCAT1)的表達來抑制結腸癌的遷移和侵襲,影響凋亡相關蛋白(上調p53、Bax、Caspase-3,下調Bcl-2的表達),促進Caco-2細胞凋亡[16]。另有研究證實,20(S)-Rg3可以通過上調脯氨酸羥化酶結構域蛋白1,從而降低缺氧誘導因子1α(HIF-1α)的表達,也可能降低NF-κB的表達,從而抑制人卵巢癌細胞系(SKOV3和3AO)的遷移[17]。此外,Liu等[18]研究證實,20(S)-Rg3激活泛素-蛋白酶體途徑促進HIF-1α降解,進而導致上皮細胞特異性標記鈣黏蛋白E(E-cadherin)上調,有效抑制卵巢癌細胞和卵巢癌異種移植模型的上皮-間充質轉化(EMT)。類似結果表明,20(R)-Rg3明顯增加上皮標記的鈣黏蛋白E的表達,抑制Snail和間充質標記波形蛋白上調,抑制轉化生長因子-β1(TGF-β1)誘導的A549肺癌細胞上皮-間充質轉化,從而抑制肺癌遷移、侵襲和抗性。以上結果表明,Rg3抑制腫瘤侵襲和遷移的作用可能與上皮-間充質轉化的調控高度相關[19]。
1.1.3 誘導腫瘤細胞凋亡 細胞的死亡和更新是多細胞生物整個生命過程中不可或缺的一重要環節。它能及時清除體內多余的受損細胞。研究表明,Rg3對癌癥模型的療效常與凋亡標志物的增加有關[20]。Sin等[21]報道20(S)-Rg3通過Akt和p53/p21依賴的信號通路上調膠質瘤細胞中衰老相關β-半乳糖苷酶的表達,誘導人膠質瘤癌衰老樣生長阻滯。Rg3誘導的腫瘤細胞凋亡與抑制NF-κB信號通路,可能是通過抑制NF-κB與FUT4啟動子的結合,降低NF-κB的易位和轉錄活性,下調NF-κB下游分子的表達[22]。熱處理西洋參(HAG)產生的活性成分-20(S)-Rg3促進人胃癌細胞凋亡通過調節Bcl-2和Bax的表達和激活。Rg3增加Bax/Bcl-2,線粒體膜電位的去極化和細胞色素C增加[23]。同樣,介導的影響是通過降低細胞活力和線粒體膜電位,線粒體細胞色素C的釋放,Caspase-3和Bax蛋白的表達增加,Bcl-2蛋白的表達降低。以上研究證明Rg3誘導細胞凋亡的作用主要是針對Bax/Bcl-2、Caspase家族、PI3K/Akt、p53/p21、NF-κB/FUT4和表皮生長因子受體(EGFR)信號通路的比例。
1.1.4 抑制腫瘤血管生成 當腫瘤血管不受控制和不規則的形成時,腫瘤生長迅速。因此,抑制血管生成被認為是抑制腫瘤增殖和遷移的有效手段。膠質母細胞瘤是一種相對常見和致命的成人原發性腦腫瘤。低劑量節律學和替莫唑胺通過靶向血管生成治療膠質母細胞瘤。低劑量節律學和替莫唑胺聯合Rg3在大鼠C6膠質瘤細胞中的應用對血管生成具有加性抑制作用,可增強低劑量節律學和替莫唑胺對膠質母細胞瘤的療效[24]。Rg3與導管動脈栓塞術(TAE)聯合治療可縮小腫瘤體積、微血管密度,減少腫瘤轉移,抑制CD31和血管內皮生長因子受體 2(VEGF-R2)磷酸化的蛋白表達[25]。Rg3聯合吉西他濱治療小鼠Lewis 肺癌,不僅可增強對腫瘤生長的抑制作用,也可增加腫瘤壞死的速度,并明顯減少血管內皮生長因子(VEGF)的表達,縮小微血管密度以及血流和收縮速度峰值(PSV)[26]。此外,Guo等[27]認為Rg3通過下調血管內皮鈣黏蛋白(VE-cadherin)、Ephrina型受體2(EphA-2)的表達,明顯抑制胰腺癌中血管生成擬態的形成,基質金屬蛋白酶-2(MMP-2)和基質金屬蛋白酶-9(MMP-9)蛋白及mRNA水平。Chen等[28]研究表明,Rg3在缺氧條件下作用于人食管癌細胞系Eca-109和786-0細胞,抑制缺氧誘導的HIF-1α、環氧化酶-2(COX-2)和NF-κB表達,降低缺氧誘導的信號轉導和轉錄激活因子3(STAT3)、細胞外調節蛋白激酶1/2(ERK1/2)和JNK磷酸化,下調VEGF表達,抑制腫瘤血管生成。Rg3被認為可以抑制內皮祖細胞(EPC)的增殖、細胞遷移、EPC管形成,并在體外減弱VEGF依賴的p38/細胞外調節蛋白激酶(ERK)信號的磷酸化級聯,同時抑制腫瘤生長和調節VEGF依賴的腫瘤血管生成[29]。總之,Rg3抑制血管生成的機制主要以VEGF、p38/ERK信號通路和ephrin受體為靶點。
1.1.5 改善免疫功能 現代免疫學的發展表明,免疫功能的穩定性在腫瘤發生發展、轉移、逆轉和回歸中起著重要作用。Rg3緩解環磷酰胺(CTX)誘導免疫抑制通過增強巨噬細胞的吞噬,增加相關免疫因子的釋放[免疫球蛋白G(IgG)、白細胞介素-2(IL-2)、粒細胞集落刺激因子(G-CSF)]和T細胞活動,并調節Th1/Th2 CTX誘導免疫抑制小鼠[30]。研究證實,肝細胞癌H22移植腫瘤20(S)-Rg3和20(R)-Rg3治療后的生長明顯抑制,含H22的小鼠免疫更強,這可能是歸因于刺激Cona誘導淋巴細胞增殖和增加Th1型細胞因子、IL-2和干擾素-γ(IFN-γ)[31]。Rg3增強紅參制劑(Rg3-RGP)對人非小細胞肺癌(H460)具有細胞毒性,促進體內淋巴細胞增殖,增強血液巨噬細胞的碳顆粒吞噬指數,說明Rg3-RGP通過間接增強免疫力發揮重要的抗腫瘤作用[32]。
2 人參皂苷Rg3治療心血管疾病
研究證明,人參皂苷Rg3對心血管疾病存在重要影響(見圖1)。Guo等[33]研究表明,20(S)-Rg3可抑制晚期糖基化終末產物(AGEs)誘導的平滑肌細胞的增殖和遷移。在動脈粥樣硬化小鼠模型中,20(S)-Rg3治療后,斑塊縮小,血管平滑肌細胞(VSMCs)增殖受到抑制。Rg3還可以通過降低三酰甘油、低密度脂蛋白。在低密度脂蛋白基因敲除(LDLR-/-)小鼠中,逆轉M1型極化為M2表型,促進動脈粥樣硬化損傷穩定性,并通過過氧化物酶體增殖物激活受體γ(PPARγ)依賴機制減輕斑塊負荷[34]。在晚期糖基化終末產物處理的巨噬細胞和糖尿病小鼠模型中,富含Rg3的紅參提取物(Rg3-RGE)不僅具有有效的降壓作用,降低自發性高血壓大鼠(SHR)病人的收縮壓和舒張壓,提高主動脈內皮型一氧化氮合酶(eNOS)磷酸化水平[35]。并且Rb1和Rg3共同給予SHR大鼠,可改善心室重構,減弱SHR心肌腎素-血管緊張素系統(RAS)活性,降低TGF-β1、腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)、白細胞介素-1(IL-1)和內皮素-1(ET-1)水平[36]。Rg3可明顯降低收縮壓、舒張壓和腎素活性(RA),增強對血管緊張素Ⅰ轉換酶的抑制作用,增加一氧化氮(NO)的含量,發揮降壓作用[37]。Rg3通過增加左室縮短和射血分數,降低左室舒張末期內徑、收縮壓和左室內壓變化速率(±dp/dt),抑制凋亡細胞Caspase-3活化,降低TNF-α和IL-1水平,誘導心肌缺血再灌注SD大鼠心功能障礙[7]。另一項實驗利用心肌缺血再灌注損傷大鼠模型和新生大鼠心肌細胞(NRC)來研究Rg3的藥理作用,結果表明,Rg3通過Akt/eNOS信號和Bcl-2/Bax通路發揮心肌缺血再灌注誘導的細胞凋亡的心臟保護作用。Rg3可降低左心室射血分數和左心室短軸縮短率,促進細胞活力,減少氧化損傷和細胞凋亡,從而改善阿霉素誘導的心臟毒性[38],并且F127膠束聯合使用阿霉素可降低阿霉素的心臟毒性,改善線粒體和代謝功能,減少ROS的產生,從而對心臟發揮保護作用[39]。
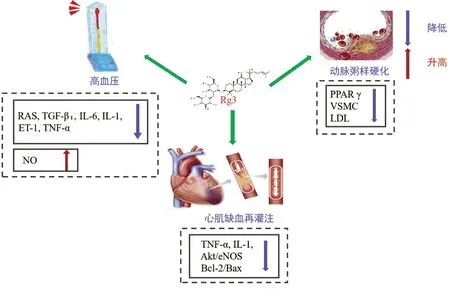
圖1 人參皂苷Rg3治療心血管疾病
3 人參皂苷Rg3對其他疾病的藥理活性
人參皂苷Rg3除了對腫瘤、心血管疾病有明顯的藥理作用,另外有部分文獻表明,Rg3還具有抗炎、抗病毒、抗抑郁、抗疲勞、抗衰老、減輕肺損傷的藥理特性。
3.1 神經保護作用 Rg3是一種具有神經保護作用的原人參二醇。Kim等[40]研究了Rg3對大鼠脊髓損傷(SCI)的神經保護作用,實驗數據表明,Rg3可抑制脊髓損傷后的神經元凋亡和炎癥反應,可明顯恢復運動功能,減少脊髓組織損傷。Rg3可以保護神經元免受朊病毒蛋白(PrP)誘導的細胞毒性和由自噬通量引起的線粒體損傷。Rg3降低cocl2誘導的PC12細胞損傷模型的ROS,抑制缺血/再灌注損傷大鼠細胞凋亡,增加線粒體膜電位,縮小腦梗死體積,改善顱神經功能障礙[41]。糖皮質激素地塞米松降低神經SHSY-5Y細胞活力,增加大鼠腦器官類型海馬切片培養細胞mRNA表達,導致神經元死亡,而Rg3和Rb1可以逆轉地塞米松的損傷作用[42]。因此,Rg3主要通過抑制神經元凋亡和神經毒性對神經發揮保護作用。
3.2 抗炎作用 炎癥是一種重要的生理反應,由于炎癥介質的持續釋放,炎癥與大多數疾病有關。Rg3通過抑制NF-κB介導的細胞因子/趨化因子[如白細胞介素-4(IL-4)、TNF-α、嗜酸性粒細胞趨化因子],調節NF-κB的活性,對A549細胞和人哮喘氣道上皮組織中IL-1誘導的炎癥產生抗炎作用[43]。Rg3在人類肥大細胞-1(HMC-1)和大鼠嗜堿性細胞白血病細胞RBL-2H3中,通過抑制促炎細胞因子的產生,提高環磷酸腺苷(cAMP)水平和鈣流入減少組胺釋放激活肥大細胞,調節絲裂原活化蛋白激酶(MAPK)/NF-κB和受體相互作用蛋白激酶2(RIP2)/Caspase-1信號通路發揮抗過敏作用[44]。Rg3通過誘導M2標記基因的表達,抑制M1標記基因的表達,促進巨噬細胞M2極化,加速炎癥反應的消退[45]。20(R)-Rg3通過抑制氧化應激和炎癥反應,激活PI3K/Akt信號通路,減輕肝細胞壞死和凋亡。Hou等[3]用Rg3和Rh2治療三甲基素中毒誘導的小鼠模型的神經退行性變,結果表明,Rg3和Rh2可明顯降低三甲基素誘導的癲癇發作和行為改變,減輕氧化應激反應和神經炎癥反應,選擇性上調PI3K/Akt,抑制ERK激活。Rg3能夠通過調節誘導型一氧化氮合酶(iNOS)的表達來抑制NO的產生,從而抑制NOD樣受體熱蛋白結構域相關蛋白3(NLRP3)的致死性內毒素休克和炎癥小體的s-亞硝基化和白細胞介素-1β(IL-1β)的產生。Rg3還能抑制脂多糖或紫外線照射誘導的巨噬細胞和人永生化表皮細胞(HaCaT)中的ROS水平,從而防止脾細胞凋亡。因此,Rg3可能作為治療炎癥和氧化應激相關疾病的雙重治療調節劑[46],并主要靶向PI3K/AKT、MAPK/NF-κB信號通路和炎性因子。
3.3 抗病毒 據報道,口服Rb2及其水解液20(S)-Rg3可以預防輪狀病毒(RV)感染。研究人員使用1.5×10斑塊形成單位/RV菌株SA11治療新生小鼠(10 d齡),評價人參皂苷對RV感染的保護作用。結果表明,持續給藥20(S)-Rg3可降低RV感染小鼠腸道內的病毒滴度,并預防了RV感染[47]。此外,Rg3治療丙型肝炎病毒(HCV)感染的細胞,使HCV核心蛋白介導的細胞質p21表達水平的降低,這是增加周期蛋白依賴性激酶1活性所必需的。在HCV誘導的線粒體裂變后,Rg3也能恢復HCV誘導的線粒體裂變后的線粒體自噬[4]。另一項實驗證實,Rg3通過降解腫瘤壞死因子受體相關因子6/轉化生長因子活化激酶-1和抑制c-Junn端激酶/AP-1信號通路,減少了乙肝表面抗原、e抗原和乙肝病毒顆粒的分泌[48]。
3.4 抗抑郁 抑郁癥是一種心理健康問題,定義為無休止的抑郁情緒。疲勞、疼痛、對預期活動失去興趣和睡眠障礙是抑郁情緒中出現的一些身體特征。Rg3可以通過調節免疫發揮抗抑郁作用。Kang等[49]在尾懸掛試驗和強迫游泳試驗抑郁動物模型中通過脂多糖誘導小鼠抑郁樣行為。Rg3治療后,小鼠血漿IL-6和TNF-α水平升高,吲哚-2,3-雙加氧酶(IDO)mRNA表達降低,色氨酸-犬尿氨酸代謝恢復。此外,Rg3通過改變N-甲基-D-天門冬氨酸(NMDA)處理的HT22小鼠海馬神經元的細胞周期來恢復細胞增殖并抑制細胞凋亡。Rg3通過磷酸化cAMP反應元件結合蛋白(CREB)和激活腦源性神經營養因子(BDNF)信號通路來介導抗抑郁作用,從而介導慢性輕度應激模型中明顯的生理和行為變化[50]。在慢性社會挫敗應激(CSDS)抑郁模型中,Rg3恢復了CSDS誘導的海馬BDNF信號通路的衰減,并預防了CSDS引起的抑郁癥狀[6]。
3.5 抗疲勞 Rg3被證明可以緩解疲勞,疲勞這是一種伴隨各種情況的非特異性癥狀。有研究建立大鼠術后疲勞綜合征(POFS)模型,結果表明,Rg3明顯增加了進食頻率,減緩了休息時間,激活沉默信息調節因子1(SIRT1),抑制了p53的轉錄活性,因此,Rg3可能通過提高運動表現和增加沉默信息調節因子1去乙酰化酶活性來預防疲勞[5]。采用多步乳化法制備了裝載Rg3的殼聚糖微球,發現裝載Rg3的殼聚糖微球可延長小鼠負重游泳時間,上調肝糖原、乳酸脫氫酶水平,降低乳酸和血清尿素氮水平,從而發揮抗疲勞作用[51]。在疲勞動物模型中建立負重強迫游泳,發現疲勞導致多巴胺的減少,這可能部分是由于酪氨酸羥化酶表達和磷酸化的變化,而Rg3逆轉了這些疲勞誘導的病理變化。可能的機制包括調控蛋白激酶Aα(PKAα)、ERK1/2、Akt和α-突觸核蛋白活性(α-synuclein)[52]。
3.6 抗衰老 近年來,從面霜到面膜,抗衰老補充劑都被用于延緩或中止衰老。這些補充劑大多含有來自天然來源的成分或天然產品。20(S)-Rg3通過下調PI3K/Akt、mTOR和激活sirtuin3/過氧化物酶體增殖物激活受體γ輔激活因子1α(PGC1α)來促進線粒體生物發生,從而逆轉人真皮成纖維細胞(HDFs)的復制衰老[53]。蛋白質組學方法表明,20(S)-Rg3通過誘導線粒體過氧化物還原蛋白(PRDX3)的轉錄和翻譯增加,至少部分逆轉了HDFs的衰老[54]。Lee等[55]發現Rg3可以恢復三磷酸腺苷(ATP)和膜電位,增加紫外線輻射誘導的損傷皮膚細胞的細胞增殖基因和細胞外基質蛋白的表達。這說明Rg3通過靶向PI3K/Akt/mTOR信號通路調節線粒體功能,發揮抗衰老作用。
3.7 減輕肺損傷 急性肺損傷是一種常見的臨床疾病。Yang等[56]研究了Rg3對脂多糖誘導的小鼠急性肺損傷的影響,發現Rg3降低了促炎介質(包括TNF-α、IL-1β和IL-6)水平,并增加了抗炎細胞因子[白細胞介素-10(IL-10)和腫瘤壞死因子-β(TGF-β)]的產生,以減輕脂多糖誘導的小鼠急性肺損傷。其潛在的機制是通過MERTK依賴的激活和下游的PI3K/Akt/mTOR信號通路來介導的。此外,脂多糖誘導的急性肺損傷導致病理改變,包括上調NF-κB/p65磷酸化和下游COX-2表達,觸發肺組織中NF-κB信號,增加肺干重比(W/D)和促炎細胞因子水平。與預期的一樣,Rg3干預逆轉了脂多糖誘導的急性肺損傷的病理改變[57]。雖然Rg3對BEAS-2B細胞的增殖和凋亡沒有明顯影響,但Rg3通過抑制炎癥反應和激活PI3K和MAPK信號通路來預防高血糖誘導的肺損傷[58]。因此,Rg3減少肺損傷的靶點始終圍繞著PI3K/Akt/mTOR/NF-κB/MAPK信號通路抑制炎癥。
4 小結與展望
人參皂苷Rg3作為一種活血產品,預防腫瘤術后復發轉移,具有廣闊的發展前景。Rg3還能抵抗心血管疾病,發揮神經保護功能,以及抗炎、抗病毒、抗抑郁、抗疲勞、抗衰老,減輕肝、肺損傷。實驗已經證實,當Rg3作用于心臟、肝、肺、腎、骨髓和神經系統時,它是相對安全的。然而,Rg3有其局限性。首先,Rg3在全球范圍內的應用范圍較窄,而Rg3在我國主要用于癌癥治療,在心血管疾病,神經保護等方面的藥理作用并未得到有效的開發,Rg3的口服生物利用度較低也限制了Rg3的應用。仍有必要評估這些優化療法的體內療效,開發新的Rg3類似物提高生物利用度特性。而且,基于這些研究,還沒有進行實際的臨床治療。目前迫切需要對Rg3的詳細、合理的分子機制進行研究,以證實其有效性和更好的臨床應用。

