宏基因組二代測序在惡性血液病并發感染患者中的診斷價值
王曉芳,馮靖
(1.天津醫科大學總醫院呼吸內科,天津 300052;2.天津市職業病防治院綜合內科,天津 300011)
感染在惡性血液病患者治療過程中較常見[1],是免疫功能低下患者死亡的主要原因,合理地使用抗菌藥物能夠改善患者預后[2]。惡性血液病患者由于接受腫瘤放化療、長期使用糖皮質激素或免疫抑制劑導致免疫功能受到抑制,易同時感染多種病原菌,臨床往往僅表現為發熱,多數患者感染部位不明確。目前臨床常用的檢測方法包括病原體檢測(如血尿便、分泌物及肺泡灌洗液等標本的培養)、炎癥指標、影像學檢查等,臨床醫師可結合這些常用的檢測方法經驗性選擇抗菌藥物,但是這些傳統的檢測方法檢出陽性率低、特異性差,往往不能同時檢測出多種病原菌,特別是對于真菌、病毒以及特殊病原體的檢測,導致經驗性抗感染治療往往只能覆蓋部分致病菌甚至未能覆蓋,延誤診治。且有部分免疫功能低下患者,同時并發細菌、真菌和病毒感染,增加了病原學診斷的難度。臨床上急需一項快速準確的診斷方法。
宏基因組二代測序(metagenomic next-generation sequencing,mNGS)是近年來快速發展的病原學診斷方法,能夠在單次實驗中檢測100 萬個以上堿基對的核酸序列,序列數可以與基因組數據庫比對,從而識別病原體[1-3]。能夠快速識別病原體,24~48 h內可獲得結果[4];并且可同時檢測多種病原體,提供病原菌物種、菌株、抗生素耐藥性,甚至毒力等特征。對于惡性血液病并發感染的患者而言,快速準確地做出病原菌的診斷至關重要。因此本研究回顧性分析了mNGS 在惡性血液病并發感染患者中的臨床數據,提示mNGS 檢測聯合傳統的檢測方法可對臨床醫生合理應用抗菌藥物提供幫助。
1 對象與方法
1.1 研究對象 收集2019 年1 月—2020 年12 月就診于天津市第一中心醫院血液科的惡性血液病患者。納入標準:(1)明確診斷為惡性血液病。(2)長期服用激素或其他免疫抑制劑或多次經過腫瘤放化療導致免疫功能低下。(3)同時完善血培養和血漿mNGS。(4)發熱(體溫>37.5℃)考慮可能為感染。排除標準:(1)病史資料不全的患者。(2)標本培養結果考慮為污染的患者。本研究已獲得天津市一中心醫院倫理委員會批準,符合倫理要求。所有受試者均知情同意。
共納入患者190 例,其中男性132 例,女性58 例,中位年齡49(10~81)歲,常見基礎疾病分別為:急性髓系白血病77 例(40.53%)、急性淋巴細胞白血病48 例(25.26%)、淋巴瘤24 例(12.63%)、骨髓增生異常綜合征11 例(5.79%)、多發性骨髓瘤5 例(2.63%)、原發性骨髓纖維化4 例(2.11%)、其他21例(包括華氏巨球蛋白血癥、淀粉樣變性、Castleman 病等)。
1.2 研究方法
1.2.1 樣本的收集及處理 于患者寒戰時或體溫峰值前半小時,同時采集血漿mNGS 和血培養。血培養樣本送往天津市第一中心醫院微生物實驗室進行培養;mNGS 樣本在2 h 內送往天津華大基因實驗室,完善DNA 提取和文庫制備,應用MGISEQ-2000 基因測序儀完成樣本中微生物核酸片段的序列測定,與基因組數據庫進行比對,用來識別病原體。
1.2.2 mNGS 陽性標準 所有mNGS 結果均在48 h內回報,陽性標準如下:(1)細菌或病毒:覆蓋率比任何其他微生物高10 倍。(2)真菌:覆蓋率比任何其他真菌高5 倍。(3)在該處>30%的相對豐度細菌、病毒或真菌中的屬水平。(4)結核分枝桿菌:由于DNA 提取困難和污染可能性低,至少有一個序列數[5]。
1.2.3 臨床診斷參考標準 根據醫院感染診斷標準(試行)[6],依據患者臨床癥狀、體征、傳統的病原菌檢測結果以及對治療的反應做出綜合診斷。抗感染有效定義為:患者使用抗菌藥物72 h 后體溫峰值下降0.5℃或7 d 后無發熱[7]。
1.3 統計學處理 對所有納入的190 例患者的檢測結果進行分析,建立Excel 表格并分類錄入數據。頻數資料采用例數及百分比(保留兩位百分比);應用SPSS22.0 統計學軟件進行數據分析,通過Pearson χ2檢驗或McNemar 檢驗對離散變量進行比較分析,對符合正態分布的計量資料以±s 表示,采用t檢驗,對于不符合正態分布的計量資料,應用Mann-Whitney U 檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 mNGS 結果分析 mNGS 檢測結果顯示共檢測出68 種病原微生物,其中細菌45.59%(31/68)、病毒26.47%(18/68)、真菌20.59%(14/68),其他為非典型病原體7.35%(5/68)。最常見的細菌、真菌、病毒分別為葡萄球菌、熱帶念珠菌和細環病毒。按照種屬分布,常見細菌、真菌、病毒的分布如圖1~3。此外根據mNGS 結果,同時檢出混合病原體的患者為35.79%(68/190),分別為細菌+病毒、細菌+真菌、病毒+真菌及細菌+病毒+真菌。
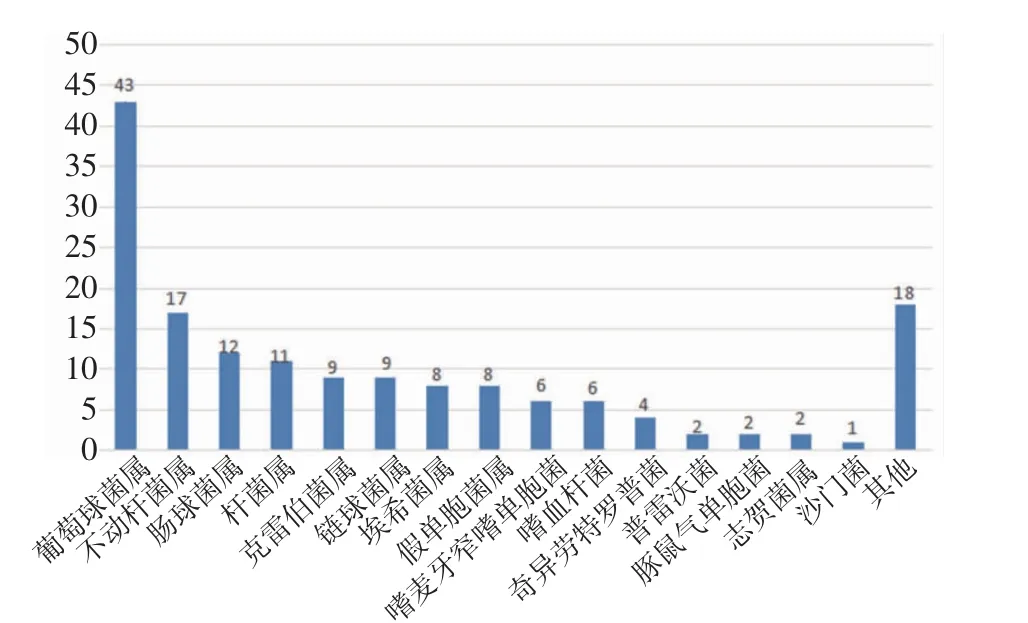
圖1 細菌菌屬分布Fig 1 Bacterial genus distribution
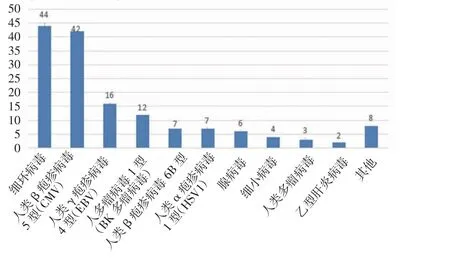
圖2 病毒種類的分布Fig 2 Distribution of virus species
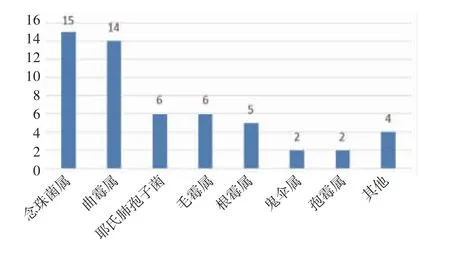
圖3 真菌菌屬的分布Fig 3 Distribution of fungal genera
2.2 mNGS 與血培養陽性率比較 190 例患者中mNGS 陽性率為77.37%(147/190),血培養陽性率為8.02%(13/190),mNGS 陽性率顯著高于血培養(χ2=13.36,P<0.01)。其中,mNGS 檢出細菌的陽性率為46.80%(89/190),血培養檢出細菌陽性率為92.30%(12/13),血培養檢出細菌陽性率較mNGS 高(χ2=4.69,P<0.05);mNGS 在真菌檢測中陽性率為24.74%(47/190),血培養陽性率為7.70%(1/13),mNGS 檢出真菌的陽性率高于血培養(χ2=3.84,P<0.05);病毒均在mNGS 中可檢測到。
2.3 mNGS 與血培養所需時間的比較 從實驗室獲取標本開始直至結果的匯報,血培養所需要時間平均為(102.31±12.31)h,而mNGS 為(29.18±3.28)h,兩者之間存在顯著差異(t=22.37,P<0.01)。
2.4 mNGS 診斷性能及其與血培養的一致性分析 根據臨床醫師的最終診斷,考慮為感染的患者數為162 例(85.26%),非感染患者數為17 例(8.95%),臨床尚未確定的患者數為11 例(5.79%)。血培養檢測到的致病菌在血mNGS 中均被檢測到。根據最終臨床診斷,mNGS 的敏感性為80.25%,特異性為47.06%,陽性預測值為93.53%,陰性預測值20%。血培養的敏感性為8.02%,特異性為100%,陽性預測值為100%,陰性預測值為10.24%。mNGS 敏感性高于血培養(χ2=10.83,P<0.01),特異性低于血培養(χ2=8.21,P<0.01)。
2.5 mNGS 與血培養檢測病原體分析 13 例mNGS 和血培養均為陽性。分析兩種檢測方法的結果:1 例患者結果完全一致,為單核細胞李斯特菌。11 例患者結果部分一致,血培養及mNGS 培養均檢測到的病原體為:大腸埃希菌、肺炎克雷伯桿菌、人葡萄球菌、鮑曼不動桿菌、熱帶念珠菌。mNGS 檢測到而血培養未檢測到的病原體主要涉及赤曲霉、人類皰疹病毒5 型(CMV)、JC 多瘤病毒、鬼傘屬、近平滑念珠菌、輪生鐮刀菌。1 例完全不一致,血mNGS為熱帶念珠菌,血培養為紋帶棒狀桿菌。
2.6 mNGS 檢測對臨床抗感染治療的影響 190 例患者在接受經驗性抗感染治療后完善mNGS 結果,抗菌藥物覆蓋情況如圖4,部分患者抗病毒和抗真菌為預防用藥。根據mNGS 結果,75 例(46.30%)患者調整抗菌藥物使用后,評價有效率為49.30%。值得注意的是,87 例患者未根據血漿mNGS 的結果調整抗感染治療方案,考慮并非所有檢出病原體均為致病菌,61 例(37.65%)患者因經驗性抗菌藥物已經覆蓋所檢測出的致病菌而未調整抗感染方案,26例(16.05%)患者考慮檢出病原體為非致病菌(如細環病毒等定植微生物),因而未調整抗菌藥物。
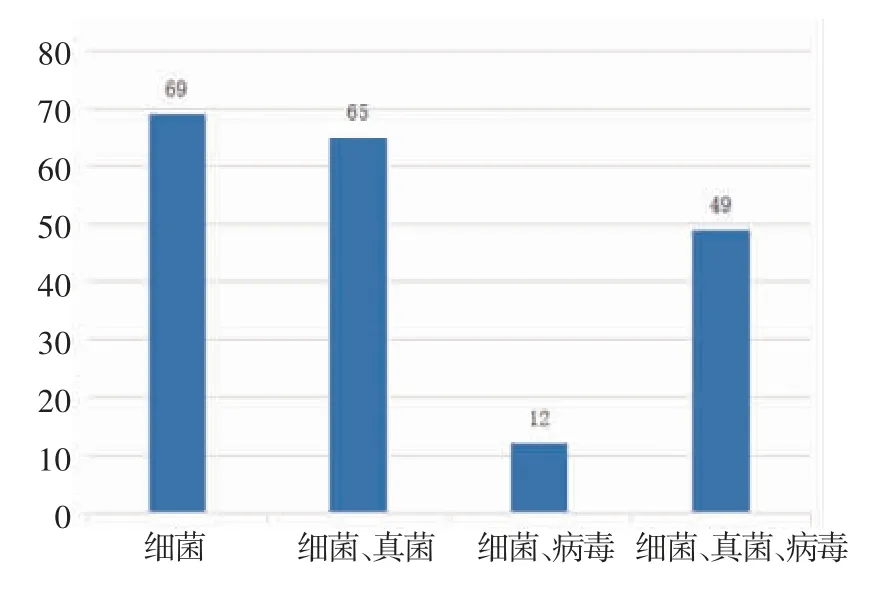
圖4 預防性抗生素覆蓋情況Fig 4 Prophylactic antibiotic coverage
3 討論
惡性血液病是骨髓、造血組織和淋巴組織發生的惡性腫瘤,如各類白血病、骨髓增生異常綜合征、骨髓增殖性腫瘤、漿細胞疾病、霍奇金和非霍奇金淋巴瘤等。此類疾病病情進展迅速,死亡率高。早期規范放化療或行造血干細胞移植可延緩疾病進展,部分患者甚至可達到完全緩解狀態。但與此同時,放化療出現骨髓抑制導致患者免疫功能低下增加感染風險,導致死亡率升高。因此早期對惡性血液病并發感染的患者進行病原學診斷至關重要,可降低此類患者死亡率。因此本文對190 例惡性血液病患者進行回顧性分析,血漿mNGS 的病原菌檢出率為77.37%。Shen 等[8]在國家兒童健康臨床研究中心兒童醫院血液科的發熱住院患者中統計發現,傳統微生物檢測在7.14%的患者中發現致病微生物,當常規檢測陰性時,mNGS 報告病原體檢測率為57.40%。筆者結果似乎較既往研究高,這可能有免疫功能低下患者容易受到感染及入組患者特征不同等因素的影響。細菌是190 例患者中檢出率最高的病原菌(49.2%),最常見的細菌、真菌、病毒分別為人葡萄球菌、熱帶念珠菌和細環病毒。
傳統的血培養陽性率通常在10%左右[9],免疫缺陷患者由于多種廣譜抗生素的使用,使血培養檢出率更低。本研究表明,mNGS 敏感性高于血培養(P<0.001),但是特異性低于血培養(P=0.004),敏感性與既往研究報告中結果基本一致[10]。mNGS 特異性低,可能與其血漿樣本檢測的是游離核酸片段,可能是活病原生物基因組純化,也有可能是已經死亡病原生物脫落的核酸碎片有關,因此導致檢測結果與臨床預期不符。
傳統的檢測方法(包括血培養)很難同時檢測出多種病原體。而惡性血液病患者常常由于化療等原因導致免疫功能缺陷,極易導致機會致病菌感染。本研究中,162 例考慮感染的患者中,有13 例血培養與mNGS 檢測結果均為陽性。其中1 例檢測到的病原體完全一致,為單核細胞李斯特菌。12 例部分一致,其余1 例完全不一致。兩種檢測方法部分一致匹配的病原體為大腸埃希菌、肺炎克雷伯桿菌、人葡萄球菌、鮑曼不動桿菌、熱帶念珠菌。部分不一致和完全不一致的主要涉及病毒和部分真菌。結合患者病情特點考慮為混合病原體感染。根據藥敏結果加用抗生素的同時,依mNGS 檢測結果分別加用抗病毒和抗真菌治療,72 h 后患者未再發熱。190 例患者中mNGS 結果為多種病原體(細菌+病毒、病毒+真菌、細菌+真菌+病毒)的比例為35.79%。與免疫功能正常的患者相比,免疫功能低下患者中易發現更多的混合病原體[11]。文獻表明,mNGS 在診斷病毒方面的敏感性低于PCR,但它能夠檢出常規方法檢測不到的病毒[12],且對細菌和真菌的陽性率顯著高于血培養(P<0.001)。同時mNGS 在(29.18±3.28)h 內可診斷出病原體,而普通血培養往往長達(102.31±12.31)h,檢測速度快是mNGS 的優勢之一。對于惡性血液病并發感染患者,尤其化療后粒細胞缺乏感染部位不明確的人群,及早快速準確的獲得病原體類型,對于降低患者死亡率至關重要。因此mNGS 可作為傳統檢測的一種有效補充手段,結合病原體檢測結果指導抗病原微生物藥物的選擇,從而優化抗感染治療。
值得注意的是,根據血漿mNGS 結果,75 例(46.30%)患者的經驗性抗感染治療未覆蓋或未完全覆蓋病原菌,經過調整后,評價有效率為49.30%。其中51/101(50.50%)例根據血漿mNGS 結果調整抗菌藥物的使用,26/51 例患者經過調整后評價有效率為50.99%。此外,惡性血液病并發感染患者由于免疫功能缺陷,經常使用大量抗生素,不僅易導致耐藥,甚至可能影響患者的預后[13]。筆者根據mNGS結果對使用不恰當的抗生素降級或停止,并且未產生不良預后。該結果與既往的研究一致[14]。因此,在經驗性使用抗菌藥物后,傳統的病原學診斷方法受限制時,mNGS 可以幫助臨床醫生調整抗感染方案。
目前有文獻表明,肺泡灌洗液、肺組織、腦脊液、皮膚和軟組織等感染部位的mNGS 可用于病原菌的診斷,病原菌檢出率可達80%以上[14-20]。然而對于惡性血液病患者,部分不能耐受或者不能接受肺泡灌洗或者肺組織活檢等有創操作,血漿標本相比而言更易獲得。惡性血液病并發感染患者臨床可能僅表現為發熱,多數沒有明確的感染灶,血漿mNGS與傳統的檢測方法如胸部CT、培養、PCR 等相結合,可使得病因學診斷更準確。然而,尚不能確定血漿mNGS 陽性是否可直接診斷為菌血癥或明確感染部位。
總之,本研究表明,mNGS 與傳統的檢測方法相比,能夠及時、準確的幫助臨床醫師進行病原學診斷,及時調整抗生素的使用,這對惡性血液腫瘤并發感染的患者至關重要。
但是本研究是有一定的局限性的,如樣本量較少,患者基礎疾病診斷種類較多。盡管NGS 在感染患者中已被廣泛接受和應用,但敏感性較高,其結果易受到污染等因素的干擾,尚無統一的標準來修改或指導臨床治療策略,特別是對于一些疑難雜癥,限制了其在臨床研究中的應用。盡管存在一些局限性,但本研究表明,mNGS 可以幫助臨床醫生迅速調整抗菌藥物,具有一定的臨床意義。

