股腘動脈閉塞癥的診斷和治療中國專家共識
國家心血管病專家委員會血管外科專業委員會下肢動脈疾病學組,中國醫藥教育協會血管外科專業委員會
在下肢動脈疾病(lower extremity artery disease,LEAD)中,股腘動脈閉塞癥約占47%~65%[1]。股腘動脈閉塞癥可造成間歇性跛行、慢性肢體威脅性缺血等一系列臨床癥狀,對患者的生活質量、肢體乃至生命構成嚴重威脅。合理選擇股腘動脈閉塞癥的治療適應證、正確選擇恰當的治療技術和器械、提高治療的規范性是取得良好療效的重要因素。鑒于中國人群股腘動脈的解剖特點、國內外治療器械的差異和我國中西醫結合治療的特色,亟需提出適合中國人群特點的診療規范推薦意見,從而為國內血管外科醫師提供最新的臨床實踐依據。在LEAD 的病理分型中動脈硬化性閉塞最為常見,由此,本共識主要闡述股腘動脈閉塞癥的相關診治問題。
1 流行病學與臨床表現
2010 年的統計數據顯示,全球LEAD 患者人數為20 200 萬人,且在過去的10 年增長了13.1%~28.7%[2]。2015 年,全球LEAD 患者人數增加至23 662 萬人,其中72.9%生活在中低收入國家,中國所在的西太平洋地區患病人數達到7 408萬人[3]。一項納入4 055 名60 歲以上中國人群研究中,男性和女性LEAD 患病率分別為2.9%和2.8%[4]。目前,中國≥80 歲高齡老人正以每年5%速度遞增,LEAD 發病率也隨之增加[5]。Song 等[6]曾預測2000~2020 年中國的LEAD 患者增長率可達40%,即從2000 年的2 944 萬增加至2020 年的4 113 萬,其中約70%的患者生活在農村地區。國內外均缺乏明確的股腘動脈閉塞癥統計數據。
影響LEAD 發病率的高危因素主要有性別、年齡、吸煙、糖尿病、高血壓、血脂異常、高同型半胱氨酸血癥、慢性腎功能不全等,此外,種族、炎性指標增高、高血黏度和血液高凝狀態也被認為與其發病有關[7]。
一般以靜息狀態下的踝肱指數(ABI)≤0.9 作為診斷LEAD 的標準。根據臨床表現可分為無癥狀性和癥狀性兩大類,兩者的比例為3:1~4:1[7]。癥狀性LEAD 主要表現為間歇性跛行和慢性肢體威脅性缺血。臨床上常用的分期方法有Fontaine 分期和Rutherford 分級(表1)[7]。
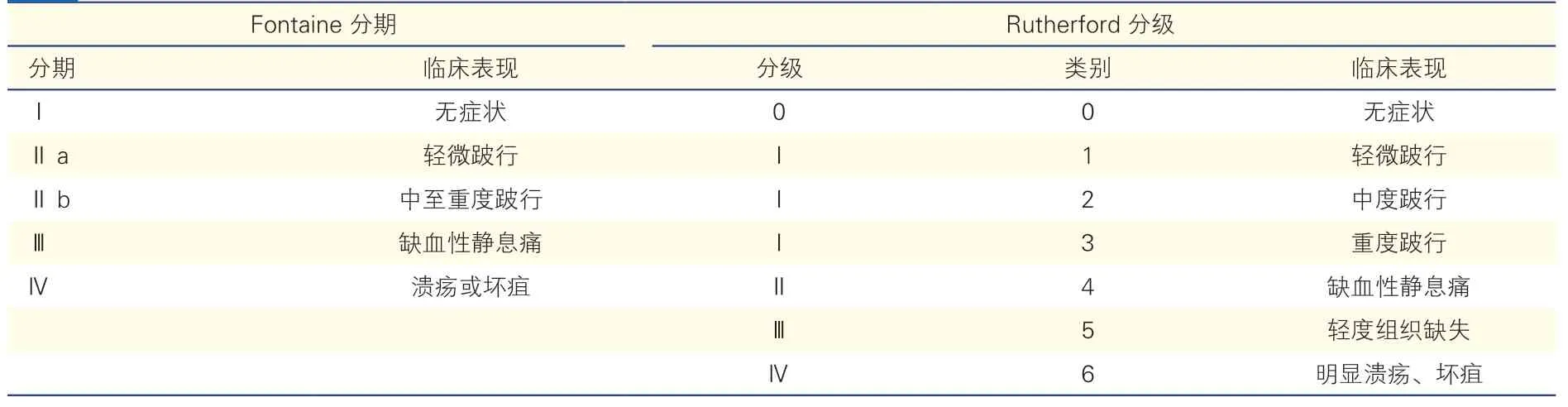
表1 下肢動脈疾病的臨床分期
推 薦
·對于有動脈硬化高危因素的人群,即個人或家族成員有心腦血管疾病或LEAD 史者,如果有下肢間歇性跛行等癥狀,建議常規進行篩查。
·確診LEAD 患者臨床分期建議使用Fontaine 分期或Rutherford 分級。
2 診斷和鑒別診斷
詳細了解患者病史對LEAD 的診斷至關重要。病史包括:(1)臨床癥狀:早期或無明顯癥狀,也可有涼麻不適等表現;典型癥狀主要為間歇性跛行、靜息痛、潰瘍和壞疽。(2)體征:皮溫下降,皮色蒼白或青紫;毛發脫落、皮膚菲薄;動脈搏動減弱或消失;肢體遠端潰瘍或壞疽。(3)生活史、疾病史和家族史:包括吸煙、肥胖、糖尿病、高血壓、血脂異常、心腦血管疾病史、慢性腎臟病史等。(4)輔助檢查:測量ABI 是臨床最常用的無創檢查方法,尤其適用于無癥狀患者的篩查和血運重建手術前后的動態評估[8]。ABI 正常值為1.00~1.40,≤0.90 為異常,0.91~0.99 為臨界異常,>1.40 表明血管嚴重鈣化或彈性減低。當ABI 臨界異常或者靜息ABI正常而仍高度懷疑下肢動脈病變時,可行ABI 運動試驗,運動后下肢動脈收縮壓下降>30 mmHg(1 mmHg=0.133 kPa)或ABI 下降20%即可診斷LEAD[9]。彩色多普勒超聲是診斷LEAD 的首選影像學檢查手段,CT 血管造影(CTA)、磁共振血管成像(MRA)和數字減影血管造影(DSA)則對病變評估、手術方法及入路選擇具有重要意義。
需與動脈硬化性股腘動脈閉塞癥相鑒別的主要疾病有血栓閉塞性脈管炎、多發性大動脈炎、急性肢體缺血及其他引起股腘動脈閉塞或下肢間歇性跛行的疾病,包括巨細胞血管炎、血管白塞病、腘動脈陷迫綜合征、動脈外膜囊性病變等。引起下肢間歇性跛行的原因很多,如腰椎間盤突出、椎管狹窄引起的神經源性間歇性跛行,靜脈性間歇性跛行、骨關節炎性間歇性跛行等,均需與股腘動脈閉塞癥的癥狀相鑒別[7]。
推 薦
·詳盡的病史采集和體格檢查對明確LEAD診斷至關重要。
·對于有間歇性跛行等臨床癥狀者,建議先采用無創血管動力學或形態學檢查,如ABI 和下肢血管彩色多普勒超聲檢查。
·為進一步明確病變程度,推薦進行CTA、MRA 或DSA 檢查,以方便提供血運重建的解決方案。
·臨床上對于有間歇性跛行癥狀的患者,需注意和其他血管免疫性疾病、血管炎性疾病以及來自神經源性跛行和靜脈性跛行等進行鑒別。
3 股腘動脈的解剖學特點及股腘動脈閉塞癥的分型
3.1 股腘動脈的解剖學特點
股總動脈由髂外動脈延續而來,分為股淺動脈和股深動脈,前者在股三角內、縫匠肌深面向下至大腿中下段進入大收肌腱裂孔和股骨組成的收肌管內,稱為收肌管段,穿過收肌管出口后延伸為腘動脈。腘動脈又以臏骨上緣和脛骨內外側髁連線自上而下分為P1、P2 和P3 段。
有關中國人群股腘動脈直徑的數據甚少,AcoArt I 和Reewarm 兩個國產藥物涂層球囊(DCB)的隨機對照研究報告的數據分別為(3.74±0.83)~(3.83±0.57)mm 和(3.9±0.8)mm[10-11]。同 為東亞人種的日本的研究結果顯示相關數據為(4.68±0.68)~(4.84±0.75)mm[12]。這種差異可能與國內研究所用的測量方式多為DSA 測量內膜至內膜的直徑有關,而日本的研究使用血管內超聲(IVUS)的比例較高,其測量外彈力膜至外彈力膜的直徑的方法為目前公認的更接近于真實血管直徑的測量方法。
3.2 股腘動脈的生物力學特點
股腘動脈在不同體位時產生的生物力學變化主要有軸向短縮、彎曲和扭轉,并還承受著下肢肌肉運動時產生的徑向壓縮力。Poulson 等[13]用尸體下肢動脈內預植金屬標記物后測量發現膝關節在110°(行走)、90°(坐位)和60°(園丁體位)彎曲時股淺動脈上中段、收肌管段及腘動脈的平均軸向壓縮分別為9%~15%、11%~19% 和13%~25%,最大壓縮達到38%;動脈彎曲角度分別為150°~157°、136°~147°及137°~148°。
股腘動脈在下肢運動過程中產生的復雜形態變化與動脈硬化疾病進展和動脈重建術后人工血管及支架的再狹窄、再閉塞密切相關。了解股腘動脈的復雜生物力學特點及形變情況,有助于手術方案的合理選擇和實施,也有助于推動股腘動脈治療器械的材料學及結構的改進。
3.3 股腘動脈閉塞癥的分型
2000 年跨大西洋協作組織(TASC)制定了TASC 分型,2007 年更新為TASC Ⅱ分型。其中股腘動脈部分主要根據病變的長度、分布等分為A~D 4 型[7]。
2019 年《全球慢性肢體威脅性缺血處理指南》提出了新的“全球肢體解剖分級系統(global limb anatomic staging system,GLASS)”,其中股腘動脈分級(表2)[14]與TASC 分型不同,GLASS 分級更加強調了股淺動脈開口、腘動脈和膝下三分叉幾個關鍵節點的病理意義。

表2 股腘動脈病變的GLASS 分級
推 薦
·了解下肢運動過程中股腘動脈生物力學特點及形變情況,有助于股腘動脈閉塞癥手術方法和器械的合理選擇,從而提高中遠期療效。
·股腘動脈閉塞癥的TASC 分級和GLASS 分級系統對于規范治療、統一評估標準具有指導意義,有利于本病相關臨床研究的標準化。
4 治療
4.1 非手術治療
多數無癥狀或僅有輕、中度間歇性跛行的患者,通過對其原發病的控制、改變吸煙等不良生活習慣,通過行走鍛煉及藥物治療就可以控制或改善癥狀[15]。尤其是醫生指導下的行走鍛煉能有效地改善患者的間歇性跛行癥狀,可以作為接受血運重建治療前的首選治療方案[7,9]。
LEAD 是全身動脈硬化性疾病的一部分,藥物治療包括抗栓、降壓、調脂、降糖治療等對于控制和改善全身高危因素及LEAD 本身都具有重要意義[15]。其中,抗血小板藥物是癥狀性LEAD 患者心腦血管事件的二級預防措施,阿司匹林可顯著降低癥狀性LEAD 患者主要不良心血管事件(MACE,包括非致死性心肌梗死、非致死性腦卒中及血管源性死亡)的發生率[16]。CAPRIE 研究則表明,對于癥狀性LEAD 患者降低血管源性死亡和MACE 的療效,氯吡格雷要優于阿司匹林,且其安全性不劣于中劑量阿司匹林[17]。阿司匹林聯合氯吡格雷的雙抗血小板治療對LEAD 患者的獲益并未得到證實,但血運重建術后雙抗血小板治療應至少延續1 個月[9]。在抗凝治療方面,COMPASS 和VOYAGER PAD 兩項隨機對照研究均表明,小劑量直接口服抗凝藥(DOAC)聯合阿司匹林(利伐沙班2.5 mg,2 次/d;阿司匹林100 mg,1 次/d)可改善LEAD 的臨床療效、降低主要肢體不良事件和心腦血管事件發生率,且未增加致死性大出血的風險[18-20]。
推 薦
·對于輕、中度間歇性跛行的患者,應嚴格戒煙,醫生指導下的行走鍛煉是首選治療。
·控制并治療心血管疾病相關高危因素,如降糖、調脂、降壓治療。單抗血小板治療阿司匹林或氯吡格雷適合所有癥狀性LEAD 患者。血運重建術后雙抗血小板治療應>1 個月,并可酌情延長。
4.2 血運重建治療
手術適應證:治療LEAD 的目的是提高肢體運動能力,減輕或消除癥狀,促進潰瘍愈合,降低截肢率。手術治療是LEAD 綜合治療方法中的一個重要手段,適用于癥狀嚴重或非手術治療無效者。間歇性跛行是相對手術適應證,一般認為FontaineⅡb 期或Rutherford Ⅲ級(即跛行距離<200 m)以上者為手術適應證。下肢靜息痛和肢端組織壞疽等慢性肢體威脅性缺血表現是手術的絕對適應證[7,9]。
手術禁忌證:對于合并有嚴重重要臟器疾病患者的治療應權衡其預期壽命、肢體缺血癥狀的嚴重程度作慎重選擇。腔內治療因其相對微創、易耐受而更適于年老、多并存病患者,但對近期有顱腦血管出血或心肌梗死病史、對比劑過敏等情況的患者亦應慎重。
4.2.1 血管腔內治療
直接比較外科開放手術和血管腔內治療療效的研究并不多,最經典的是2005 年及以后發表的BASIL 系列研究[21],但該研究受到當時的腔內技術水平的局限,其結論并不能反映當今真實世界的治療現狀。盡管目前仍缺乏足夠高水平的循證醫學證據,腔內治療方法因其創傷小、恢復快、易耐受、可重復等優點越來越成為股腘動脈閉塞癥的首選治療方法。同時,隨著技術和器械的發展,腔內治療的療效也在不斷改善之中。
4.2.1.1 腔內治療入路選擇
股腘動脈閉塞癥腔內治療入路可采用同側股動脈順行入路和對側股動脈逆行翻山入路。同側順行入路具有操作距離短、操控性好等優點,更適用于處理膝下動脈等肢體遠端病變。反之,如股淺動脈近端有病變或需同時處理髂動脈病變,或腹部過于肥胖順行穿刺不便者則宜采用對側股動脈入路。
如股動脈入路因疤痕、閉塞、腹主動脈分叉部及髂動脈對吻支架或分體式腹主動脈瘤腔內修復術后無法使用時可采用肱動脈入路。肱動脈入路在處理股淺動脈中遠段和腘動脈時可能會遇到球囊、支架等器械的輸送系統長度不夠的問題,這時可酌情采用與遠端逆行入路或同側股動脈順行入路聯合的方法解決。
在無法找到股淺動脈近端開口、內膜下成形返回真腔困難、病變末端側支較多、鈣化嚴重等情況下順行無法通過病變時可采用逆行開通方式。根據病變動脈閉塞長度的不同,可以選擇閉塞段遠端任何部位的通暢血管行逆行穿刺,包括股淺動脈遠端、腘動脈和膝下動脈。逆行穿刺可應用超聲、實時對比劑推注、路徑圖、鈣化和支架等作為定位和引導。
支架內再狹窄(intra-stent restenosis,ISR)再開通時如支架完全閉塞、導絲進入支架或通過閉塞段困難,順行開通無法實現時,可以行直接支架穿剌。此法可規避閉塞支架兩端嚴重的內膜增生導致的進入困難。
4.2.1.2 病變性質評估與血管開通
股腘動脈閉塞癥的形態和性質是決定不同開通、血管準備和管腔維持方法的主要因素,也是影響術后療效的主要因素,作好對病變形態和性質的評估至關重要。
病變形態應評估病變是狹窄性還是閉塞性、病變的長度、流出道的狀態和數量等。病變性質則應評估是否合并血栓及病變鈣化程度。可根據病史、術前影像、術中通過病變的手感等方法來判斷是否為血栓性病變。常用的鈣化分級方法一為PACSS 法[22],即在血管縱向的透視影像上無明顯鈣化者為0 級,單側且長度<5 cm 者為1 級,單側且>5 cm 為2 級,雙側且<5 cm 者為3 級,雙側且>5 cm 者為4 級;二是Fanelli 的環評法[23],即在血管CT 橫截面上無鈣化為A 級,鈣化占圓周1/4 為B 級,1/2 為C 級,3/4 為D 級,1 周為E 級。IVUS 可測量鈣化的范圍與深度,評估更為精準。股腘動脈ISR 常用的是Tosaka 分級[24],即Ⅰ級為支架內局限性狹窄,病變長度≤5 cm,Ⅱ級為彌漫性病變,長度>5 cm,Ⅲ級為支架內完全閉塞。
導絲成功通過病變是完成腔內治療的前提。應根據不同病變類型選擇合適的導絲和導管。如為狹窄性病變,宜選用低頭端克數的親水導絲滑行通過病變。閉塞性病變則可根據鈣化程度由低到高地選擇不同硬度的導絲,常需要應用支持導管等以加強支撐力,增強導絲通過病變的能力。
慢性完全性閉塞(CTO)病變應盡量爭取真腔通過,內膜下通過也是常用的開通方法,但應注意在病變遠端返回真腔時不能過多延長在通暢段血管內膜下走行的長度,必要時應及時改為逆行開通。
在應用支架或DCB 等治療之前需應用球囊擴張、減容等技術手段進行管腔準備,以達到碎裂或清除斑塊、開放管腔的目的。在臨床應用中應根據不同的病變類型和技術條件選擇不同的技術方法進行血管準備。
普通球囊擴張是腔內治療最常用的血管準備方法,可采用普通球囊行“遞增性擴張”,即選擇多個不同直徑的球囊由小至大地進行擴張,如靶血管的直徑為D(mm),可依序選擇D-2(mm)、D-1(mm)和D 直徑的球囊,鈣化較重者則可用D+1(mm)進行擴張。“遞增性擴張”方式可以有序、漸次地擴張病變,對于減少夾層的形成有一定意義,但還缺乏前瞻性、隨機對照的臨床研究證據。
特殊球囊根據作用原理可分為“切割性擴張”、“低壓聚焦擴張”和“控制性擴張”等幾類。“切割性擴張”是利用切割球囊中附著的刀片對斑塊進行擴張,適用于短段鈣化病變。“低壓聚焦擴張”是使用雙導絲球囊和刻痕球囊等以壓力聚焦的方式進行擴張,從而因擴張壓力較低而減少夾層的形成。“控制性擴張”是利用“巧克力球囊”表面的導絲束縛形成的相對低壓區所產生的緩沖作用來減少對血管內膜的損傷,減少夾層的形成。
非順應性球囊(也稱高壓球囊)擴張時壓力分布更為均勻,能夠較容易地擴開病變而對相鄰血管影響較小,同時其具備高壓擴張性能,適用于嚴重鈣化等較難擴開的病變。
對于嚴重鈣化病變,應用血管內碎石技術的震波球囊有助于更好獲得管腔、減少支架的置入。
此外,在球囊擴張過程中,緩慢充盈、緩慢釋壓、延長擴張時間等方法都有助于提高球囊擴張的效果。
減容是指利用專用器械進行血栓或斑塊清除,以獲得管腔、改善血管壁的順應性。針對動脈硬化性病變的減容技術,國內目前可使用的有定向斑塊切除系統和準分子激光等。前者的使用適應證主要是短段、多處、分散病變以及跨關節病變和鈣化病變,以減少多個、長段或跨關節支架的置入。準分子激光則是利用低能量準分子激光的物理作用對病變進行消蝕治療,兼具輔助導絲通過病變和減容雙重功效,尤其適合于長段CTO 病變和ISR 的治療。
對于病程較短、術前影像學評估有提示,或者術中導絲通過閉塞段相對容易的閉塞性病變應考慮可能存在繼發血栓,可先采用導管溶栓術或經皮機械祛栓裝置等作袪栓處理。利用多裂孔的灌注導管(如UniFuse)行導管溶栓術治療是安全、有效、經濟的袪栓方式,操作簡單且無需特殊設備,但它一般用時較長,不太適合那些病情急重、需要迅速復通血管的病例,理論上也存在著引起出血并發癥的風險,需要嚴格把握應用適應證,正確選擇用藥方式和劑量,嚴密監測相關實驗室指標[25]。國內可以使用的經皮機械祛栓裝置主要有兩種:Rotarex 和AngioJet,可起到袪除血栓、快速復通血管的目的。前者可以治療急性和亞急性血栓性病變,后者主要用于急性病變。
4.2.1.3 血管準備結果評估及管腔維持
血管準備結果評估:良好的血管準備要求最大限度地獲得管腔的開放、最低限度的彈性回縮導致的殘余狹窄(<30%)和沒有血流限制性夾層形成。對于夾層的評估,目前仍是借鑒冠狀動脈的美國國立心肺血液研究所(NHLBI)夾層分型法(表3)[26],一般認為,A、B 兩型屬于非血流限制性夾層,可以不置入支架,而C 型以上者為血流限制性夾層,需置入支架[27]。但在臨床實際應用中,對夾層的分型和判斷有時并不容易,更多地需依賴術者的主觀判斷。多角度造影、動脈壓力梯度測定和IVUS 等方法可以提高判斷夾層的準確性。原則上如彈性回縮殘余狹窄>30%、出現C 級以上夾層或平均動脈壓力差>10 mmHg 的夾層可以置入補救性支架。
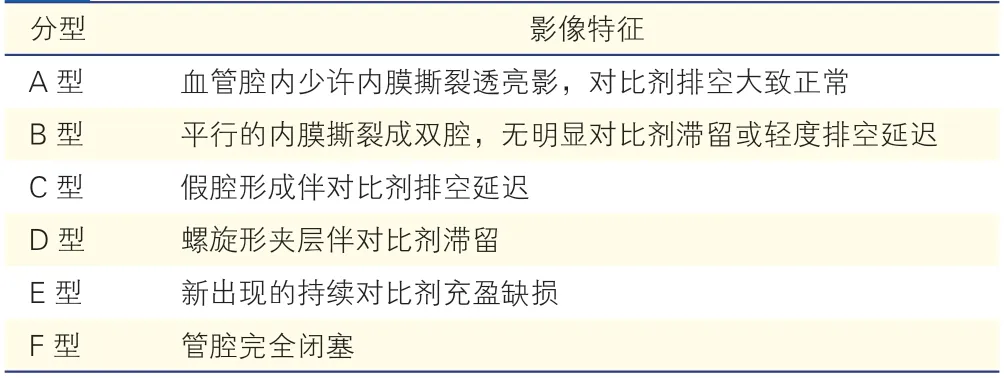
表3 NHLBI 夾層分型法
4.2.1.4 管腔維持
血管準備后的管腔維持手段包括DCB 和支架置入。DCB 是利用其攜載的紫杉醇或雷帕霉素等來抑制中膜平滑肌細胞增生,從而減輕腔內治療后內膜增生所導致的血管再狹窄。現有的循證醫學證據表明載藥器械在股腘動脈療效良好,尤其是DCB 有著較多的證據支持[28-30],已成為治療LEAD 的重要手段之一。但DCB 仍無法完全避免彈性回縮和限流性夾層等不良擴張效果的產生,在必要時仍需補救性置入支架。
球囊擴張加支架置入是近10 余年來股腘動脈閉塞癥腔內治療的主要方式,但因股腘動脈承受的復雜力學作用,對支架的徑向支撐力和柔順性要求較高。同時,降低支架的慢性外擴張力也有助于減少支架對血管壁的刺激,減少內膜增生和再狹窄的發生。股腘動脈支架多為激光雕刻的鎳鈦支架,又稱標準鎳鈦支架。標準鎳鈦支架現多作為DCB 后的補救支架,應盡量避免長段、全程標準鎳鈦支架置入。
覆膜支架因有覆膜的機械屏障,具有阻隔動脈硬化組織滲透和內膜增生的天然優勢。VIASTAR 等和RELINE 等臨床試驗結果都顯示具有肝素活性表面的Viabahn 對于長段股腘動脈閉塞癥和ISR 均有良好的療效[31-32]。使用Viabahn 時需注意把握充分預擴張、恰當的直徑選擇、充分覆蓋病變等技術細節。
血管仿生支架主要是指Supera 支架,是一款由鎳鈦絲編織而成的支架,具有4 倍于標準鎳鈦支架的徑向支撐力和接近于零的慢性外擴張力,能夠較好地順應下肢運動時血管的力學變化,尤其是對嚴重鈣化、跨關節病變、斷裂ISR 具有優于標準鎳鈦支架的通暢率和極低的支架斷裂率[33]。
將載藥技術和支架相結合的藥物洗脫支架(DES)是治療股腘動脈閉塞癥的又一利器。目前商品化的DES 主要有Zilver PTX 支架和Eluvia 支架兩款,兩者都是紫杉醇載藥支架。與DCB 相比,DES尤其是Eluvia 支架有更長的藥物釋放和作用時間,藥物劑量也遠小于DCB。有限證據表明,對于長段、鈣化等復雜病變,DES 較DCB+補救支架有更持久的作用效果[34]。然而,作為以標準鎳鈦支架為平臺的DES 同樣具有標準鎳鈦支架的不足之處,如不能完全避免支架斷裂,徑向支撐力相對較弱等。因此,對于跨關節、嚴重鈣化、直徑太細的腘動脈P2、P3 段,以及嚴重斷裂、移位的ISR,使用DES 仍需慎重。
4.2.1.5 腔內治療的并發癥
股腘動脈閉塞癥腔內治療的并發癥分為全身并發癥和局部并發癥兩大類。全身并發癥主要包括對比劑腎病、過敏反應、感染、溶血、迷走反射等。局部并發癥有穿剌部位血腫、假性動脈瘤、動靜脈瘺、局部閉塞和血管夾層、遠端栓塞、破裂穿孔、血栓形成、術后再灌注損傷等。
4.2.2 外科手術治療
外科開放手術仍是治療股腘動脈閉塞癥的重要方式,術式包括內膜剝脫成形術、動脈旁路術、切開取栓術等,尤其是對復雜股腘動脈閉塞癥,如超長病變、累及股動脈分叉的病變,應用傳統外科手術有助于減少腔內治療中長段和跨關節支架的置入,提高中、遠期通暢率。2007 年的TASC Ⅱ 指南中,D 級病變是明確推薦的外科手術指征[7],2015 年的TASC Ⅱ更新版指南指出,隨著腔內技術的飛速進步,越多越多的學者傾向于“腔內優先“的觀點,但尚未達成一致的共識[35]。2017 年的歐洲心臟病學會(ESC)指南仍指出,在股腘動脈閉塞癥長度>25 cm時旁路手術的療效優于腔內手術,尤其是在使用自體大隱靜脈作為移植物時。膝上股腘動脈旁路應用自體靜脈5 年通暢率可達到80%以上,而用人工血管者為67%[9]。
因此,對于相對年輕、全身狀況較好、預期壽命較長的患者,在其病變復雜、又有良好靜脈移植物可用,術者又有足夠的傳統外科手術經驗時可以優先選擇外科開放手術。
4.2.3 雜交手術
雜交手術是指外科開放手術和腔內手術相結合的一種復合手術方式,在為復雜、特殊部位病變治療時,可彌補腔內技術的不足,提高手術成功率,改善療效。
雜交手術的指征包括復雜多處或特殊部位病變,如股腘動脈閉塞癥累及股總動脈分叉病變,內膜剝脫加成形術的通暢率優于局部支架置入;需同時行取栓及原發病變治療者,如心房顫動導致的動脈栓塞同時伴有近、遠端動脈狹窄,或動脈硬化閉塞基礎之上繼發血栓形成導致的急性肢體缺血;腔內治療遇到技術瓶頸無法進一步實施,如順行無法找到股淺動脈開口或內膜下行進無法返回近、遠端真腔者。雜交手術的開放手術方法包括股總動脈內膜剝脫術、股總動脈切開取栓術等。
4.2.4 術后藥物管理和隨訪
股腘動脈閉塞癥術后的藥物管理及功能鍛煉是治療中必不可少的環節,應用的藥物與前述藥物治療要求相同。
中國傳統醫學包括辨癥施治的各類內服方劑和外用的各種洗劑,在緩解癥狀、術后調補等方面都有一定作用,尤其是在肢體缺血或感染性創面的處理方面,中醫中藥療法具有獨到的功效[36]。
對于無血運重建條件的股腘動脈閉塞癥患者,尤其是有潰瘍、壞疽創面的慢性肢體威脅性缺血患者,生物醫學和再生醫學包括基因治療和細胞治療提供了促進創面愈合和保肢的潛在可能性[14]。
定期隨訪及檢查也十分重要,可以及時發現再狹窄等問題并及時進行干預,以提高術后的輔助通暢率。一般建議在術后1 個月、3 個月、6 個月、12個月進行相關的檢查如彩色多譜勒超聲及ABI 檢查,如癥狀明顯則需行CTA 或DSA 檢查。
推 薦
·就血運重建手術而言,Fontaine Ⅱb 期或Rutherford Ⅲ級(即跛行距離<200 m)以上的間歇性跛行是相對適應證,靜息痛和肢端組織的缺血壞死等慢性肢體威脅性缺血表現是絕對適應證。鑒于股腘動脈閉塞癥治療的復雜性(方法和器械選擇多、再狹窄率相對較高等),嚴格掌握手術治療適應證至關重要。
·腔內治療微創、易耐受,適合高齡、并存疾病多的股腘動脈閉塞癥患者,可以作為首選手術治療方式。
·腔內治療需重視病變性質的評估,并根據不同病變選擇不同的開通、血管準備和管腔維持的方法和器械。應熟悉和了解不同方法和器械的特點和適用范圍。
·外科開放手術,尤其是自體靜脈旁路移植術的通暢率仍然優于腔內治療,對于相對年輕、病變復雜者可以選擇應用。
·股動脈分叉等特殊部位病變或腔內技術不完備時可以采用雜交手術方式。
專家共識寫作組成員(按姓氏漢語拼音排序):包俊敏(海軍軍醫大學第一附屬醫院),陳兵(浙江大學醫學院附屬第二醫院),郭連瑞(首都醫科大學宣武醫院),何菊(南開大學附屬第一中心醫院),李擁軍(北京醫院),梁衛(上海交通大學醫學院附屬仁濟醫院),劉冰(哈爾濱醫科大學附屬第一醫院),沈晨陽(中國醫學科學院阜外醫院),張健(中國醫科大學附屬第一醫院),章希煒(江蘇省人民醫院),張艷(暨南大學附屬第一醫院),莊百溪(中國中醫科學院西苑醫院)
執筆:包俊敏(海軍軍醫大學第一附屬醫院),劉冰(哈爾濱醫科大學附屬第一醫院),沈晨陽(中國醫學科學院阜外醫院),鄒君杰(江蘇省人民醫院)
利益沖突:所有作者均聲明不存在利益沖突

