皮膚致敏對TNBS誘導小鼠急性實驗性結腸炎的影響*
劉可心 王 卯 吳星星 吳 琪 段正蘭 王耀輝 王 瓊 陳玉根 吳 靜,2
(1.南京中醫藥大學附屬醫院,南京 210029)(2.南京大學中醫研究院,南京鼓樓醫院,南京中醫藥大學鼓樓臨床醫學院,南京 210008)
三硝基苯磺酸 (trinitrobenzenesulfonic acid, TNBS) 是一種半抗原物質的皮膚接觸劑。Morris等[1]研究指出,TNBS誘導的實驗性結腸炎機制為乙醇破壞腸道屏障,使得TNBS與結腸組織蛋白相互作用。當TNBS與具有高分子量的蛋白結合后,會對宿主免疫系統產生免疫原性,進而引起免疫應答。TNBS復合乙醇灌腸給藥,此方法誘導的實驗性結腸炎是常用的造模方式,以BALB/c小鼠為例,其單次給藥即可出現由Th1細胞介導的炎癥反應[2-3]。在TNBS誘導的急性實驗性結腸炎小鼠模型中,也有采用第1天予皮膚致敏,第8天予直接灌腸[4]。然而,大多數的實驗研究僅采用直接灌腸造模,不予皮膚致敏。有研究表明,使用皮膚致敏后體內會產生TNBS抗體,可能減少首次灌腸后產生的嚴重腸道炎癥反應以及降低TNBS用藥相關的死亡率[5]。也有研究指出,使用皮膚致敏可能加重腸道黏膜損傷,以促進實驗性結腸炎模型的建立[6]。目前有關二者造模方式的比較研究沒有相關報道,故在灌腸前是否予皮膚致敏仍無定論。
除此之外,既往研究表明,腫瘤壞死因子-α (tumor necrosis factor-α, TNF-α)是廣泛應用于炎癥性腸病 (inflammatory bowel disease, IBD) 中用來評價炎癥及黏膜免疫的指標,其在IBD患者腸道黏膜屏障功能中具有重要作用。有研究表明,IBD患者血清TNF-α 較健康人增高[7-8],也有研究表明TNBS誘導的小鼠急性實驗性結腸炎模型組中,TNF-α 較正常組增高[9]。Fu等[10]臨床試驗表明TNF超家族結構中B細胞激活因子 (B cell-activating factor, BAFF) ,又稱BLys/TNFSF13B,可用于IBD的診斷與評估;同時,BAFF影響T細胞介導的炎性反應,血清中BAFF水平與皮膚或黏膜的過敏反應密切相關[11]。細胞間粘附分子1 (intercellular adhesion molecule-1, ICAM-1) 又稱CD54,是免疫球蛋白超家族的內皮粘附分子,在各種炎癥性疾病中介導白細胞與內皮細胞的緊密粘附方面起關鍵作用[12];Huo等[13]研究表明,在TNBS誘導的實驗性結腸炎大鼠模型中ICAM-1是增加的;基質金屬蛋白酶的組織抑制劑1 (tissue inhibitor of matrix metalloproteinases 1, TIMP-1) 是一種獨立于基質金屬蛋白酶 (matrix metalloproteinase, MMP) 抑制的多功能蛋白,參與組織重塑和創傷愈合[14]。IBD患者結腸黏膜中TIMP-1的水平已經被證實是升高的[15];同時,血漿TIMP-1的水平與內鏡下黏膜損傷程度、疾病活動程度和預后密切相關[16]。由此,本研究在比較小鼠腸道炎癥基礎上,選取以上4個指標,檢測各組小鼠血清中細胞因子的水平,比較各組指標差異,以期探索皮膚致敏對TNBS誘導的急性實驗性結腸炎小鼠模型的影響。
1 材料和方法
1.1 材料
1.1.1實驗動物與分組:15只SPF級雄性BALB/c小鼠,8周齡,體重(20±2)g,購于浙江維通利華實驗動物技術有限公司【SCXK (浙) 2019-0001】。將小鼠隨機分為NC組、NP組及SP組,每組5只。飼養于江蘇省中醫藥基礎藥理實驗室【SYXK(蘇)2017-0069】。適應性喂養7 d,飼養期間小鼠自由飲水攝食(江蘇省中醫藥基礎藥理實驗室提供)。晝夜各半循環照明,濕度恒定,溫度控制在(26±2)℃,濕度控制在50% ± 10%。實驗符合江蘇省中醫院動物倫理委員會要求 (動物實驗審批號:2020DW-10-01) ,并遵守ARRIVE UPDATE 2.0版實驗動物報告準則[17]。
1.1.2主要試劑:5% TNBS (Sigma,P2297-5X10ML),丙酮 (南京寧試化學試劑有限公司,XK13-201-00494) ,異氟烷 (瑞普生物醫藥有限公司,020037015),HE染色液 (珠海貝索生物科技有限公司,BA4025),封片劑(上海國藥,10004160) ,Luminex試劑盒 (R&D System,1609517) 等。
1.1.3主要儀器和設備:小型ABS動物氣體麻醉機 (上海玉研科學儀器有限公司,Y100141034) ,電子分析天平 (上海恒平科學儀器有限公司,FA1004),玻片掃描影像系統 (深圳市生強科技有限公司,SQS-600P) ,液態懸浮芯片系統 (R&D System,Luminex X200) 。
1.2 方法
1.2.1藥品制備:1% TNBS溶液制備:5% TNBS與丙酮按1∶4渦旋混勻;2.5% TNBS溶液制備:5% TNBS溶液與80% 乙醇按1∶1渦旋混勻。
1.2.2實驗造模:SP組小鼠持續吸入麻醉,將兩肩之間皮膚1.5 cm×1.5 cm充分暴露,第1天予皮膚上輕涂1% TNBS 150 μL后,記錄小鼠體質量變化情況。于第8天灌腸,灌腸前禁食不禁水12 h,吸入麻醉后SP組及NP組各進行2.5% TNBS 100 μL灌腸,NC組予生理鹽水100 μL灌腸,輕揉腹部30 s,頭朝下倒置1 min,待其蘇醒后放回籠中,保溫觀察[4]。
1.2.3一般指標:觀察小鼠食水攝入,皮毛色澤及活動度等情況,記錄體質量變化,糞便性狀改變及有無肉眼血便,灌腸后進行小鼠疾病活動指數[18](disease activity index, DAI) 評分,DAI評分=(體質量增減率分數+大便性狀分數+血便程度分數)/3。
1.2.4脾臟質量及指數:使用精密電子天平 (稱重精度為0.000 1 g) 對脾臟稱重,將脾臟質量與取材當天小鼠的體質量比較,計算脾臟指數,脾臟指數=脾臟質量/末次體質量×100% 。
1.2.5血清制備及細胞因子檢測:灌腸造模后第3天,予小鼠麻醉后,將其單側眼球摘除后取血,室溫靜置30 min后離心,取血清100 μL分裝備用,利用Luminex試劑盒,檢測血清樣本中炎性細胞因子,實驗過程參照試劑盒說明書進行。
1.2.6結腸CMDI及評分:麻醉取血后,予頸椎脫臼法處死小鼠,取肛門至回盲部結腸,沿腸系膜縱行剖開,觀察結腸粘膜。將結腸組織平整的鋪在紙板上,拍攝全結腸圖片,觀察并記錄結腸質量、長度等,計算腸重與腸長比值及結腸指數 (結腸指數=結腸質量/末次體質量× 100%) ,并縱向剖開腸管,沖凈管腔后,進行結腸CMDI評分[19]。具體評分標準為:結腸黏膜與周圍組織無粘連,無潰瘍形成及炎癥,即無損傷,0分;結腸黏膜輕度水腫,但無潰瘍,只表現局部充血,1分;結腸黏膜潰瘍、充血且腸黏膜粗糙,2分;結腸黏膜潰瘍面積直徑約1 cm左右,3分;結腸黏膜潰瘍面積較大,直徑約2 cm左右,腸壁增厚,與周圍組織輕度粘連,4分;結腸黏膜潰瘍面積較大,直徑約2 cm左右,腸壁增厚,與周圍組織重度粘連,5分。
1.2.7結腸組織制備及病理評分:將遠端結腸組織進行縱剖,制作瑞士卷,包繞在PBS潤濕的注射器針頭上,投置于4% 多聚甲醛中固定,按酒精梯度進行脫水,浸入石蠟中包埋,將修整好的石蠟切片后脫蠟,經蘇木精-伊紅 (hematoxylin-eosin, HE) 染色,脫水烘干后中性樹脂封片,光學顯微鏡下觀察評分[4]并采集圖像。病理評分標準為:無炎癥跡象且無腸黏膜損傷,0分;低水平炎癥,分散浸潤單核細胞(1~2個病灶),輕度腸黏膜損傷,1分;中度炎癥,伴有多個病灶,中度腸黏膜損傷,2分;炎癥水平高,血管密度增加,血管壁增厚明顯,重度腸黏膜損傷,3分;炎癥的最大嚴重程度,包括透壁白細胞浸潤和杯狀細胞丟失,伴有壞死滲出,4分。
1.3 統計學分析
應用SPSS 22.0進行統計分析。組間分析采用單因素方差分析 (One-way ANOVA) ,若服從正態分布,方差齊采用LSD檢驗,方差不齊采用Tamhane檢驗;若不服從正態分布,采用非參數檢驗;結果以P<0.05,提示差異有顯著性。
2 結果
2.1 皮膚致敏對一般指標的影響
NC組活動良好,皮毛平順光澤。生理鹽水灌腸后有稀軟便排出,無肉眼血便。SP組皮膚致敏后活動良好,皮毛光澤,大便性狀正常,皮膚致敏期間無剔除小鼠。灌腸后小鼠精神倦怠,不喜動,食水攝入減少,大便黏附于肛周,拱背,扎堆,皮毛無光澤,豎毛現象明顯,有血便。NP組灌腸后小鼠倦怠懶動,皮毛欠光澤,豎毛嚴重,食水攝入差,大便質稀黏于肛周,部分有血便。至取材前,3組小鼠均無死亡。
2.2 皮膚致敏對體質量的影響
SP組及NP組行皮膚致敏后,每日監測體質量及其增減率,與NC組比較,SP組及NP組小鼠,皮膚致敏后至灌腸前體質量均無顯著差異 (圖1) 。第8天禁食不禁水12 h后,3組小鼠體質量較禁食前均下降,與NC組比較,SP組及NP組差異有顯著性 (P<0.01) ;SP組與NP組比較,差異無顯著性;第9天NC組體質量增加,SP組及NP組體質量均降低,且SP組較NP組體質量顯著下降 (P<0.05);第10天NC組體質量持續增加,SP組及NP組體質量呈增加趨勢,但SP組較NP組體質量差異有顯著性 (P<0.05) ;第11天SP組小鼠體質量呈增加趨勢,NC組及NP組體質量有所降低,但3組小鼠體質量差異無顯著性 (圖2) 。
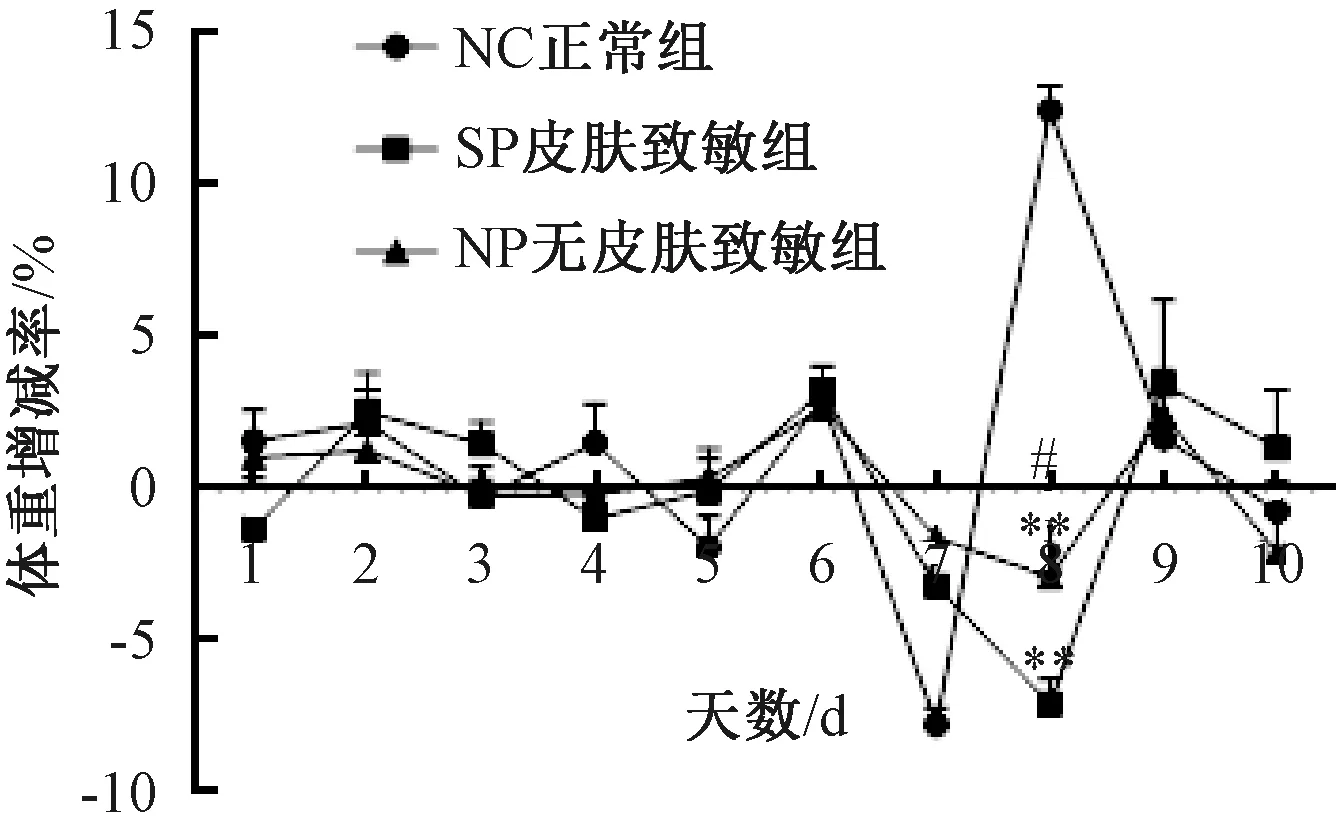
圖1 不同實驗組小鼠體質量的增減率變化注: 與NC組比較, * P<0.05, ** P<0.01; 與SP組比較, #P<0.05;下同Fig.1 Changes of percentage of weight gain or loss of mice in different experimental groupsNote: vs. NC group, * P<0.05, ** P<0.01;vs. SP group, #P<0.05; The same below
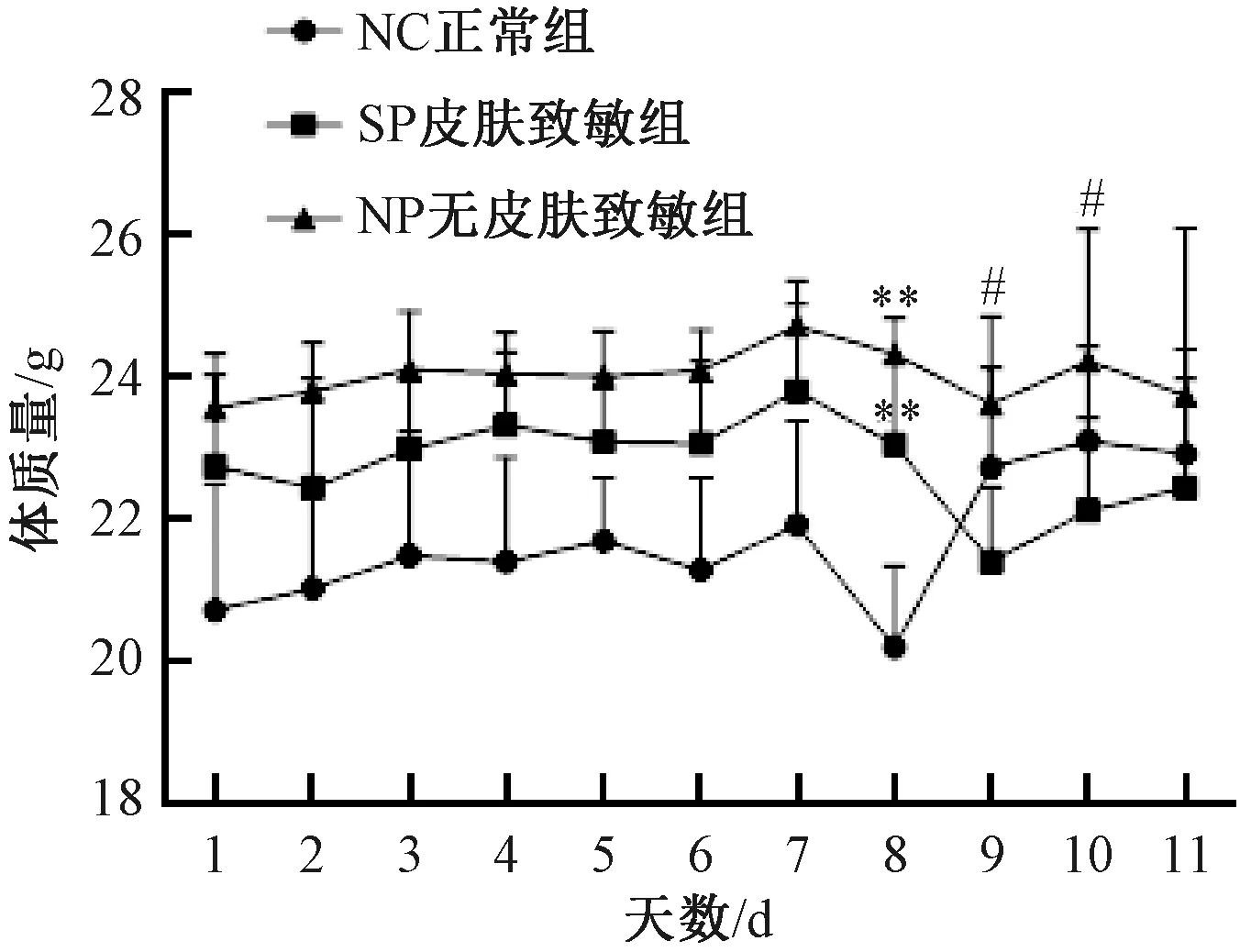
圖2 不同實驗組小鼠體質量變化Fig.2 Changes of weight of mice in different experimental groups
2.3 皮膚致敏對疾病活動指數評分(DAI)的影響
灌腸后至取材前,與NC組比較,SP組及NP組DAI評分均顯著增加 (P<0.05) ;SP組與NP組比較,差異無顯著性 (圖3) 。
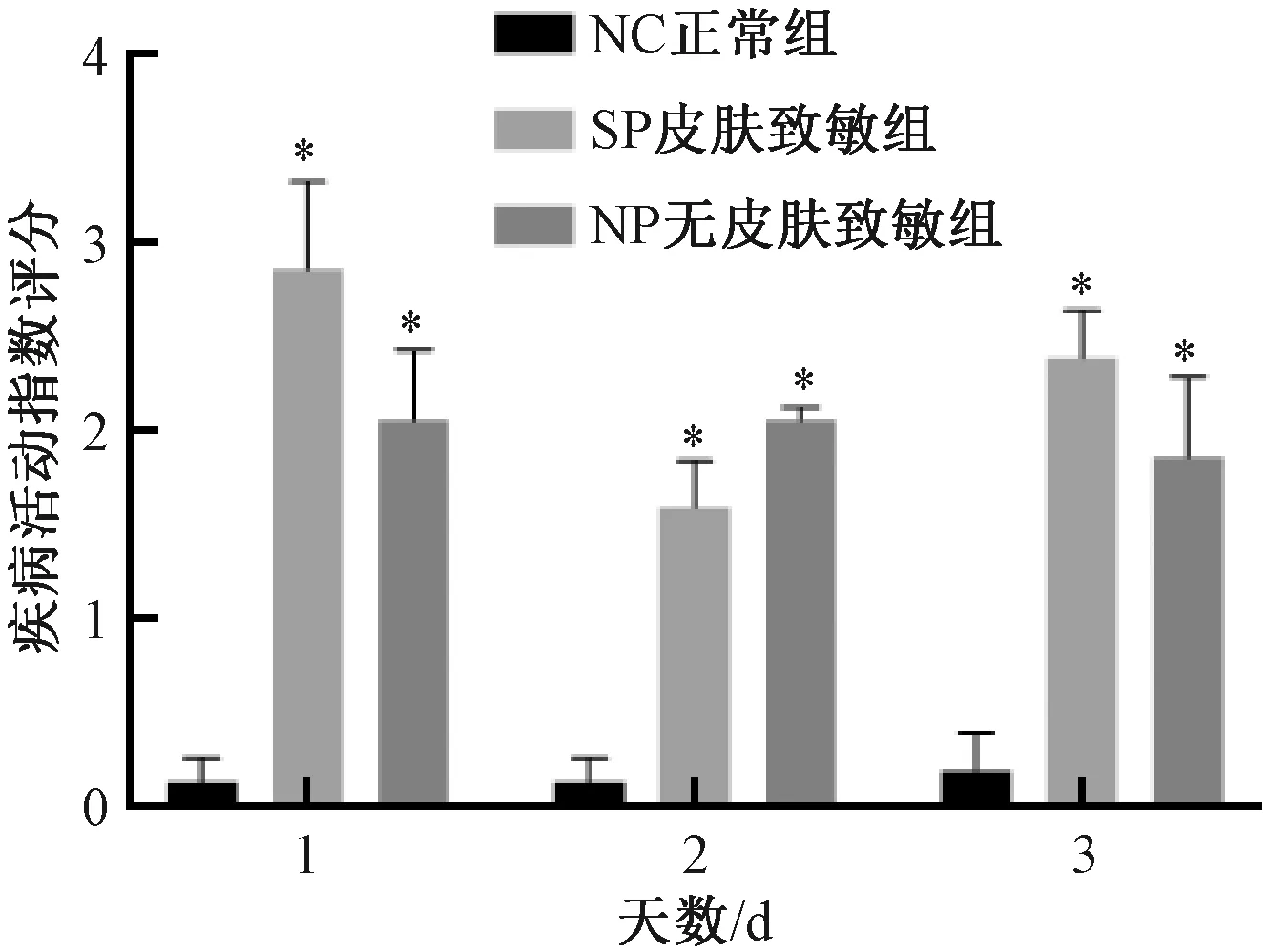
圖3 不同實驗組小鼠疾病活動指數評分的變化Fig.3 Changes of disease activity index score of mice in different experimental groups
2.4 皮膚致敏對脾臟質量及指數的影響
脾臟是反應機體免疫的器官,脾臟指數越高表示機體免疫能力越強[20],與NC組比較,NP組小鼠脾臟質量及指數顯著下降 (P<0.05) ,SP組小鼠脾臟質量及指數下降但差異無顯著性;SP組較NP組脾臟質量及指數均增加,但差異無顯著性 (圖4) 。
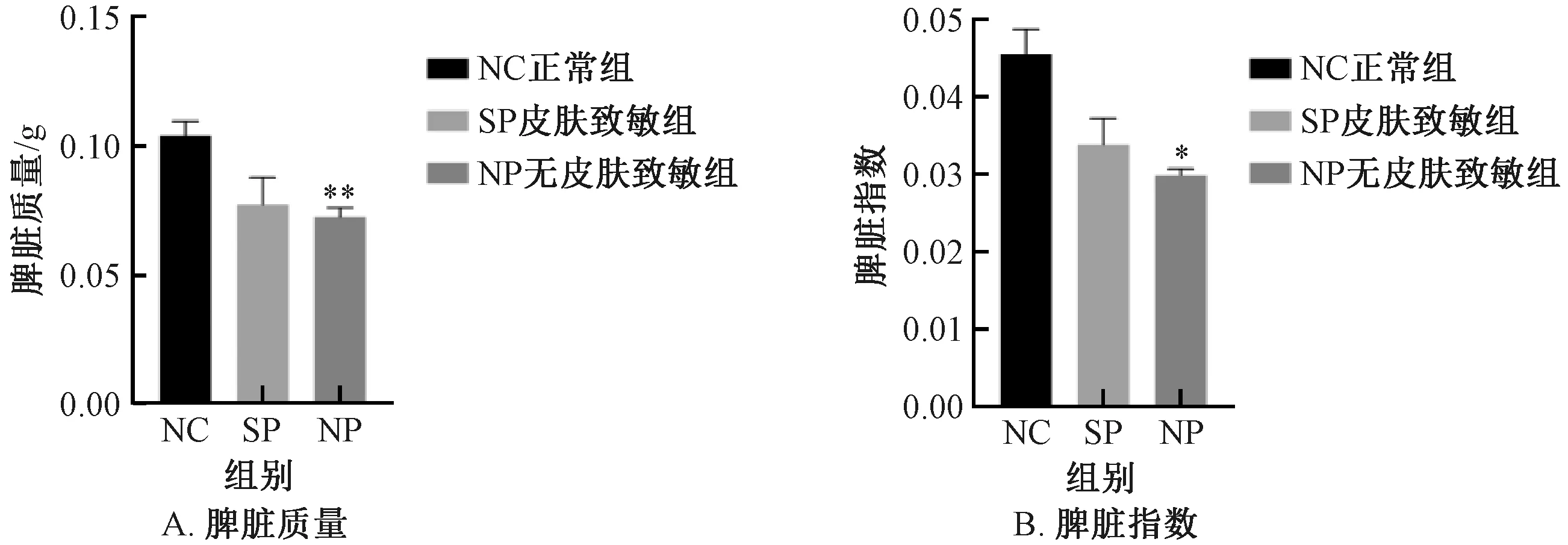
圖4 不同實驗組小鼠的脾臟質量及脾臟指數變化Fig.4 Changes of spleen weight and spleen index of mice in different experimental groups
2.5 皮膚致敏對結腸組織相關指標的影響
與NC組比較,SP組及NP組,結腸質量增加、結腸長度縮短、腸質量與腸長度比值升高以及結腸指數增加,但組間差異均無顯著性 (圖5-8) 。
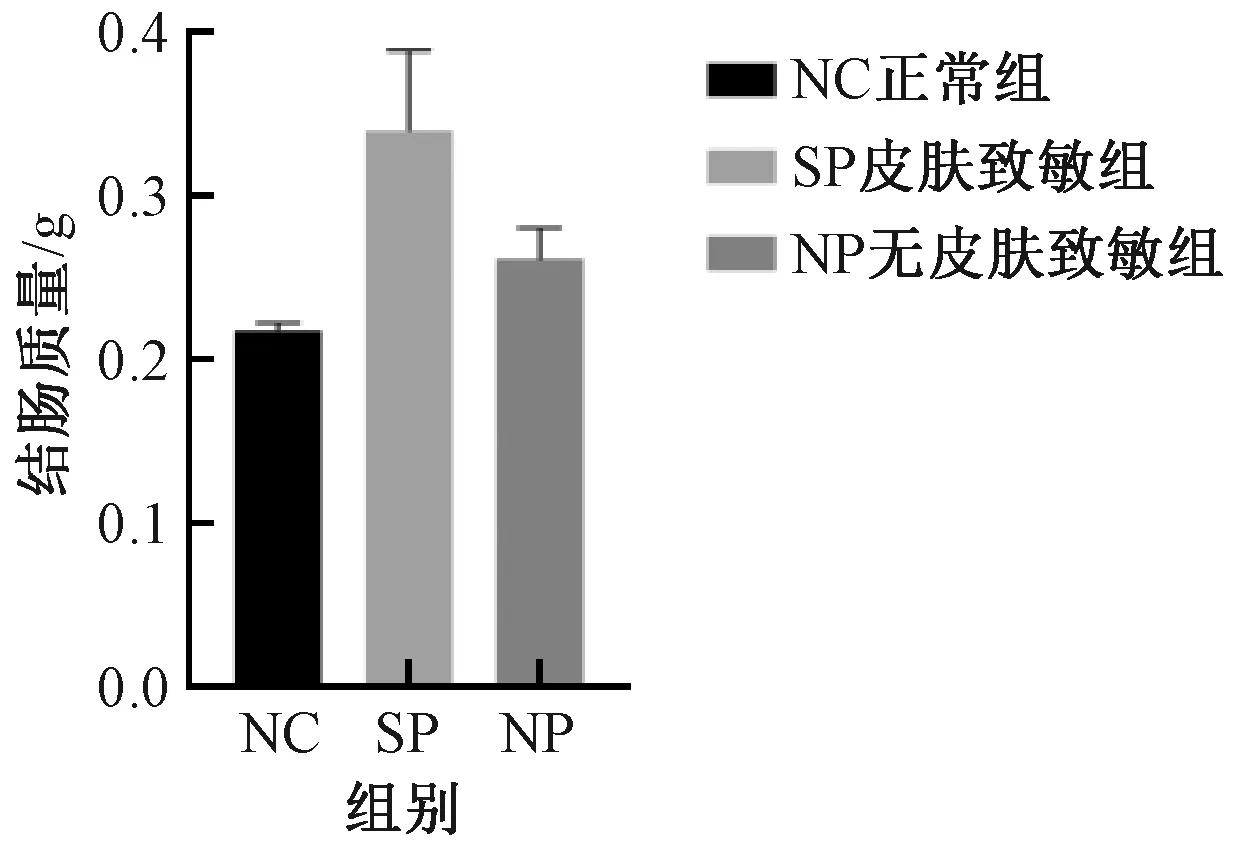
圖5 不同實驗組小鼠結腸質量的變化Fig.5 Changes of colon weight of mice in different experimental groups
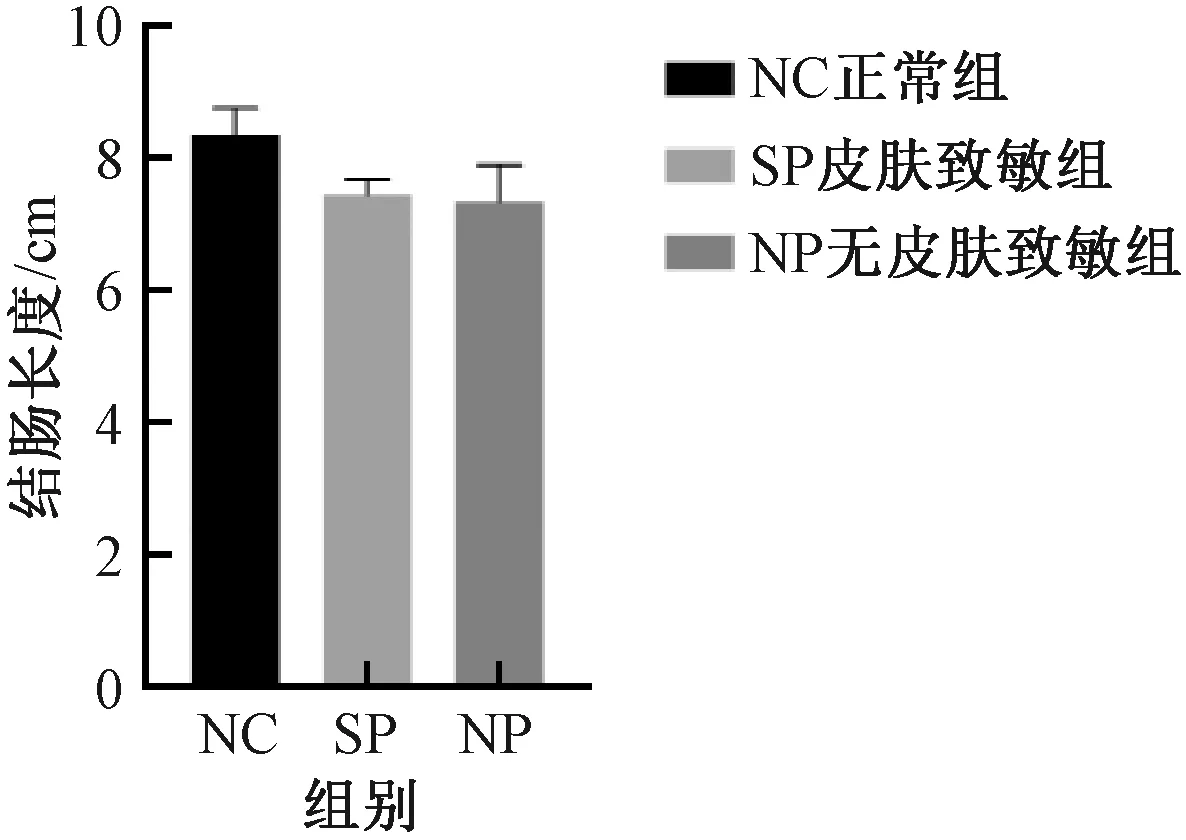
圖6 不同實驗組小鼠結腸長度的變化Fig.6 Changes of colon length of mice in different experimental groups
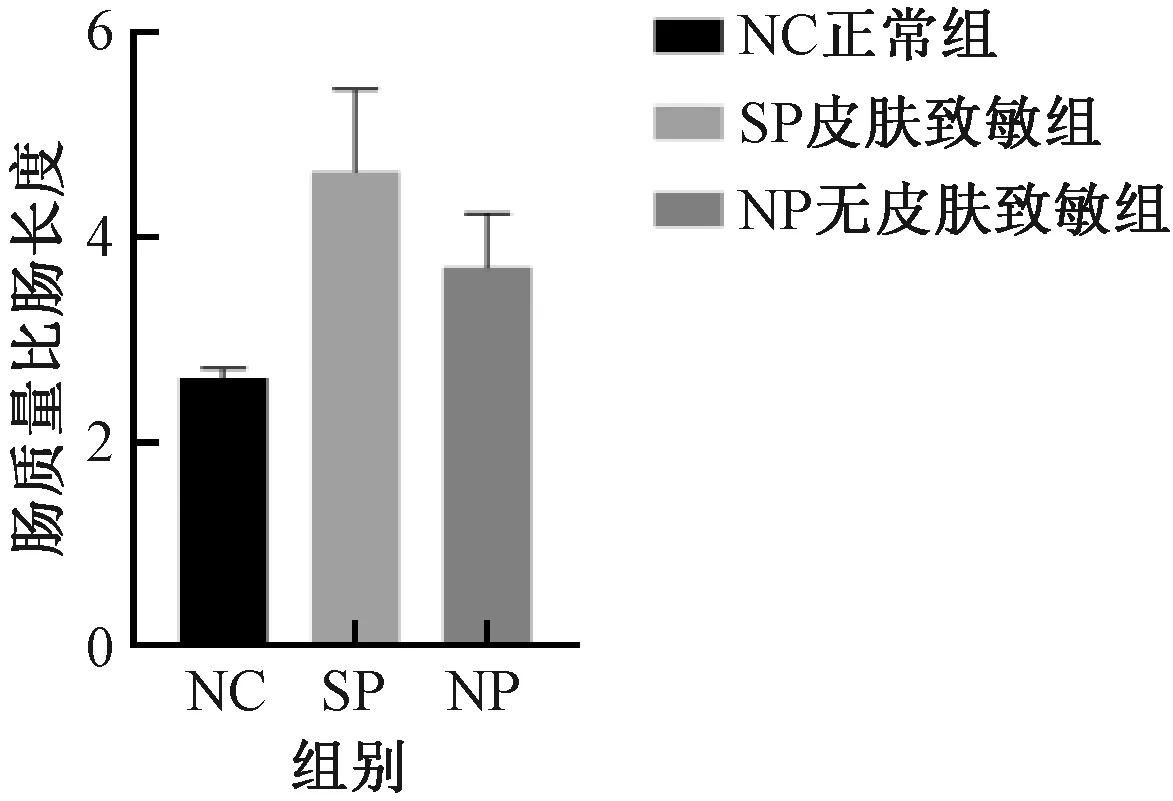
圖7 不同實驗組小鼠的腸質量與腸長度比值Fig.7 Intestinal weight ratio length of mice in different experimental groups
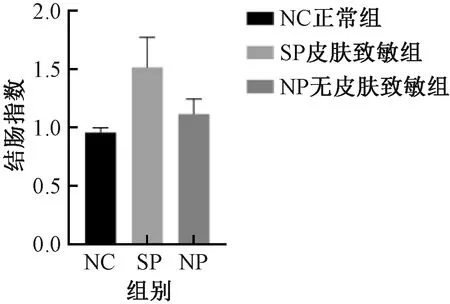
圖8 不同實驗組小鼠的結腸指數變化Fig.8 Changes of colonic index of mice in different experimental groups
2.6 皮膚致敏對結腸形態及CMDI評分
NC組結腸組織外觀正常,未見充血,黏膜層及肌層未見明顯病變;SP組結腸黏膜存在充血現象,偶見紅褐色血痂,個別結腸組織與周圍組織黏連;NP組結腸黏膜充血,結腸縮短,腸壁增厚明顯。與NC組比較,SP組CMDI評分顯著增加 (P<0.05) ,NP組CMDI增加但差異無顯著性;SP組與NP組比較,差異無顯著性 (圖9、圖10) 。
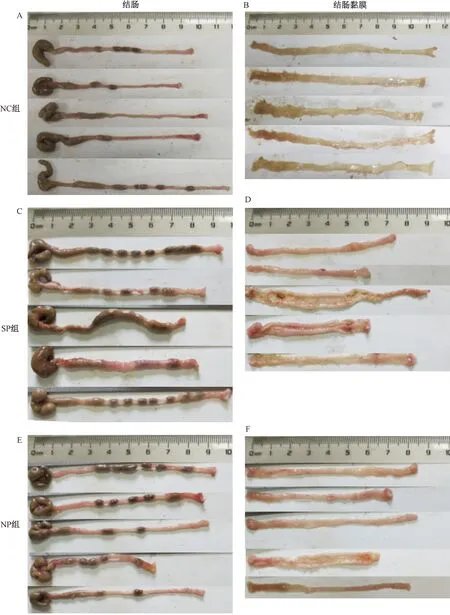
圖9 不同實驗組小鼠的結腸及結腸黏膜變化情況Fig.9 Changes of colon and colon mucosa of mice in different experimental groups
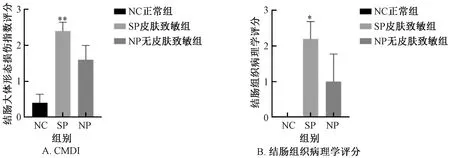
圖10 不同實驗組小鼠的CMDI及結腸組織病理學評分Fig.10 CMDI and colonic hispathological score of mice in different experimental groups
2.7 結腸組織病理及評分
由圖11可以看到,NC組腸壁完整,黏膜無缺損。與NC組比較,SP組小鼠出現間質淋巴細胞、漿細胞略增多,小灶糜爛;組內結腸黏膜損傷程度差異較小。NP組小鼠腸黏膜糜爛,肉芽組織增生,可見壞死滲出,間質較多中性粒細胞、淋巴漿細胞浸潤 (大部分黏膜層,少量累及黏膜下層) ,隱窩結構基本正常;但組內結腸黏膜損傷程度差異較大。與NC組比較,SP組結腸組織病理評分顯著增加 (P<0.05) ,NP組結腸組織病理評分增加,但差異無顯著性;SP組與NP組比較,差異無顯著性。
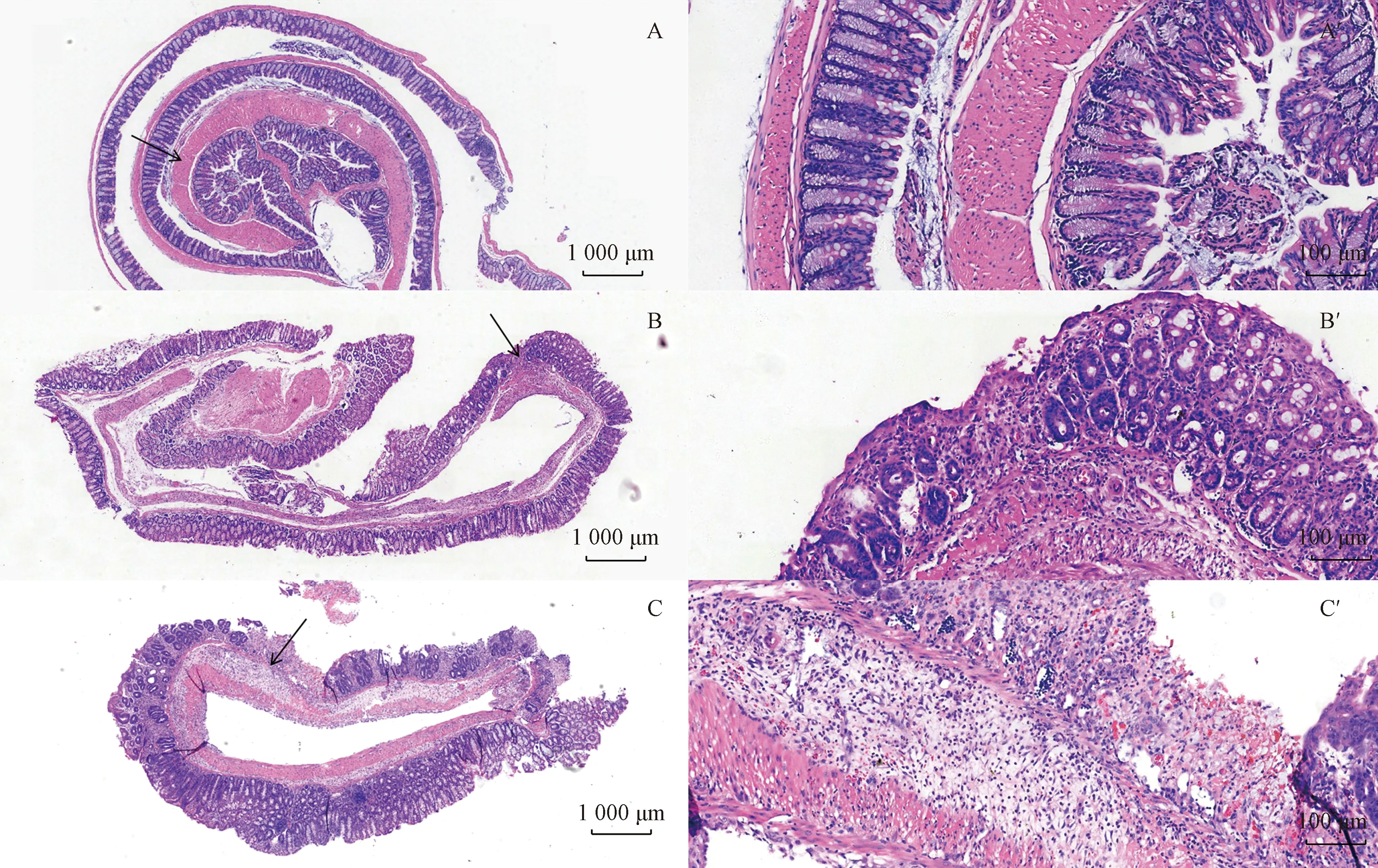
圖11 不同實驗組小鼠結腸組織的HE染色對比注:A : NC組 (× 20), A’ : NC組(× 100); B : SP組 (× 20);B’ : SP組(×100); C : NP組(× 20), C’ : NP組 (× 100); 黑色箭頭表示圖片放大區域Fig.11 Comparison of HE staining in colon tissue of mice in different experimental groupsNote. A : NC group (× 20), A’ : NC group(× 100); B : SP group (× 20), B’ : SP group(× 100); C : NP group(× 20), C’ : NP group(×100); The black arrow indicates the magnified area
2.8 皮膚致敏對細胞因子的影響
BAFF/BLys/TNFSF13B顯示,與NC組比較,SP組及NP組均顯著增加,差異有顯著性 (P<0.01);SP組及NP組比較,差異無顯著性;與NC組比較,SP組及NP組的TNF-α、ICAM-1/CD54、TIMP-1血清濃度值稍增加或持平,差異無顯著性;以上指標SP組與NP組比較,差異無顯著性 (圖12) 。
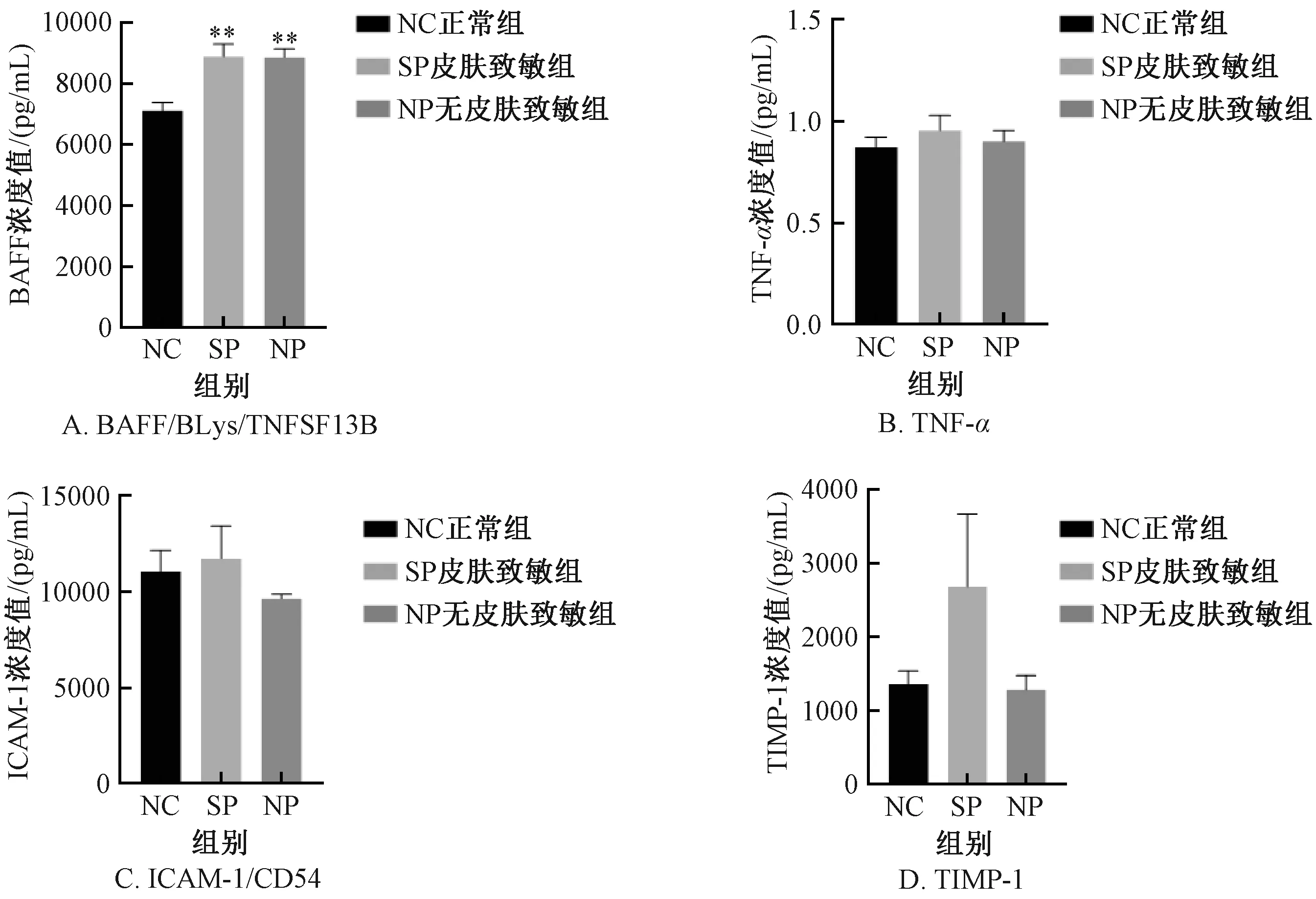
圖12 不同實驗組小鼠細胞因子的變化Fig.12 Changes of cytokines in mice of different experimental groups
上述結果提示,SP組及NP組均可建立急性實驗性結腸炎小鼠模型;綜合比較后,SP組小鼠組內差異較小且成模效果好,NP組小鼠組內差異較大;故在采用TNBS誘導建立小鼠急性實驗性結腸炎模型時,建議使用皮膚致敏。
3 討論
本研究基于TNBS的不同給藥方式,即是否予皮膚致敏,建立小鼠急性實驗性結腸炎模型。目前研究公認直接灌腸誘導急性實驗性結腸炎的機制是通過直腸灌注TNBS與乙醇的復合物,引起結腸黏膜中的某些氨基酸或腸內細菌蛋白產生反應,通過半抗原化的交聯過程,使得自身蛋白具有免疫原性,產生免疫反應。與皮膚致敏會引起遲發而非持續性的超敏反應相比較,直接灌腸其機制可能是由于TNBS與黏膜中的抗原發生反應,募集免疫效應細胞,形成Th1 T細胞的透壁性結腸炎。在與三硝基苯基(trinitrophenyl,TNP) 半抗原交聯的蛋白消失后,免疫效應細胞仍持續受到刺激,從而誘發免疫反應[21]。
當皮膚首次接觸致敏劑后,致敏物質通過角質層與表皮細胞結合,表皮層中角質細胞接觸致敏物質后產生應激反應,將釋放促炎因子[22]。基于此,本研究檢測了血清中BAFF/BLys/TNFSF13B、TNF-α、ICAM-1/CD54、TIMP-1細胞因子表達水平。結果表明,與NC組比較,SP組與NP組的TNF-α、ICAM-1/CD54、TIMP-1指標表達水平稍增加或持平,差異無顯著性。然而,有研究指出TNBS誘導的急性實驗性結腸炎小鼠模型中TNF-α 增加[9],TNBS誘導的大鼠模型中ICAM-1增加[13];臨床中IBD患者結腸黏膜中TIMP-1水平升高[15]。推測本研究差異無顯著性的原因可能是急性造模期間血清中細胞因子表達水平受時間因素影響。由于急性造模時間較短,這幾種炎性細胞因子尚未達峰,從而導致檢測結果無顯著差異;當然也不能排除檢測時間已過峰值[23],后期待檢測不同時間點的細胞因子水平,以期獲得更為精準的數據。BAFF/BLys/TNFSF13B的結果顯示,與NC組比較,SP組與NP組表達均顯著增加,與Sutherland等[11]報道的由甲基化BSA (mBSA) 和卵清蛋白 (Ovalbumin, OVA) 所致免疫反應一致。BAFF可能是炎癥免疫反應的早期指標之一。由于本研究樣本數量較少,且僅使用單次皮膚致敏,未來需大樣本進一步確證。

