模擬增溫對青海湖河源濕地土壤微生物群落特征的影響
章妮, 楊陽, 陳克龍
模擬增溫對青海湖河源濕地土壤微生物群落特征的影響
章妮1,2, 楊陽1,2, 陳克龍2,3,*
1. 青海師范大學生命科學學院, 西寧 810008 2. 青海省自然地理與環(huán)境過程重點實驗室, 西寧 810008 3. 青海師范大學科技處, 西寧 810008
濕地生態(tài)系統(tǒng)在生物多樣性保護等方面有著重要的功能及地位, 不同的濕地生態(tài)系統(tǒng)在功能上存在差異, 土壤微生物在濕地生態(tài)系統(tǒng)中發(fā)揮著重要作用, 但目前對河源濕地的土壤微生物群落開展的研究較少。全球變暖大背景下, 為探究溫度升高對河源濕地土壤微生物的影響, 利用高通量測序方法來深入了解模擬增溫后土壤細菌及真菌的群落結構及多樣性的變化。青海湖河源濕地細菌的優(yōu)勢菌群為變形菌門、酸桿菌門、放線菌門及厚壁菌門, 真菌的優(yōu)勢菌群為子囊菌門、擔子菌門。細菌群落對比真菌群落而言對土壤增溫的響應更為明顯, 細菌菌群的相對豐度呈增加趨勢, 真菌群落僅Hypocreales目相對豐度顯著增加; 土壤細菌及真菌群落的豐富度均降低, 而群落多樣性增加。增溫影響了土壤細菌及真菌的群落結構及多樣性, 且細菌群落對土壤增溫更為敏感。
河源濕地; 增溫; 土壤微生物; 高通量測序
0 前言
土壤微生物組成了一個強大的動力資源庫, 在養(yǎng)分的持續(xù)循環(huán)和地上生態(tài)系統(tǒng)的驅動方面起著至關重要的作用[1]。土壤微生物也影響著植物健康[2]、土壤結構[3]等進而影響著地上生態(tài)系統(tǒng)。濕地生態(tài)系統(tǒng)中, 土壤微生物不僅維持著系統(tǒng)的穩(wěn)定性, 也參與了生態(tài)修復、生物多樣性保護等生態(tài)過程[4]。因此, 土壤微生物在濕地生態(tài)系統(tǒng)中極其重要。濕地作為一個復雜多樣化的生態(tài)系統(tǒng), 為多種生物提供了棲息環(huán)境, 同時也為人類生存提供了一定的環(huán)境條件, 其功能和地位是不可替代的[5]。但濕地生態(tài)系統(tǒng)受到多重因素的干擾, 致使?jié)竦孛娣e持續(xù)萎縮、功能多樣性降低以及資源不斷減少。已有研究表明80%的濕地資源正在喪失、退化[6], 這對生存環(huán)境及生物多樣性帶來了不利影響。我國濕地分布極廣[7], 濕地面積達到了5360.26萬hm2, 為世界濕地面積排名第四的國家[8]。我國青藏高原作為全球氣候變化的敏感區(qū), 濕地面積約為13.19×104km2, 占全國濕地面積的20%[9-10], 在全球變化研究中也有著重要地位[11]。青海湖流域位于青藏高原東北部, 為國際重要濕地, 也是我國重要的生態(tài)功能調節(jié)區(qū)。
近年來, 自然因素與人為因素的綜合作用造成了青海湖流域水土流失、生物多樣性減少、草場退化等生態(tài)問題[12], 其中氣候變化對青海湖流域的濕地生態(tài)系統(tǒng)影響顯著。IPCC第五次報道指出, 截止到本世紀末, 全球地表平均溫度上升了約1.5—2.0 ℃, 2018—2100年全球氣溫將持續(xù)上升[13], 這將對青海湖流域產生極大影響。目前, 對濕地的植物[14-15]、動物[16-18]、微生物[19-21]及生態(tài)評價[22-24]等方面均有研究, 但不同濕地生態(tài)系統(tǒng)具有的生態(tài)功能存在差異性[25], 針對河源濕地的研究多為對河源濕地生態(tài)系統(tǒng)的評估與評價[26-28], 河源濕地土壤微生物的研究依然較少。對模擬增溫條件下河源濕地土壤微生物的研究有利于深入了解全球變暖后河源濕地生態(tài)系統(tǒng)的作用機制, 為河源濕地生態(tài)系統(tǒng)的保護提供一定的參考依據。
1 研究區(qū)概況
研究區(qū)為沙柳河上游源頭的典型河源濕地, 位于青海湖北岸, 地理位置為37°43′—37°46′ N、100°01—100°05′ E, 平均海拔在3720—3850 m。該區(qū)晝夜溫差極大, 為高原大陸性氣候, 多年平均溫度為-3.31 ℃, 年降水量在420.37 mm, 同時也是以小嵩草 () 主要植被的高寒草甸。
2 材料與方法
2.1 樣品采集
本實驗于2015年設置增溫實驗, 采用高于92%透光率的聚丙烯酸脂作為開頂箱 (Open-Top Chamber, OTC) 的制作材料, OTC增溫圈上表面直徑為150 cm, 邊長為87 cm; 下表面直徑為208 cm, 邊長為122 cm。該裝置對0—10 cm土層增溫約1.3 ℃, 10—20 cm土層增溫約1.0 ℃。實驗設置兩個處理、三個重復, 取三個樣方內增溫處理土壤 (WW), 同時取距增溫圈2 m內自然狀態(tài)土壤 (Wck) 作為對照。于2019年8月采集土壤樣品, 每個樣方采取隨機取五鉆土的方式, 對0—10 cm, 10—20 cm土壤分層取樣, 同層土壤混勻后過2 mm篩, 用10 mL的EP管保存土壤樣品, 分別標記為Wck1-1、Wck1-2、Wck2-1、Wck2-2、Wck3-1、Wck3-2、WW1-1、WW1-2、WW2-1、WW2-2、WW3-1、WW3-2, 置于液氮罐中用于高通量測序。
2.2 基因組DNA提取
土壤微生物總DNA提取試劑盒 (PowerSoil) 提取樣品的總基因組DNA, 試劑盒來源于美國的Mio-bio公司。PCR擴增的土壤細菌引物為CCTAYGGGRBGCASCAG(正向引物)、GGAC-TACNNGGGTATCTAAT(反向引物), 土壤真菌的引物為CTTGGTCATTTAGAGGAAGTAA(正向引物)、GCTGCGTTCTTCATCGATGCPCR(反向引物), 擴增過程參照文獻進行[29,30]。
2.3 數據分析
PCR擴增產物轉化得到原始測序序列 (Sequenced Reads) 后利用FLASH v1. 2. 7軟件[31]拼接PE reads得到原始Tags數據 (Raw Tags), 再利用Trimmomatic v0.33軟件[32]、UCHIME v4.2軟件[33]得到Effective Tags。UCLUST軟件[34]基于序列的相似性高于97%的分別利用Silva(細菌)和 UNITE(真菌)聚類得到OTU數目以及韋恩圖, R 包繪制Heatmap聚類分析圖, Mothur軟件[35]對α-多樣性評估, SPSS 21.0對土壤微生物的群落結構及多樣性進行ANOVA單因素方差分析, 對組間及組內數據作顯著性檢驗。Excel 2018繪制相對豐度餅圖。
3 結果與分析
3.1 基于序列相似度的OTU分類
高通量測序得到的有效序列經OTU分類后得到1607個細菌OTU, 87個真菌OTU。WW土壤細菌及真菌的OTU數目與Wck保持了一致性。為驗證測序數據量是否足以反映樣品中的物種多樣性, 構建了所有樣品土壤細菌(圖1A)及真菌的稀釋性曲線(圖1B)。可以看出, 隨著測序數據的增加, 各樣品的曲線逐漸趨于平坦, 表明無須再增加測序量, 也表明了本實驗數據的測序數量的合理性。
3.2 增溫對土壤微生物群落結構的影響
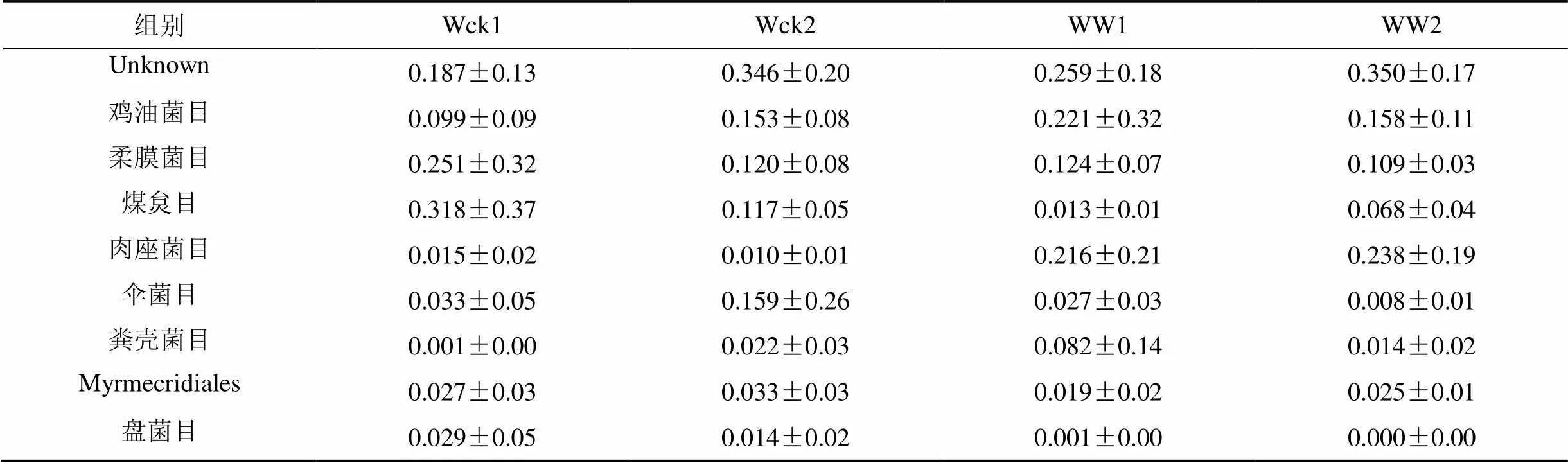
以青海湖河源濕地相對豐度大于1%的土壤微生物菌群構建餅圖, 細菌菌群(圖2)以變形菌門 (Proteobacteria, 50.77%)、酸桿菌門 (Acidobacteria, 18.17%)、放線菌門 (Actinobacteria, 6.28%)、厚壁菌門 (Firmicutes, 5.01%)、Rokubacteria門 (3.89%)、疣微菌門 (Verrucomicrobia, 3.79%)、芽單胞菌門 (Gemmatimonadetes, 3.19%)、綠彎菌門 (Chloroflexi, 3.14%)、硝化螺旋菌門 (Nitrospirae, 2.52%)、擬桿菌門 (Bacteroidetes, 2.15%) 為主要菌群; 真菌門水平的已知菌群主要為子囊菌門 (Ascomycota, 56.59%)、擔子菌門 (Basidiomycota, 22.16%), 真菌目水平(圖3)以未分類菌群 (未分類菌群, 28.54%) 相對豐度最高,其余主要菌群為雞油菌目 (Cantha-rellales, 15.79%)、柔膜菌目(Helotiales, 15.13%)、煤炱目 (Capnodiales, 12.90%)、肉座菌目(Hypocreales, 11.96%)、傘菌目 (Agaricales, 5.69%)、糞殼菌目 (Sordariales, 2.99%)、Myrmecridiales目 (2.61%)、盤菌目 (Pezizales, 1.10%)。
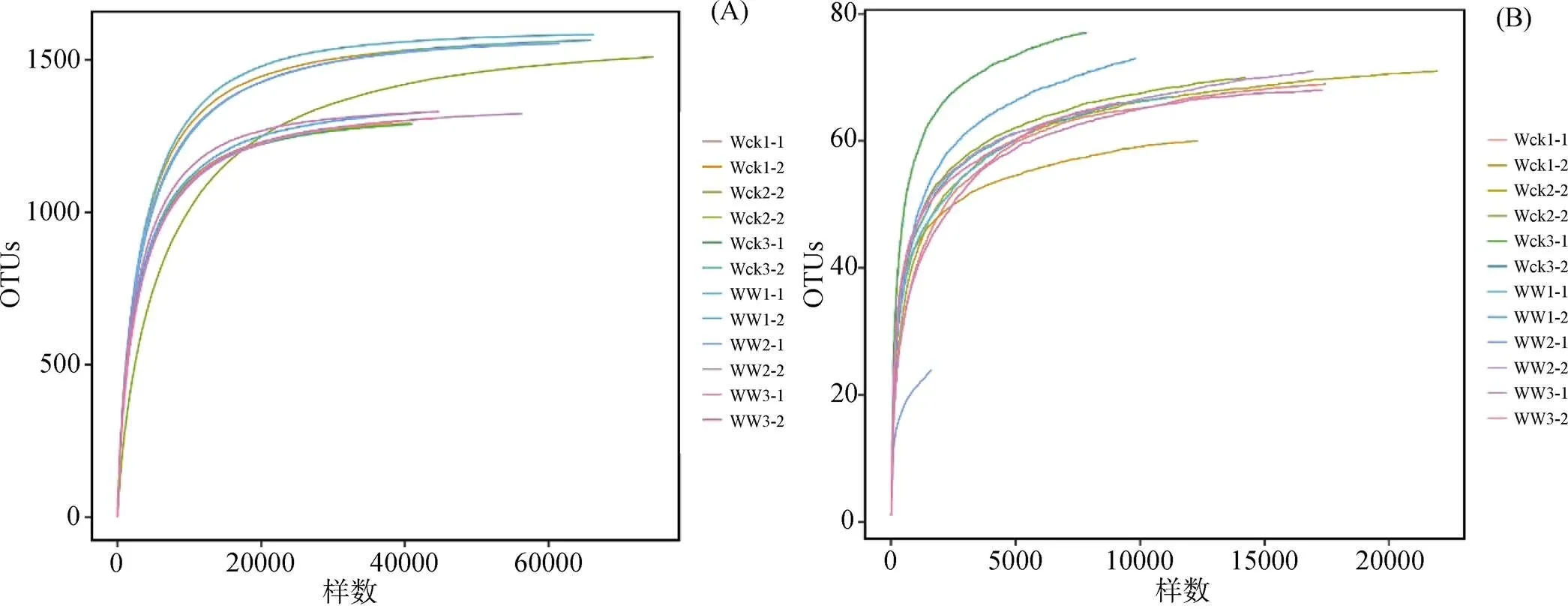
圖1 土壤細菌 (A) 及真菌 (B) 稀釋性曲線圖
Figure 1 Dilution curves of soil bacteria (A) and fungi (B)

圖2 細菌群落主要菌群相對豐度
Figure 2 Relative abundance of main flora in bacterial community
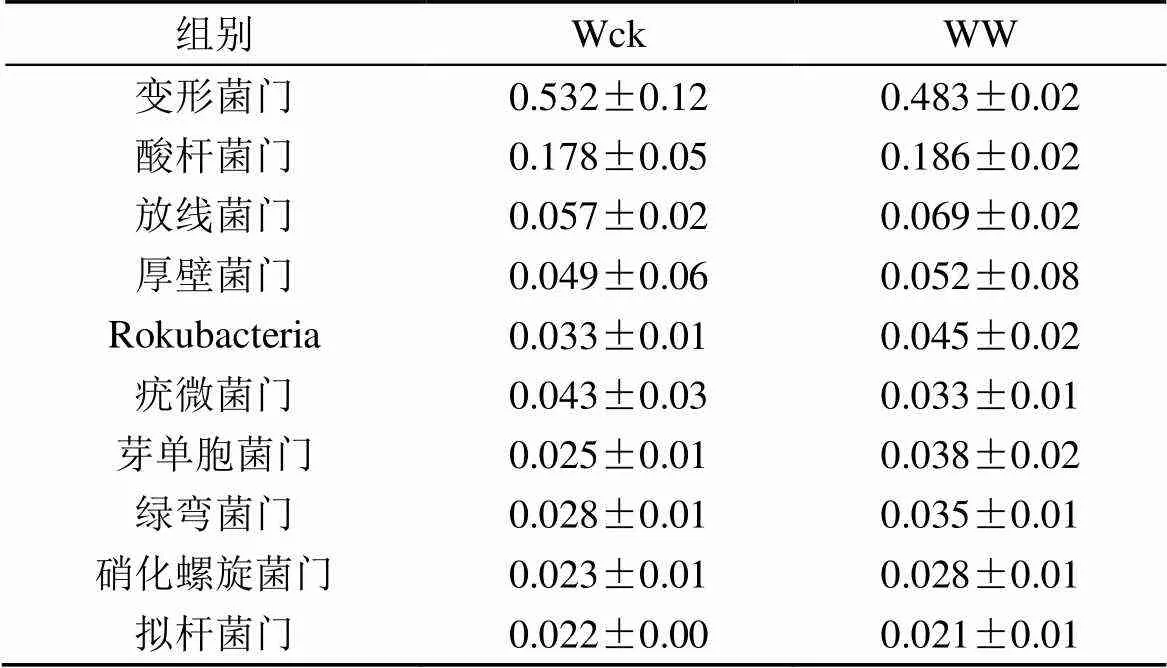
表1 不同處理下細菌菌群的相對豐度

圖3 真菌群落主要菌群相對豐度
Figure 3 Relative abundance of major flora in the fungal community
對不同處理的樣品的土壤微生物菌群的相對豐度計算均值及標準誤, 增溫處理后的土壤微生物菌群的相對豐度都發(fā)生改變。細菌的主要菌群(表1)中有7個菌群的相對豐度升高, Bacteroidetes門、Proteobacteria門及Verrucomicrobia門的相對豐度降低, 但細菌菌群相對豐度的變化并不顯著。真菌目水平有9個主要菌群(表2), 其中4個菌群的相對豐度升高, 5個菌群的相對豐度降低, 但僅Hypocreales目的相對豐度顯著升高 (= 0.015)。
3.3 增溫對土壤微生物群落多樣性的影響
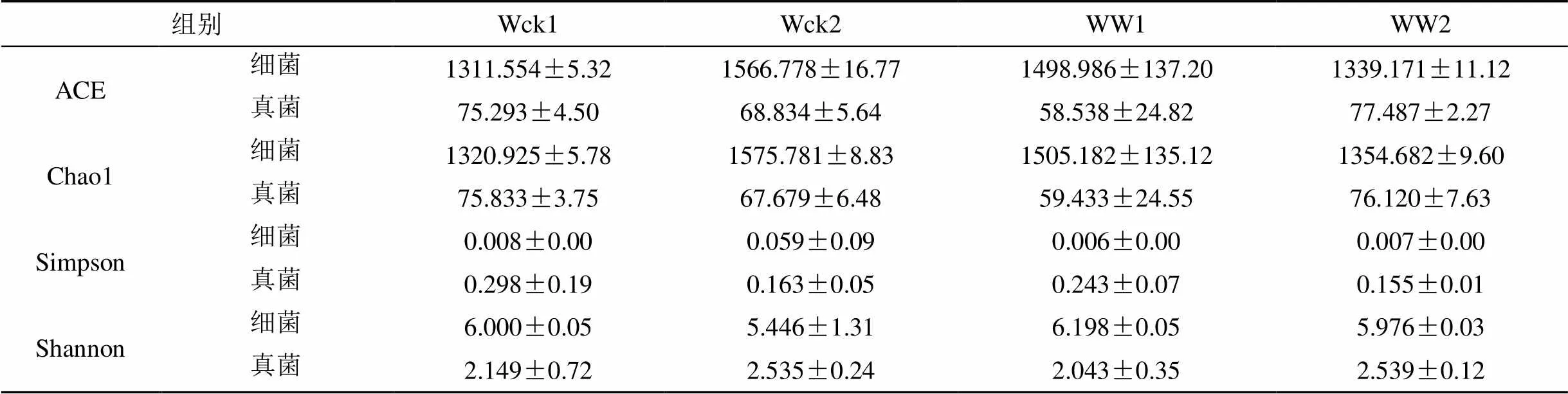
增溫處理影響了青海湖河源濕地土壤微生物群落多樣性(表3)。細菌群落的ACE指數、Chao1指數、Simpson指數表現為Wck>WW, Shannon指數表現為Wck 表2 不同處理下真菌菌群的相對豐度 表3 土壤微生物群落多樣性指數 3.4.1 不同土層土壤微生物群落結構 計算不同土壤層次樣品細菌(表4)及真菌(表5)的均值、標準誤。對Wck、WW組內不同層次進行ANOVA分析。Wck1與Wck2在細菌門水平上存在10個有顯著差異的菌群, 主要菌群中僅在Firmi-cutes門差異顯著 (= 0.013); 而在真菌門水平下的Ascomycota門表現出顯著性差異 (= 0.024), 但真菌目水平并無存在顯著差異的菌群。WW1與WW2的細菌菌群僅有4個表現出顯著性差異, 但主要菌o群中的Chloroflexi門 (= 0.024)、Gem-matimonadetes門 (= 0.033)及Nitrospirae門 (= 0.016)均表現出顯著差異; 真菌群落則完全沒有表現出顯著差異。對組間同層樣品進行比較, 0—10 cm土層中, Wck1與WW1的細菌菌群僅在Entotheonellaeota門有顯著差異 (= 0.013), 但該菌群相對豐度較低; 真菌菌群則沒有顯著差異。10—20 cm土層中, Wck2與WW2的細菌菌群中的14個菌群差異顯著, 主要菌群中Actinobacteria門 (= 0.033)、Firmicutes門 (= 0.013)、Gemmatimonadetes門 (= 0.016)、Nitrospirae門 (= 0.008) 表現出顯著差異; 真菌菌群都未表現出顯著差異。表明土壤微生物對溫度的上升的響應中, 群落結構會發(fā)生變化, 不同土層細菌的多個群落變化顯著, 但真菌群落結構的變化并不顯著, 表明細菌群落對溫度升高更為敏感。 表4 不同土層細菌主要群落相對豐度 表5 不同土層真菌主要群落相對豐度 3.4.2 不同土層土壤微生物群落多樣性 分析不同土層土壤微生物群落的豐富度及多樣性(表6)。組內分析表明, Wck1與Wck2的細菌群落的豐富度指數(ACE指數、Chao1指數)差異極顯著 (= 0.00), 且Wck1 熱圖(圖4)是基于距離算法得到樣品間的距離矩陣, 通過R包繪制的樣品熱圖, 可根據顏色梯度的變化直觀看出兩樣品間的差異性, 圖中各樣品間均表現出一定的差異。土壤細菌菌群(圖4A)差異性明顯, Wck1-2、Wck2-2、Wck3-2、WW1-1、WW2-1聚為一支, 差異性較小, 其余樣品聚為一支, 兩大支間差異明顯。土壤真菌菌群(圖4B)差異更大, 所有樣品聚為三支, Wck1-2、Wck2-2、Wck3-2、WW1-1、WW2-1仍聚為一支, Wck1-1、Wck2-1、Wck3-1聚為一支, 其余四個樣品聚為一支。表明增溫處理后0—10 cm土層的微生物群落趨于與10–20 cm土層的微生物群落保持一致性。 表6 不同土層土壤微生物群落多樣性指數 圖4 不同樣品間土壤微生物差異熱圖 Figure 4 Heat map of soil microbial differences among different samples 土壤微生物對生存的微環(huán)境變化極為敏感, 溫度升高影響土壤微生物的群落結構及多樣性。Papatheodorou等人的研究表明, 對比其他土壤微生物群落特征, 土壤微生物的群落組成可能對環(huán)境變化更為敏感[36]。青海湖河源濕地的細菌主要菌群為變形菌門、酸桿菌門、放線菌門、厚壁菌門、疣微菌門、芽單胞菌門、綠彎菌門、硝化螺旋菌門和擬桿菌門; 真菌優(yōu)勢菌群為子囊菌門以及擔子菌門, 其目水平的主要菌群則有雞油菌目、柔膜菌目、煤炱目、肉座菌目、傘菌目、糞殼菌目、Myrmecridiales目、盤菌目。這與濕地土壤微生物優(yōu)勢菌群的報道具有高度的一致性[37-39]。本實驗中, 增溫處理后青海湖河源濕地細菌群落的十個主要菌群中有7個菌群相對豐度升高, 另外三個菌群相對豐度降低; 表明溫度升高增加了土壤細菌的相對豐度。熊金波等人的研究同樣表明了增溫會改變土壤細菌的群落結構[40]。真菌目水平的9個主要菌群中4個菌群相對豐度升高, 但僅肉座菌目的相對豐度在統(tǒng)計學上顯著升高, 其余5個菌群相對豐度降低。已有的研究表明溫度升高對土壤微生物群落結構有影響[41-43]。本實驗中土壤細菌及真菌的大多菌群變化并不顯著, 這與Schindlbacher等人[44]研究表明氣候變暖沒有影響大多數微生物群的豐度相一致。以往研究表明不同土壤層次的微生物群落結構存在較大差異[45]。本實驗對0—10 cm及10—20 cm土壤樣品的微生物群落結構剖析, 結果表明Wck組內差異較大, 十個菌群在統(tǒng)計學上表現出顯著差異, 厚壁菌門為唯一一個差異顯著的相對豐度較高的菌群; 真菌菌群中, 子囊菌門差異顯著, 但在真菌目水平并無差異顯著的菌群。而WW組內差異相對較小, 4個細菌菌群表現出顯著差異, 其中芽單胞菌門、綠彎菌門及硝化螺旋菌門三個主要菌群均差異顯著; 但真菌菌群不存在顯著差異。Wck與WW組間同層分析表明, 0—10 cm土層僅細菌菌群中Entotheonellaeota門差異顯著; 10—20 cm土層中微生物群落結構的顯著差異仍體現在細菌菌群, 14個細菌菌群均表現出顯著差異, 其中Actinobacteria門、Firmicutes門、Gemmati-monadetes門、Nitrospirae門為主要細菌菌群。夏北成等人發(fā)現在不同層次的土壤環(huán)境中細菌群落有明顯的變化[46], 這與本實驗的結果一致。趙建琪等人的研究也表明不同層次的土壤微生物的群落結構均發(fā)生了變化[47]。 已有研究表明氣候變暖可能改變土壤微生物群落的多樣性[48]。本實驗增溫處理后, 土壤細菌及真菌群落的ACE指數、Chao1指數、Simpson指數均下降, Shannon指數升高, 表明土壤微生物群落多樣性對增溫的響應體現在豐富度指數的降低以及均一度指數的升高。Gregory等人的研究也證實了增溫會導致土壤微生物的群落多樣性變化[49]。Chengqun Yu 等人七年的模擬增溫實驗也表明土壤微生物多樣性會發(fā)生變化, 與本實驗一致[50]。0—10 cm及10—20 cm土壤樣品的微生物群落多樣性ANOVA分析表明, Wck組內細菌群落豐富度指數差異顯著, 10—20 cm土層的細菌豐富度明顯高于0—10 cm土層; WW組內多樣性指數差異顯著, 0—10 cm土層細菌多樣性高于10—20 cm土層。組間同層分析表明, 0—10 cm土層WW的細菌多樣性明顯高于Wck; 10—20 cm土層Wck的細菌豐富度明顯高于WW。李鈞敏等人的研究也表明土壤微生物的多樣性隨土壤深度增加會有顯著變化[51], 與本實驗一致。 青海湖河源濕地的細菌優(yōu)勢菌門為變形菌門、酸桿菌門、放線菌門、厚壁菌門, 相對豐度之和為80.23%; 真菌優(yōu)勢菌門為子囊菌門、擔子菌門, 總相對豐度達到了78.75%。溫度上升改變了土壤微生物的群落結構及多樣性, 對不同土層的細菌群落影響明顯。OTC增溫條件下, 細菌菌群的相對豐度整體呈上升趨勢, 真菌菌群中Hypocreales目的相對豐度顯著升高。土壤細菌及真菌群落的豐富度指數下降, 多樣性指數上升。表明增溫降低了土壤微生物豐富度, 增加了微生物群落多樣性。但增溫對不同土層微生物的影響主要是對細菌菌群群落的影響, 其群落結構中10—20 cm土層的三個細菌主要菌群, 即Actinobacteria門、Gemmatimonadetes門和Nitrospirae門相對豐度顯著升高, Firmicutes門這一主要菌群相對豐度顯著降低; 不同土層的細菌群落多樣性均有變化, 0—10 cm土層細菌群落多樣性顯著增高, 10—20 cm土層的細菌群落豐富度顯著降低。 [1] MELIANI A, BENSOLTANE A, MEDERBEL K. Microbial diversity and abundance in soil: related to plant and soil type[J]. American Journal of Plant Nutrition and Fertilization Technology, 2012, 2(1): 10–18. [2] SRIVASTAVA D, KAPOOR R, SRIVASTAVA S K, et al. Vesicular arbuscular mycorrhiza-an overview[M]. Springer, Dordrecht, 1996. [3] DODD J C, BODDINGTON C L, RODRIGUEZ A, et al. Mycelium of arbuscular mycorrhizal fungi (AMF) from different genera: form, function and detection[J]. Plant and Soil, 2000, 226(2): 131–151. [4] CHAUHAN A, OGRAM A, REDDY K R. Syntrophic- methanogenic associations along a nutrient gradient in the Florida Everglades[J]. Applied and Environmental Microbiology, 2004, 70(6): 3475–3484. [5] MITSCH W J, GOSSELINK J G. Wetlands, 4th ed[M]. John Wiley & Sons, 2007. [6] 孫志高, 劉景雙, 李彬. 中國濕地資源的現狀、問題與可持續(xù)利用對策[J]. 干旱區(qū)資源與環(huán)境, 2006, 20(2): 83–88. [7] 胡勝杰, 牛振國, 張海英, 等. 中國潛在濕地分布的模擬[J].科學通報, 2015, 60(33): 3251–3263. [8] 柯善北. 頂層設計為“地球之腎”撐起制度保護傘《濕地保護修復制度方案》解讀[J]. 中華建設, 2017, (7): 36–37 [9] 邢宇, 姜琦剛, 李文慶, 等. 青藏高原濕地景觀空間格局的變化[J]. 生態(tài)環(huán)境學報, 2009, 18(3): 1010–1015. [10] 閆立娟, 齊文. 青藏高原湖泊遙感信息提取及湖面動態(tài)變化趨勢研究[J]. 地球學報, 2012, 33(1): 65–74. [11] 白軍紅, 歐陽華, 徐惠風, 等. 青藏高原濕地研究進展[J].地理科學進展, 2004, 23(4): 1–9. [12] 李成秀, 李小雁, 楊太保, 等. 青海湖流域沙柳河草甸群落結構與數量特征[J]. 干旱區(qū)研究, 2013, 30(6): 1028–1035. [13] IPCC. Climate change 2013: the physical science basis: contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change [M]. Cambridge: Cambridge University Press, 2013. [14] OWEN R K, WEBB E B, HAUKOS D A, et al. Projected climate and land use changes drive plant community composition in agricultural wetlands[J]. Environmental and Experimental Botany, 2020, 175: 104039. [15] Wang X, Luo B, Wang L, et al. Plant diversity improves the effluent quality and stability of floating constructed wetlands under increased ammonium/nitrate ratio in influent[J]. Journal of Environmental Management, 2020, 266: 110607. [16] 朱慧蘭, 劉夢迪, 周宇鴻, 等. 深圳灣福田紅樹林濕地小型底棲動物群落結構及海洋線蟲新紀錄種[J].生態(tài)學雜志, 2020, 39(6): 1806–1812. [17] BROTHERTON S, JOYCE C B, SCHARLEMANN J P W. Global offtake of wild animals from wetlands: critical issues for fish and birds[J]. Hydrobiologia, 2020, doi: 10.1007/s10750-020-04188-z. [18] 王琰, 童春富, 湯琳, 等. 崇明東灘鹽沼濕地大型底棲動物功能群分布特征及其影響因子[J]. 生態(tài)學雜志, 2020, 39(3): 880–892. [19] 趙先麗, 周廣勝, 周莉, 等. 盤錦蘆葦濕地土壤微生物初步研究[J]. 氣象與環(huán)境學報, 2007, (1): 30–33. [20] MA L, LIU S N, DING X H, et al. Seasonal dynamics of soil microorganism in Zhalong reed wetland[C]. Trans Tech Publications Ltd, 2011. [21] SHENGUI L I. Study of Wetland Plant Rhizosphere Microorganism in the Treatment of Sanitary Wastewater[J]. Industrial Safety and Environmental Protection, 2010, (11): 6. [22] 徐香勤, 蔡文倩, 王艷, 等. 天津市典型湖庫濕地生態(tài)完整性評價[J]. 應用生態(tài)學報, 2020, 31(8): 2767–2774. [23] 趙衡, 閆旭, 王富強, 等. 基于PSR模型的三門峽庫區(qū)濕地生態(tài)系統(tǒng)健康評價[J]. 水資源保護, 2020, 36(4): 21–25. [24] 朱金峰, 周藝, 王世新, 等. 白洋淀濕地生態(tài)功能評價及分區(qū)[J]. 生態(tài)學報, 2020, 40(2): 459–472. [25] 舒儉民, 杜加強, 孟曉杰, 等. 牡丹江支流河源濕地環(huán)境特征與服務功能研究[J]. 水生態(tài)學雜志, 2009, 30(6): 62–66. [26] SHU J, DU J, MENG X, et al. Study on the Wetland Ecosystem Functions and the Characteristics of Surrounding Environment in Bayou Headwater Wetland of the Mudan River[J]. Journal of Hydroecology, 2009, (6): 13. [27] TANG C. Ecohydrological Assessments on Nitrogen Behavior in the Headwater Wetland[M]. Springer, Tokyo, 2014. [28] CHEN M, CAO J J, WU G L, et al. Preliminary estimation of service values of Maqu wetland ecosystem in the head water areas of the Yellow River[J]. Pratacultural Science, 2010, 27(5): 10–14. [29] LIU J, JIA X, YAN W, et al. Changes in soil microbial community structure during long‐term secondary succession[J]. Land Degradation & Development, 2020, 31(9): 1151–1166. [30] SEKARAN U, SANDHU S S, QIU Y, et al. Biochar and manure addition influenced soil microbial community structure and enzymatic activities at eroded and depositional landscape positions[J]. Land Degradation & Development, 2020, 31(7): 894–908. [31] MAGOC T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957–2963. [32] BOLGER A M, LONSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114–2120. [33] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194–2200. [34] WANG Y, SHENG H F, HE Y, et al. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and environmental microbiology, 2012, 78(23): 8264–8271. [35] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and environmental microbiology, 2009, 75(23): 7537–7541. [36] PAPATHEODOROU E M, ARGYROPOULOU M D, STAMOU G P. The effects of large-and small-scale differences in soil temperature and moisture on bacterial functional diversity and the community of bacterivorous nematodes[J]. Applied Soil Ecology, 2004, 25(1): 37–49. [37] 諶佳偉, 葛繼穩(wěn), 馮亮, 等. 神農架大九湖泥炭濕地甲烷通量特征及其與土壤微生物群落組成的關系[J]. 地球科學, 2020, 45(3): 1082–1092. [38] LI H, CHI Z, LI J, et al. Bacterial community structure and function in soils from tidal freshwater wetlands in a Chinese delta: potential impacts of salinity and nutrient[J]. Science of The Total Environment, 2019, 696: 134029. [39] 于少鵬, 史傳奇, 胡寶忠, 等. 古大湖濕地鹽堿土壤微生物群落結構及多樣性分析[J]. 生態(tài)學報, 2020, 40(11): 3764–3775. [40] 熊金波. 青藏高原短期增溫實驗引起土壤細菌群落的快速響應[C]//中國土壤學會. 面向未來的土壤科學(中冊)—中國土壤學會第十二次全國會員代表大會暨第九屆海峽兩岸土壤肥料學術交流研討會論文集, 2012. [41] DEANGELIS K M, POLD G, TOPCUOGLU B D, et al. Long-term forest soil warming alters microbial communities in temperate forest soils[J]. Frontiers in microbiology, 2015, 6: 104. [42] RINNAN R, MICHELSEN A, BAATH E, et al. Fifteen years of climate change manipulations alter soil microbial communities in a subarctic heath ecosystem[J]. Global Change Biology, 2007, 13(1): 28–39. [43] ALLISON S D, TRESEDER K K. Warming and drying suppress microbial activity and carbon cycling in boreal forest soils[J]. Global change biology, 2008, 14(12): 2898–2909. [44] SCHINDLBACHER A, RODLER A, KUFFNER M, et al. Experimental warming effects on the microbial community of a temperate mountain forest soil[J]. Soil Biology and Biochemistry, 2011, 43(7): 1417–1425. [45] FIERER N, SCHIMEL J P, HOLDEN P A. Variations in microbial community composition through two soil depth profiles[J]. Soil Biology and Biochemistry, 2003, 35(1): 167–176. [46] 夏北成, ZHOU J, TIEDIE J M. 土壤細菌類克隆群落及其結構的生態(tài)學特征[J]. 生態(tài)學報, 2001, 21(4): 574–578. [47] 趙建琪, 吳建平, 張慧玲, 等. 增溫對南亞熱帶季風常綠闊葉林土壤微生物群落的影響[J]. 生態(tài)環(huán)境學報, 2019, 28(5): 881–889. [48] SHADE A, PETER H, ALLISON S D, et al. Fundamentals of microbial community resistance and resilience[J]. Frontiers in microbiology, 2012, 3: 417. [49] ZOGG G P, ZAK D R, RINGELBERG D B, et al. Compositional and functional shifts in microbial communities due to soil warming[J]. Soil Science Society of America Journal, 1997, 61(2): 475–481. [50] YU C, HAN F, FU G. Effects of 7 years experimental warming on soil bacterial and fungal community structure in the Northern Tibet alpine meadow at three elevations[J]. Science of the Total Environment, 2019, 655: 814–822. [51] 李鈞敏, 金則新, 張崇邦. 不同土層土壤細菌的遺傳多樣性及其與環(huán)境因子的相關性[J]. 浙江大學學報(理學版), 2006, 33(6): 695–701. Effects of simulated warming on soil microorganisms community characteristics in source wetland of qinghai lake ZHANG Ni1,2, YANG Yang1,2, CHEN Kelong2,3,* 1. College of Life Science Qinghai Normal University, Xining 810008, China 2. Qinghai Key Laboratory of Physical Geography and Environmental Processes, Xining 810008, China 3. Science and Technology Department, Qinghai Normal University, Xining 810008, China Wetland ecosystems play an important role in biodiversity conservation, but different wetland ecosystems have different functions, and soil microbes play an important role in wetland ecosystems. However, few studies have been carried out on soil microbial communities in source wetland. In the context of global warming, in order to explore the impact of temperature rise on soil microorganisms in source wetland, high-throughput sequencing method was used in this experiment to further understand the community structure and diversity changes of soil bacteria and fungi after simulated warming. The dominant flora were Proteobacteria, Acidobacteria, Actinomycetes and Firmicutes, and the dominant flora were Ascomycetes and Basidiomycetes. Compared with the fungal community, the bacterial community showed a more obvious response to the increase in soil temperature. The relative abundance of the bacterial community was increasing, and the relative abundance of the fungal community was only significantly increased in Hypocreales. The richness of soil bacteria and fungi community decreased, while the community diversity increased. Temperature increase affects the community structure and diversity of soil bacteria and fungi, and the bacterial community is more sensitive to soil temperature increase. source wetland; warming; soil microbe; high-throughput sequencing 章妮, 楊陽, 陳克龍. 模擬增溫對青海湖河源濕地土壤微生物群落特征的影響[J]. 生態(tài)科學, 2022, 41(5): 46–54. ZHANG Ni, YANG Yang, CHEN Kelong. Effects of simulated warming on soil microorganisms community characteristics in source wetland of qinghai lake[J]. Ecological Science, 2022, 41(5): 46–54. 10.14108/j.cnki.1008-8873.2022.05.006 Q938.1+1 A 1008-8873(2022)05-046-09 2020-07-12; 2020-08-05 國家自然科學基金項目(41661023); 國家科技支撐計劃項目(2017YFC0403601); 第二次青藏高原綜合科學考察研究(2019QZKK0405); 青海省科技廳項目(2017-ZJ-782) 章妮(1997—), 女, 湖北荊州人, 碩士研究生, 主要從事濕地生態(tài)學研究, E-mail:1581146264@qq.com 陳克龍, 男, 二級教授, 博士生導師, 主要從事生物地理與濕地生態(tài)研究, E-mail:ckl7813@163.com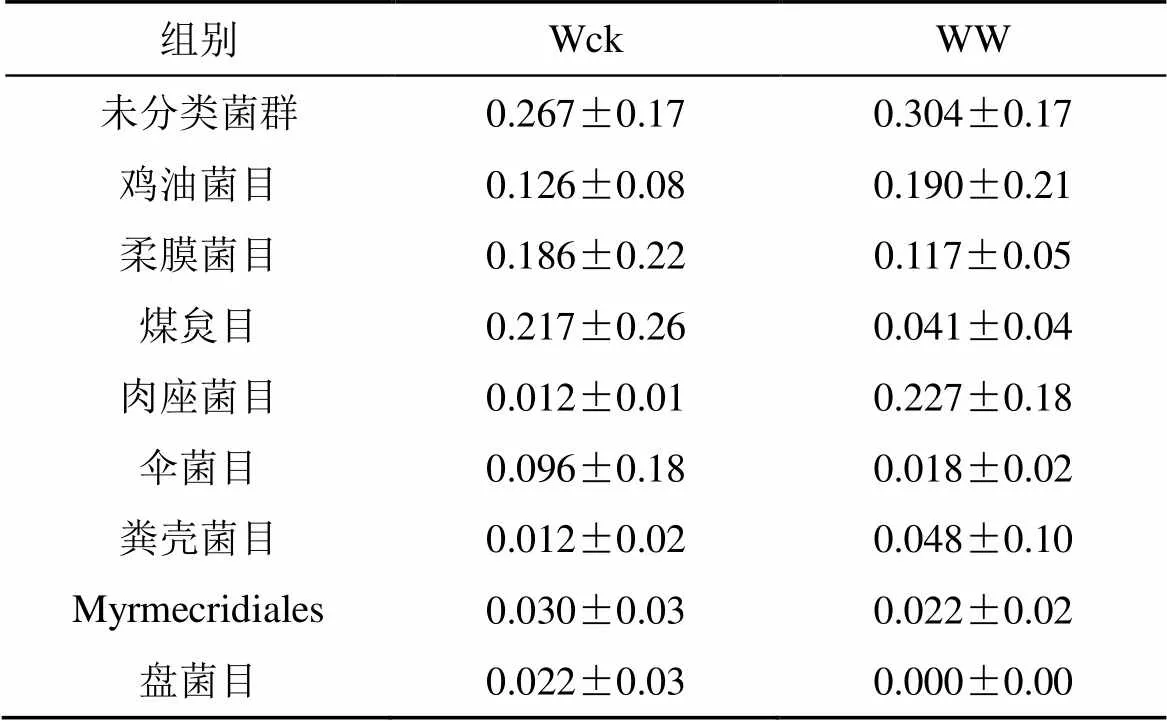

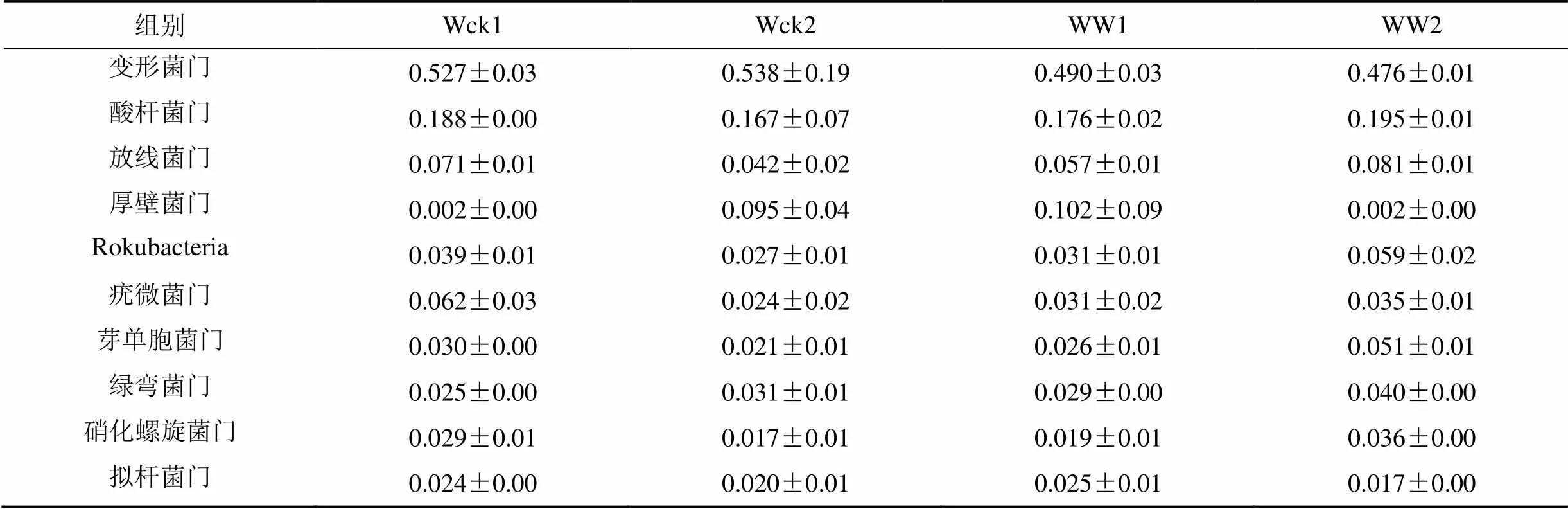
3.4 不同土層土壤微生物群落特征變化
3.5 組間差異性分析
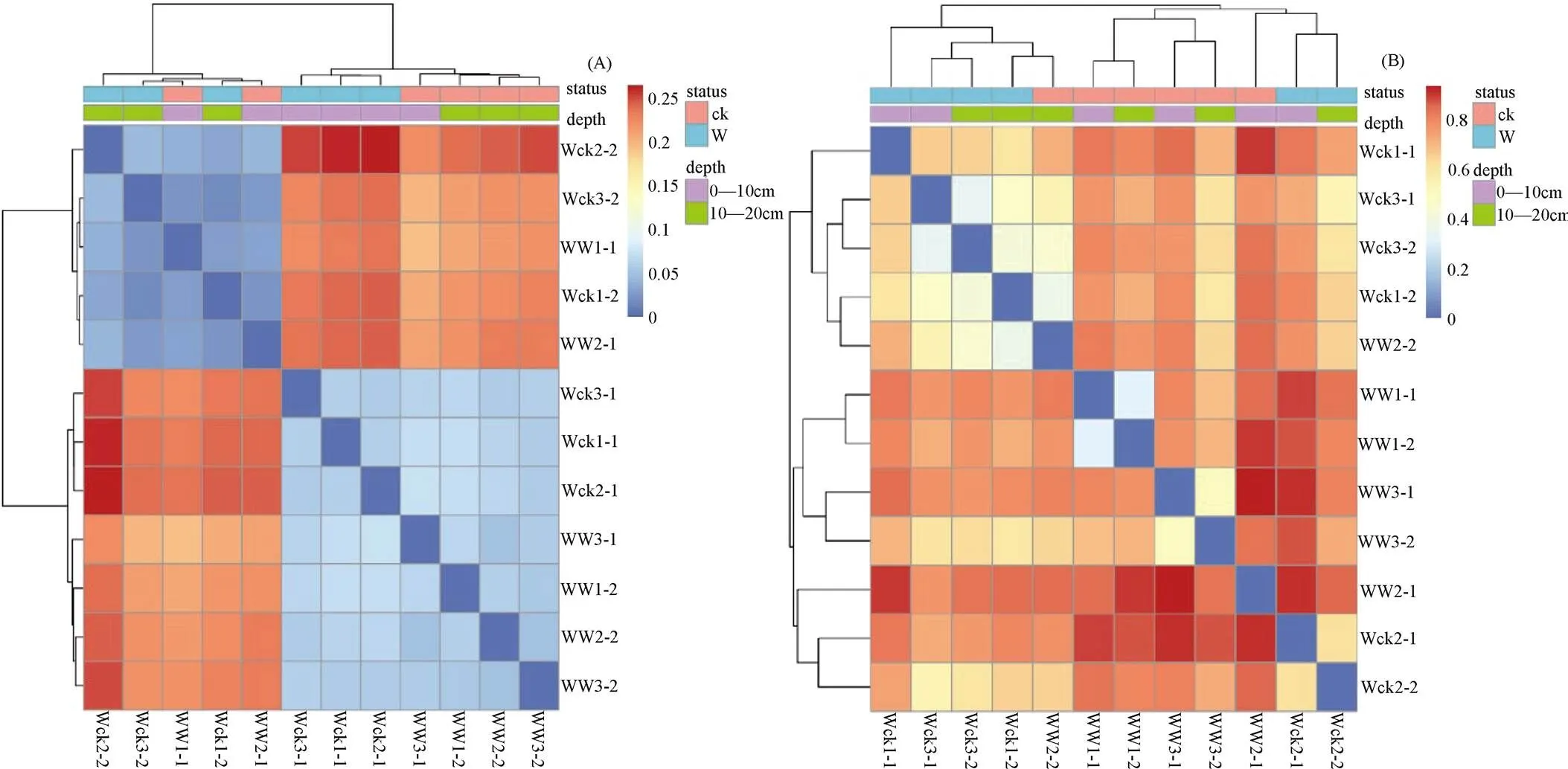
4 討論
5 結論

