冬凌草甲素抗結核病理損傷的作用機制研究
李銀虹 劉芳琳 鹿振輝 姜昕
結核分枝桿菌(Mycobacterium tuberculosis,MTB)侵襲人體后,主要定居于巨噬細胞,固有免疫應答對于宿主抵抗MTB感染至關重要。NOD 樣受體家族蛋白3(NOD-like receptor protein 3,NLRP3)是目前研究最廣泛、機制了解相對透徹的炎癥小體,其在調節固有免疫和炎癥信號轉導方面發揮著重要作用。研究發現,內質網應激(endoplasmic reticulum stress,ERS)可活化NLRP3炎癥小體介導炎癥反應,影響炎癥性疾病的發生發展。硫氧還蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)是ERS與NLRP3炎癥小體活化之間的關鍵聯系[1-3]。ERS 可通過TXNIP 活化NLRP3炎癥小體介導白細胞介素(IL)-1β分泌[4]。ERS也可通過核因子κB(NF-κB)誘導IL-1β前體(pro-IL-1β)表達,并通過TXNIP促進IL-1β 分泌[5]。基于此,尋找可以干預ERS/TXNIP/NLRP3炎癥小體信號通路的藥物成為目前研究炎癥性疾病治療的一個新靶點。
近年來,宿主導向療法(host-directed therapies,HDT)成為結核病防治的新型策略。HDT 可通過調節宿主免疫功能來加強機體抗結核作用,同時減輕過度炎癥導致的組織損傷,達到既清除MTB又避免機體損傷的目的。HDT 可以與世界衛生組織推薦的直接督導短程化療(directly observed treatment short-course,DOTS)聯用,降低過度炎癥反應引起的肺損傷、縮短疾病病程、降低耐藥性的發生[6-7]。
我國中草藥資源豐富,從中尋找有效中藥成分,通過調控宿主免疫功能、增強宿主細胞的抗菌機制以清除MTB、治療或減輕結核病癥狀成為目前結核病防治的研究熱點。中藥冬凌草制劑冬凌草片為臨床非處方藥,廣泛用于抗炎治療[8]。冬凌草甲素(Oridonin)是從中提取的貝殼烯二萜類天然有機化合物,占冬凌草有效成分的90%以上,為無色針狀結晶,具有抗炎、抗腫瘤、免疫調節等功能[9]。He等[10]研究發現,冬凌草甲素通過共價鍵直接結合NLRP3,抑制NLRP3炎癥小體活化,發揮抗炎功能。這提示冬凌草甲素及其類似物可作為治療NLRP3相關疾病,尤其是慢性疾病的潛在治療藥物。曾慶鐘等[11]發現冬凌草甲素通過調節結腸上皮組織ERS從而緩解小鼠結腸炎癥。冬凌草甲素在MTB感染中的作用,還未見相關報道,因此,筆者探討冬凌草甲素在MTB感染的巨噬細胞中的抗炎機制,以期為冬凌草制劑的臨床作用機制提供相關實驗實依據。
材料和方法
一、材料及試劑
MTB標準株H37Ra、小鼠巨噬細胞Raw264.7保存于本實驗室。冬凌草甲素購自上海同田生物技術股份有限公司;DMEM 高糖培養基購自美國Hyclone公司;胎牛血清購自以色列BI 公司;Middle Brook 7H9、7H10培養基購自美國BD 公司;四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白濃度測定試劑盒,以及蛋白質裂解液(RIPA)購自上海碧云天生物技術有限公司;兔抗鼠NLRP3、免疫球蛋白結合蛋白(Bip)、CCAAT/增強子結合蛋白同源蛋白(CHOP)、真核生物翻譯起始因子2α(peIF2α)、磷酸化肌醇需要酶1α(pIRE1α)、肌醇需要酶1α(IRE1α)、pp65、磷酸化應激活化蛋白激酶(pJNK)及pp38單克隆抗體購自美國CST 公司,TXNIP單克隆抗體購自美國SC公司,pIRE1α單克隆抗體購自美國NOVUS公司,小鼠抗肌動蛋白單克隆抗體購自美國Proteintech公司;辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗兔、羊抗鼠二抗購自美國CST公司。
二、方法
1.Raw264.7細胞的培養:Raw264.7細胞用含10%胎牛血清的DMEM 培養基,放置于37℃、含5%CO2的培養箱中培養。
2.冬凌草甲素對Raw264.7細胞的細胞毒性實驗:冬凌草甲素用二甲基亞砜(DMSO)溶解制備成100 mmol/L的藥物儲液,Raw264.7細胞生長至對數期,收集后鋪板于96孔板中,細胞濃度為2×104/孔,加入不同濃度(0.5、1.0、2.0、4.0、8.0μmol/L)的冬凌草甲素,并設空白組、DMSO 對照組,每組設6個復孔。放置于37℃、含5%CO2的培養箱中分別培養24、48、72 h 后,避光加入MTT,10μl/孔,放入培養箱繼續培養4 h,酶標儀測定各孔的吸光度值(A490值),根據各孔平均值,繪制細胞生長曲線。細胞存活率(%)=(A490值-A空白組值)/(ADMSO組值-A空白組值)×100%。
3.MTB標準株H37Ra的培養:H37Ra菌株用含有10%白蛋白-葡萄糖-過氧化氫酶(albumin dextrose catalase,ADC)營養添加劑的Middle Brook 7H9液體培養基,37℃培養箱培養生長至對數期。
4.H37Ra 菌株感染巨噬細胞模型的建立:Raw264.7細胞離心收集后,鋪板于6孔板中,細胞濃度為1×106/孔,設空白組、模型組、藥物處理組,每組3個復孔,37℃培養箱培養過夜。收集生長至對數期的MTB,磷酸鹽緩沖液(PBS)洗3遍,按感染復數(MOI,即細菌∶細胞=10∶1)加入模型組、藥物處理組,共孵育4 h后,PBS洗3遍,以便棄掉未進入胞內的MTB;而后細胞分別采用不同濃度的冬凌草甲素干預不同的時間,模型組用PBS處理。
5.蛋白免疫印跡法檢測Raw264.7細胞相關蛋白的表達水平:以冬凌草甲素(4.0μmol/L)分別處理模型組細胞6、12、24 h。預冷PBS洗3遍后,加入預冷的RIPA 細胞裂解液,冰上裂解30 min。4℃、離心半徑10 cm,12 000 r/min離心15 min,收集蛋白上清。BCA法檢測蛋白濃度,然后將蛋白與上樣緩沖液(loading buffer)混合后煮沸。在SDS-聚丙烯酰胺凝膠(SDS-PAGE)上分離蛋白并轉印至硝酸纖維素膜上,5%脫脂牛奶封閉2.5 h后,將硝酸纖維素膜轉移至預先按1∶1000進行稀釋好的兔抗NLRP3、Bip、CHOP、peIF2α、pIRE1α/IRE1α、pp65、pJNK及pp38單克隆抗體,以及鼠抗TXNIP單克隆抗體、小鼠抗肌動蛋白單克隆抗體中,4℃搖床孵育過夜。次日Tris-吐溫緩沖液(Tris-buffered saline Tween,TBST)洗3次,每次10 min,然后將膜放入1∶5000稀釋的HRP標記的羊抗兔或羊抗鼠二抗中,室溫孵育1 h,TBST 洗3次。用增強化學發光(enhanced chemiluminescence,ECL)顯影劑在Protein Sample儀器上進行顯影,用Image J軟件進行圖像的蛋白灰度值測定。
三、制圖與統計學處理
采用SPSS 26.0軟件進行數據分析,正態分布的計量資料以“”描述,組間差異的比較采用單因素方差分析或重復測量數據的方差分析,兩兩比較采用Turkey’s檢驗。以P<0.05為差異有統計學意義。
結果
一、冬凌草甲素對Raw264.7細胞活力的影響
在不同時間點(24、48、72 h)用MTT法檢測不同濃度(0.5、1.0、2.0、4.0μmol/L)冬凌草甲素處理后細胞的存活情況。結果顯示,冬凌草甲素作用24 h、48 h和72 h細胞的存活率均能保持在90%左右,4.0μmol/L 的冬凌草甲素處理細胞72 h后,Raw264.7細胞的生存率仍能達到(101.60±0.61)%,見表1。為此,后續實驗選擇4.0μmol/L不存在細胞毒性,為最大藥物安全使用濃度。
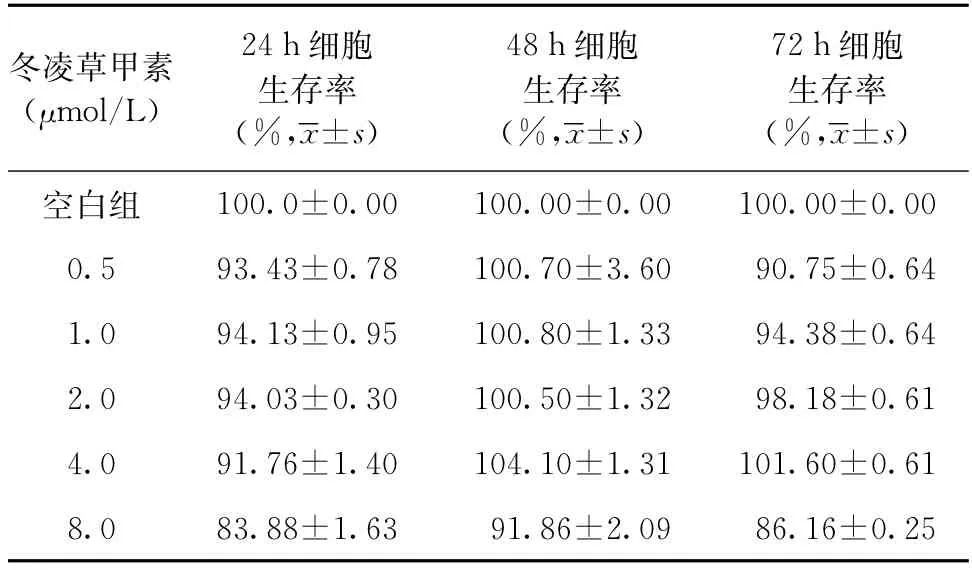
表1 不同濃度冬凌草甲素作用下Raw264.7細胞的生存情況
二、冬凌草甲素抑制MTB 感染的Raw264.7細胞NLRP3炎癥小體活化
利用蛋白免疫印跡法檢測NLRP3炎癥小體活化情況,以小鼠肌動蛋白為內參。與模型組相比,冬凌草甲素(4.0μmol/L)作用(6、12、24 h)可明顯抑制MTB感染的Raw264.7細胞NLRP3和TXNIP蛋白的表達,見表2。
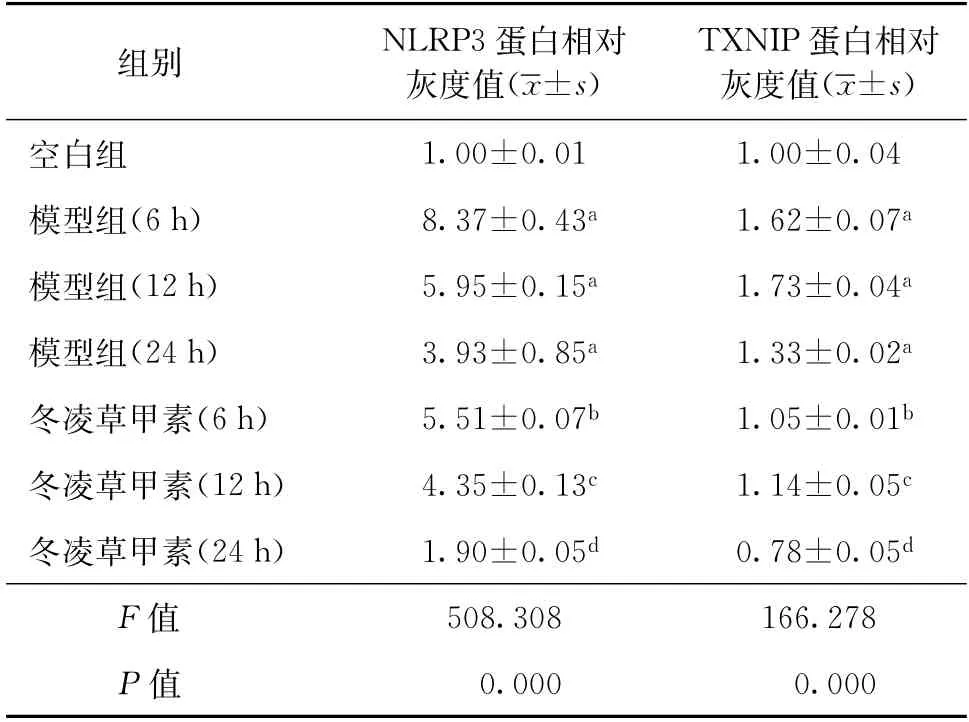
表2 冬凌草甲素作用MTB感染的Raw264.7細胞不同時間對NLRP3炎癥小體活化的影響
三、冬凌草甲素抑制MTB 感染的Raw264.7細胞內質網應激
利用蛋白免疫印跡法檢測內質網應激相關蛋白(Bip、CHOP、peIF2α、IRE1α及pIRE1α)的表達情況,以小鼠肌動蛋白為內參。與模型組相比,冬凌草甲素(4.0μmol/L)作用(6、12、24 h)可明顯抑制MTB感染的Raw264.7細胞內質網應激相關蛋白的表達,見表3。
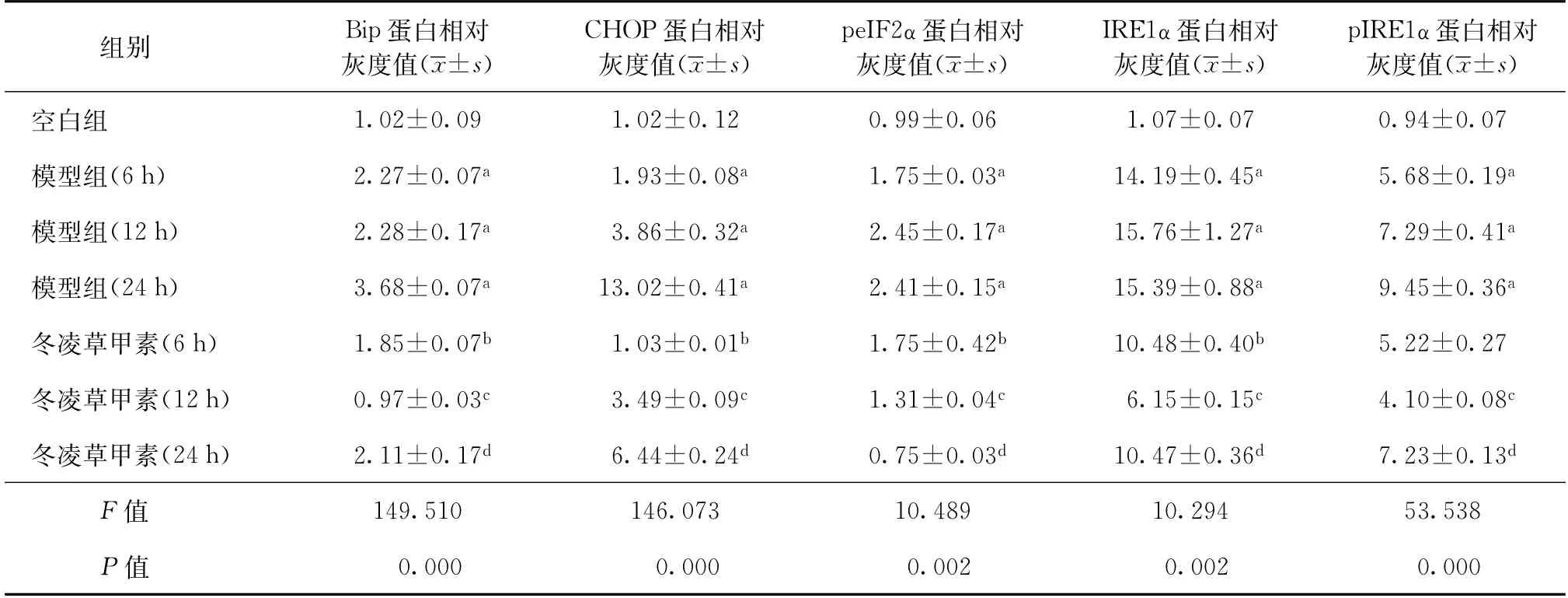
表3 冬凌草甲素作用MTB感染的Raw264.7細胞不同時間對內質網應激的影響
四、冬凌草甲素抑制MTB 感染的Raw264.7細胞內質網應激IRE1α通路下游蛋白的表達
利用蛋白免疫印跡法檢測內質網應激情況。以小鼠肌動蛋白為內參,與模型組相比,冬凌草甲素(4.0μmol/L)作用(6、12、24 h)可明顯抑制MTB感染的Raw264.7 細胞IRE1α 通路下游相關蛋白(pp65、pJNK、pp38)的表達,見表4。
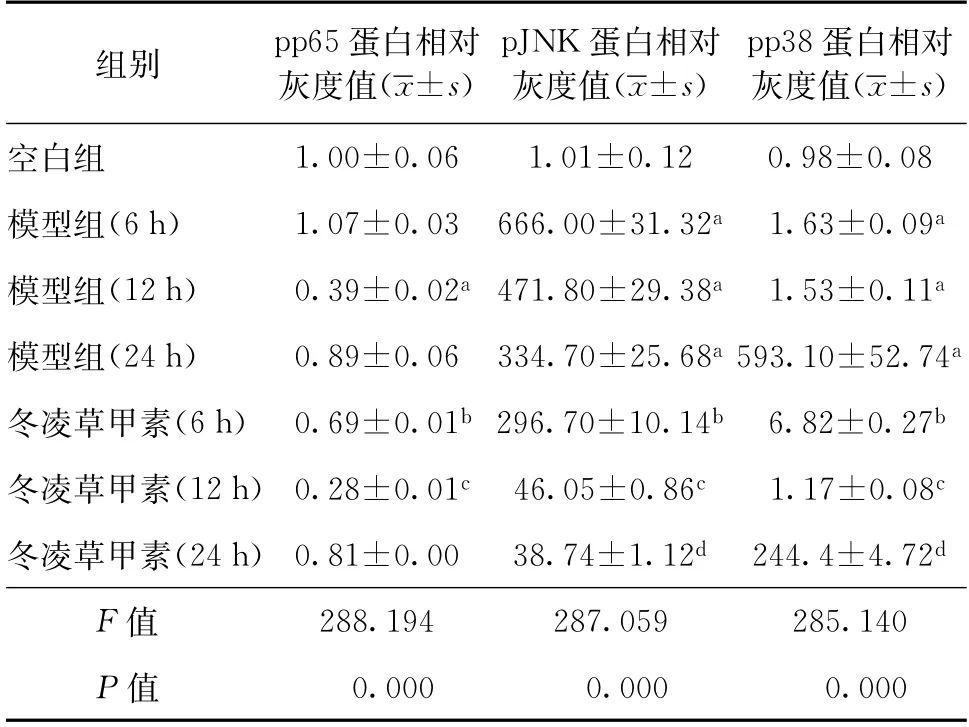
表4 冬凌草甲素作用MTB感染的Raw264.7細胞不同時間對內質網應激IRE1α通路下游相關蛋白的影響
討 論
研究發現,冬凌草甲素對大腸埃希菌、金黃色葡萄球菌、白色鏈球菌、枯草芽孢桿菌及銅綠假單胞菌有明顯的抗菌作用[12]。冬凌草甲素可通過減少一氧化氮、腫瘤壞死因子α、白細胞介素-1β(IL-1β)、IL-6釋放緩解炎癥反應,同時抑制DNA 逆轉錄酶NF-κB結合,從而減輕脂多糖對大鼠小神經膠質細胞的刺激作用[13]。然而結核病模型中,還未見有關冬凌草甲素的相關報道。
本次實驗首先通過MTT法檢測冬凌草甲素對Raw274.7細胞的細胞毒性,發現冬凌草甲素在4.0μmol/L濃度以下作用24、48、72 h時細胞的存活率均在90%以上,可見冬凌草甲素在4.0μmol/L濃度下對細胞的毒性較小,因此,本次實驗選用4.0μmol/L作為冬凌草甲素的最大安全使用濃度。
MTB感染巨噬細胞可以活化NLRP3炎癥小體,介導成熟IL-1β的釋放[14-16]。多種信號可誘導NLRP3炎癥小體活化,其中,TXNIP與NLRP3的結合在NLRP3炎癥小體組裝及活化中發揮重要作用[17]。當細胞受到危險信號如尿酸晶體等刺激后,原本與硫氧還蛋白結合的TXNIP與之分離,并與NLRP3直接結合,活化NLRP3炎癥小體[18]。相關實驗研究發現,干擾TXNIP蛋白表達可在一定程度上阻斷NLRP3炎癥小體活化,從而影響下游成熟IL-1β的釋放[19]。本次研究通過冬凌草甲素干預MTB感染的Raw264.7巨噬細胞,蛋白免疫印跡法檢測提示MTB感染后,NLRP3及TXNIP蛋白表達均明顯升高,冬凌草甲素作用6、12及24 h后,可明顯抑制NLRP3及TXNIP蛋白的表達,TXNIP與NLRP3結合減少,從而抑制NLRP3炎癥小體活化。那么炎癥小體活化是通過何種機制調控的?筆者又做了進一步研究。
內質網應激激活未折疊蛋白反應后可通過IRE1α和PERK 促進TXNIP 轉錄,抑制TXNIP mRNA降解,活化NLRP3炎癥小體[20]。本次研究通過蛋白免疫印跡法檢測發現冬凌草甲素可明顯抑制內質網標志蛋白Bip和CHOP[21]的表達水平,同時,明顯抑制與Bip 解離的內質網跨膜蛋白pIRE1α、IRE1α及peIF2α的表達,提示冬凌草甲素可明顯抑制MTB感染誘導的內質網應激。發生內質網應激后,解離的IRE1α可形成IRE1/TRAF2/ASK1復合物,誘導絲裂原活化蛋白激酶(MAPK)通路中的JNK 和p38MAPK 下游活化。MAPK/NF-κB信號傳導通路是炎癥反應的經典通路,抑制該信號的傳導可緩解炎癥反應[22]。蛋白免疫印跡法檢測結果提示,冬凌草甲素明顯抑制MTB感染的Raw264.7細胞中IRE1α通路下游蛋白pJNK、pp38、pp65表達水平。基于以上研究結果,冬凌草甲素在MTB感染巨噬細胞中可能通過調控內質網應激,干預TXNIP/NLRP3 信號通路,從而抑制NLRP3炎癥小體活化,發揮抗炎癥損傷的作用。
綜上所述,基于本研究的結果,筆者推測,冬凌草甲素有可能成為新的HDT 候選藥,作為輔助用藥與臨床一線抗結核藥物聯合用于結核病的防治。另外,本實驗尚存在一些不足之處,例如:細胞模型相對單一、未開展動物體內實驗驗證等,需在后續工作中進一步完善。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻李銀虹:直接參與(實施研究、采集數據、分析/解釋數據)、文章撰寫(起草文章)、工作支持(統計分析);劉芳琳:直接參與(實施研究、采集數據);鹿振輝:直接參與(分析/解釋數據)、文章撰寫(對文章的知識性內容作批評性審閱)、工作支持(支持性貢獻);姜昕:直接參與(醞釀和設計實驗、分析/解釋數據)、文章撰寫(對文章的知識性內容作批評性審閱)、工作支持(獲取研究經費、指導、支持性貢獻)

