迷迭香提取物延長雌性果蠅壽命研究
沈彬,王懿椿,張瑜,尚逢實,杜曉梅,王曉丹,王華麗,王浩*
(1.中科蘭丁(天津)自然醫學研究院,天津 300308;2.天津科技大學食品科學與工程學院,天津 300457;3.國家風險評估中心,北京 100022)
衰老是一種不可避免的生理現象,它會導致人類器官功能逐漸下降。“衰老的自由基理論”得到了許多研究的支持[1]。據報道,活性氧(reactive oxygen species,ROS)是導致衰老的主要因素之一[2]。在生物體中,維持適當水平的ROS 是維持氧化還原穩態的關鍵。在一個健康的狀態下,自由基被用來清除衰老的細胞,清理或控制突變的細胞,從而使身體處于一個和諧有序的狀態[3]。然而,過量的過氧化物和自由基引起的氧化應激可導致細胞凋亡或壞死,導致許多疾病發生,從而加速衰老。隨著年齡的增長,內源性抗氧化酶活性降低,導致抗氧化防御系統的功能降低,自由基損傷增加,進而衰老[4]。
迷迭香是唇形科迷迭香屬植物,產地在地中海沿岸,具有長遠的發展歷史[5]。迷迭香提取物(rosemary extract,RE)具有良好的抗氧化、抗炎、抗菌、調節免疫功能和改善脂質代謝等多種生物學功能,是替代抗生素的潛在產品[6]。許多報道顯示RE 中有鼠尾草酸、鼠尾草酚、迷迭香酸等多種活性物質[7]。前期試驗也發現1.5 mg/mL RE 對雌雄果蠅都有一定的抗氧化作用,并且可以有效延緩高脂導致的氧化損傷從而進一步延緩衰老[8-10]。黑腹果蠅作為一種經典的模式生物,其衰老基因與代謝途徑與人類非常相似[11]。研究發現雌性果蠅的雌激素含量高,而且腸道發育的敏感性要比雄性果蠅強[12],所以選擇雌性果蠅作為模型研究腸道。
在分子水平上,人體的衰老與胰島素通路密切相關,胰島素途徑是一個高度保守的轉導途徑,調控生命周期[13]。Akt 作為胰島素通路和雷帕霉素通路之間的樞紐,被胰島素生長因子激活,抑制mTOR 負調控因子TSC2 的活性和TSC1 的活性,從而減少自噬調控,加速衰老[14]。近年來,有研究發現自噬可以調節腸道干細胞(intestinal stem cells,ISCs)的增殖以及腸道屏障功能障礙,以維持腸道穩態,減少由腸道失衡引起的疾病[15]。
近年來,RE 的抗氧化活性已被廣泛報道,但其在mTOR 和自噬通路中調控壽命的機制研究較少。因此,本論文研究了RE 對雌性果蠅的抗氧化作用,及其對雌性果蠅衰老過程腸道功能的調節作用和潛在的分子機制,為RE 產品的開發和進一步探索提供參考。
1 材料與方法
1.1 材料與試劑
RE:天津尖峰天然產物研究開發有限公司;野生型果蠅W1118:天津科技大學食品添加劑與營養調控研究室提供;Esg-Gal4 UAS-GFP 轉基因型果蠅(該品系果蠅特異性的攜帶標記果蠅腸道前體細胞綠色熒光蛋白):東北林業大學生命科學學院提供;過氧化氫、非消化染料(FD&C blue NO.1)、Trizol 試劑、SYBR Green染料、Lyso-Tracker Red 熒光探針:美國Sigma 公司。
cDNA(complementary DNA)反轉錄試劑盒:美國Sigma 公司;總超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、銅鋅超氧化物歧化酶(Cu/Zn-superoxide dismutase,Cu/Zn-SOD)、錳超氧化物歧化酶(Mn-superoxide dismutase,Mn-SOD)試劑盒、過氧化氫酶(catalase,CAT)試劑盒、丙二醛(malondialdehyde,MDA)試劑盒:南京建成試劑公司。乳酸桿菌瓊脂、胰蛋白胨、酵母浸粉、氯化鈉、葡萄糖、瓊脂、甘露醇、營養瓊脂(均為分析純):北京鼎國昌盛生物技術公司。所需基因引物由北京鼎國昌盛生物技術公司設計。
1.2 儀器與設備
OLYMPUSU-RFLT50 型熒光顯微鏡:日本Olympus公司;G:box 凝膠圖像采集分析系統:英國Syngene 公司;BIO-RAD 實時定量聚合酶鏈式反應(polymerase chain reaction,PCR)儀:北京元業伯樂科技發展有限公司;Thermo Finnigan Surveyor 液相色譜-質譜聯用儀(liquid chromatograph mass spectrometer,LC-MS):美國Thermo Finnigan公司;SMZ-140 酶標儀:麥克奧迪(廈門)電氣股份有限公司;玻璃勻漿器:安徽韋斯實驗設備有限公司。
1.3 RE 的成分分析
采用Thermo Finnigan Surveyor LC-MS 系統,配備光電二極管陣列檢測器和Venusil XBP C18柱(2.1 mm×150 mm)對迷迭香提取物中的成分進行測定。流速0.2 mL/min、檢測波長280 nm、烘箱溫度30 ℃。流動相為0.1%A 相(甲酸)和B 相(乙腈)。梯度洗脫程序:10%B 0~5 min;20%B 40 min~45 min;90%B:45 min~55 min;最后用10%B 浸泡55.1 min~60.0 min。采用電噴霧電離源(electron spray ionization,ESI)進行正電離模式下的質譜分析。ESI 噴霧電壓為4.5 kV,毛細管電壓為-10 V,毛細管溫度為275 ℃,氮氣(N2)流量為30 arb,輔助氣流量為5 arb。全掃描模式下分子量范圍為100~500 m/z。
1.4 果蠅培養基的配制
果蠅基礎培養基(750 mL):蒸餾水(750 mL)、玉米粉(72 g)、無水葡萄糖(72 g)、酵母粉(10 g)、瓊脂粉(6 g)、防腐劑(40 mL)(1%對羥基苯甲酸乙酯)[16]。果蠅實驗培養基由基礎培養基添加RE(0.2、0.5、1.5 mg/mL)配制而成。
1.5 壽命實驗
2 d 未交配的野生型果蠅W1118被分為4 組,每組各200 只。一組基礎飲食為對照組,另3 組分別為0.2、0.5、1.5 mg/mL RE 實驗組。每3 d 更換一次培養基,并記錄存活只數。最大壽命計算為10%最長存活時間[17]。
1.6 攝食量和體重實驗
收集羽化后2 d 的野生型果蠅W1118,隨機分成4組,每組200 只,果蠅培養如1.5 果蠅壽命培養方法。攝食量測定實驗:培養4 d,先轉移到含有用蒸餾水浸濕的濾紙條的空管中,饑餓2 h,然后轉移到含有0.2%羅丹明B 磺酸鈉鹽的飲食中2 h。采用雙盲法主觀評分0(無色腹部)到5(完全紅色腹部)測量紅色腹部的程度,以紅色程度作為每只果蠅的食物攝入量指標[17]。體重實驗:體重變化也被認為是食物攝入量的一個指標。在飼養第20 天,用CO2麻醉果蠅,然后稱量并計算果蠅平均體重[18]。
1.7 攀爬實驗
用RE(0.2、0.5、1.5 mg/mL)或對照處理的黑腹果蠅在0、15、30、45 d 轉移到空管中,計時統計20 s 內爬升超過7 cm 的果蠅的數量。實驗平行測定3 次[18]。
1.8 應激損傷實驗
收集羽化后2 d 的野生型果蠅W1118,隨機分成4 組,每組200 只。RE(0.2、0.5、1.5 mg/mL)或對照處理至25 d 時將果蠅饑餓2 h,然后轉移到新的小瓶中,其中含浸有1 mL 飽和30%過氧化氫(H2O2)或含20 mmol/L百草枯的6%葡萄糖溶液的濾紙條。每2 h 計數一次存活只數,直到果蠅全部死亡,每個獨立實驗重復3 次[9]。
1.9 “藍精靈”實驗
收集羽化后2 d 的野生型果蠅W1118,隨機分成4組,每組200 只,果蠅培養如1.5 果蠅壽命培養方法。第20 天和第50 天,對照組果蠅在不添加RE 且含有2.5%藍色染料的培養基中喂養,實驗組果蠅在添加不同濃度RE 且含有2.5%藍色染料的培養基中喂養。饑餓2 h 后,喂食藍色染料9 h,之后用CO2迷暈,并在顯微鏡下觀察其腹部狀態,統計“藍精靈”的數量[17]。每個獨立實驗重復3 次。
1.10 腸道菌落總數測定
乳酸桿菌(Lactobacilli,LMRS)選擇性培養基:70 g/L 乳酸桿菌瓊脂;腸桿菌(Enterobacteria,ENT)選擇性培養基:10 g/L 胰蛋白胨、1.5 g/L 酵母浸粉、10 g/L葡萄糖、5 g/L 氯化鈉、12 g/L 瓊脂;醋酸桿菌(Acetobacteria,ACE)選擇性培養基:25 g/L 甘露醇、5 g/L 酵母浸粉、3 g/L 胰蛋白胨、15 g/L 瓊脂;營養培養基(nutrient rich medium,NR):23 g/L 營養瓊脂。
收集羽化后2 d 的野生型果蠅W1118,隨機分成4組,每組200 只,果蠅培養如1.5 果蠅壽命培養方法。飼養到20、50 d 時,禁食2 h,用CO2麻醉后,在顯微鏡下用解剖針取出中腸(n=10),置于1 mL 磷酸鹽緩沖液(pH6)中,然后用玻璃勻漿器研磨并稀釋,取0.1 mL稀釋液,分別涂布在腸桿菌(ENT)、乳酸菌(LMRS)、醋酸桿菌(ACE)的選擇培養基和營養培養基(NR),采用平板菌落計數法計算腸道菌落總數[16]。每個獨立實驗重復3 次。
1.11 熒光染色和熒光顯微鏡觀察
Esg-Gal UAS-GFP 果蠅以RE(0.2、0.5、1.5 mg/mL)或對照飼料培養20 d 或50 d 后,解剖出中腸,在倒置熒光顯微鏡下觀察熒光點。在熒光染色實驗中,RE 或普通飼料喂養果蠅20 d 后,在磷酸鹽緩沖液中解剖取腸道,用1μmol/L Lyso-Tracker Red 熒光染色液染色3min;用磷酸鹽緩沖液(pH6)清洗,4%甲醛溶液固定30 min,之后用70%甘油封片。使用倒置熒光顯微鏡進行觀察[19]。每個獨立實驗重復3 次。
1.12 抗氧化酶活性和脂質過氧化物含量測定
收集羽化后2 d 的野生型果蠅W111(8n=200),按照1.5 中的果蠅壽命培養方法培養。將果蠅連續培養45 d,饑餓2 h,稱重,按體重與生理鹽水1 ∶9(mg/mL)勻漿并稀釋,取上清液,按照SOD、CAT、MDA 試劑盒方法測定SOD、CAT 的酶活性和MDA 的含量[20]。
1.13 實時熒光定量聚合酶鏈式反應實驗
用RE(0.2、0.5、1.5 mg/mL)或對照飲食喂食果蠅45 d,在液氮中研磨。總RNA 采用TRizol 提取,采用cDNA 反轉錄試劑盒構建cDNA。根據循環閾值(cycle threshold,CT)值計算基因表達量。每個基因擴增的引物信息見表1(以RP49 為內參基因)。

表1 引物檢測果蠅基因PCR 引物Table 1 PCR primers used for the measurement of genes mRNA expression in Drosophila melanogaster
1.14 統計分析
使用Origin 2021 進行統計分析,結果以平均值±標準差表示。生存實驗采用SPSS 17.0 軟件的Kaplan-Meier 分析,采用log-rank 檢驗分析組間顯著差異。采用單因素方差分析法評估均數間差異的顯著性。采用ImageJ 軟件分析熒光水平。P<0.05 表示差異顯著,而P<0.01 表示差異極顯著。
2 結果與分析
2.1 RE 的組成
采用LC-MS 分析鑒定RE 中的活性成分,結果見表2。
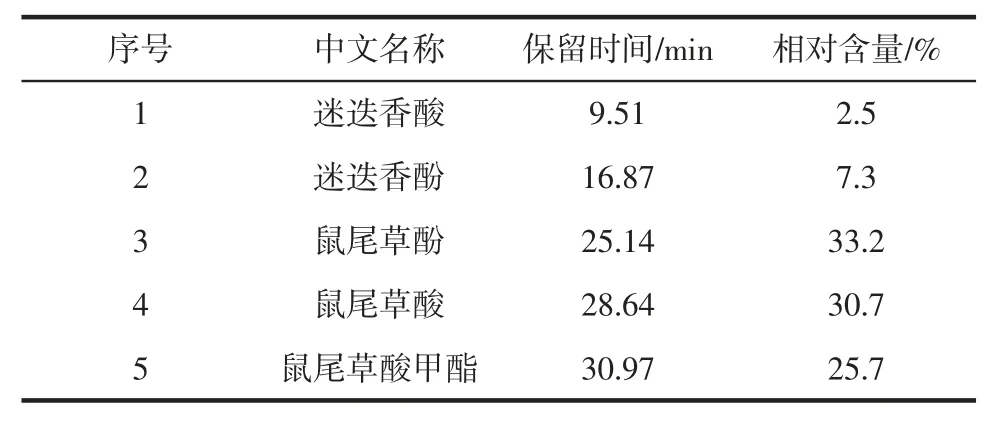
表2 RE 中的主要活性成分Table 2 Main active ingredients in RE
通過液相色譜質譜聯用儀共分離鑒定出5 種不同的化合物,如表2 所示,分別為鼠尾草酚、鼠尾草酸、迷迭香酚、迷迭香酸、鼠尾草酸甲酯。
2.2 RE 對果蠅壽命的影響
RE 對雌性果蠅壽命的影響見表3。
表3 RE 對雌性果蠅平均壽命和最大壽命的影響(±s)Table 3 Effects of RE on average lifespan and maximum lifespan of female drosophila(±s)
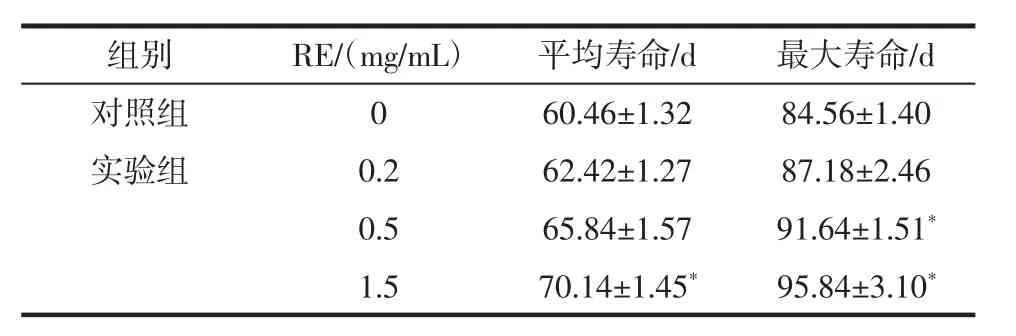
表3 RE 對雌性果蠅平均壽命和最大壽命的影響(±s)Table 3 Effects of RE on average lifespan and maximum lifespan of female drosophila(±s)
注:*表示和對照組相比差異顯著(P<0.05)。
組別 RE/(mg/mL) 平均壽命/d 最大壽命/d對照組 0 60.46±1.32 84.56±1.40實驗組 0.2 62.42±1.27 87.18±2.46 0.5 65.84±1.57 91.64±1.51*1.5 70.14±1.45* 95.84±3.10*
隨著身體的自我調節能力和功能的降低[21],衰老過程中往往伴隨著機體對外部壓力適應性或抵抗力的降低[3]。如表3 所示,與對照組相比,1.5 mg/mL RE 組平均壽命從60 d 延長到70 d,延長了16.67%(P<0.05);1.5 mg/mL RE 組最大壽命從84 d 延長到95 d,延長了13.10%(P<0.05)。RE 對雌性果蠅的壽命延長有劑量依賴效應關系。因此,認為RE 具有延緩衰老的效果。
2.3 RE 對果蠅進食量和體重的影響
RE 對雌性果蠅攝食量和體重的影響見圖1 和表4。
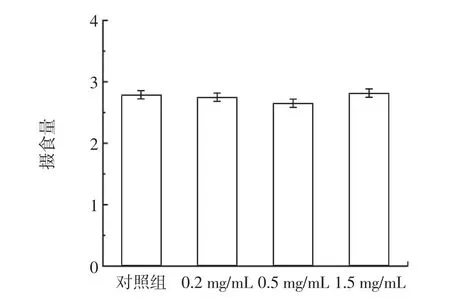
圖1 RE 對雌性果蠅攝食量的影響Fig.1 Effect of RE on food intake of female drosophila
表4 RE 對雌性果蠅體重的影響(±s)Table 4 Effects of RE on body weight of female drosophila(±s)

表4 RE 對雌性果蠅體重的影響(±s)Table 4 Effects of RE on body weight of female drosophila(±s)
組別 RE/(mg/mL) 體重/μg對照組 0 1 124.83±11.19實驗組 0.2 1 119.47±25.21 0.5 1 123.45±23.25 1.5 1 117.01±25.35
飲食限制在之前的報道中被認為有延長壽命的效果[22],本研究為了排除飲食限制對壽命的影響,根據1.6 描述的方法測量了果蠅的體重和攝食量。由表4 可知,雌性果蠅喂食RE 之后,平均體重與對照組相比,無明顯差異;通過測量攝食量發現,實驗組與對照組雌性果蠅的攝食量無明顯差異(圖1)。
2.4 RE 對果蠅爬行能力的影響
隨著機體的衰老,生理功能和自我調節能力逐漸減弱,爬行能力間接反映了機體的健康狀況和衰老程度[19]。RE 對雌性果蠅爬行能力的影響見圖2。
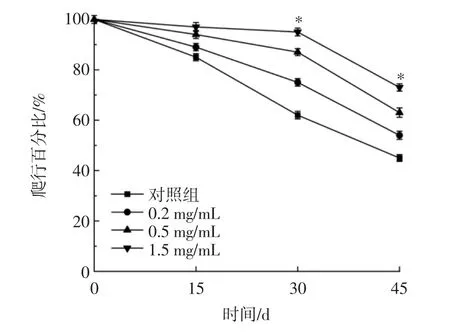
圖2 RE 對雌性果蠅爬行能力的影響Fig.2 Effects of RE on the crawling ability of female drosophila
由圖2 可知,添加RE 的果蠅爬行能力以劑量依賴的方式增加,1.5 mg/mL RE 處理組的平均爬行百分比比對照組顯著增加了18.25%(P<0.05)。在給予RE之后,果蠅的爬行能力明顯被改善,在第30 天和第45 天時,1.5 mg/mL RE 組的平均爬行百分比分別提高了33%和28%。以上結果顯示,RE 可以改善果蠅的爬行能力、增強機體調節能力。
2.5 RE 對果蠅抵抗氧化應激能力的影響
RE 對雌性果蠅百草枯和過氧化氫應激的影響見圖3。
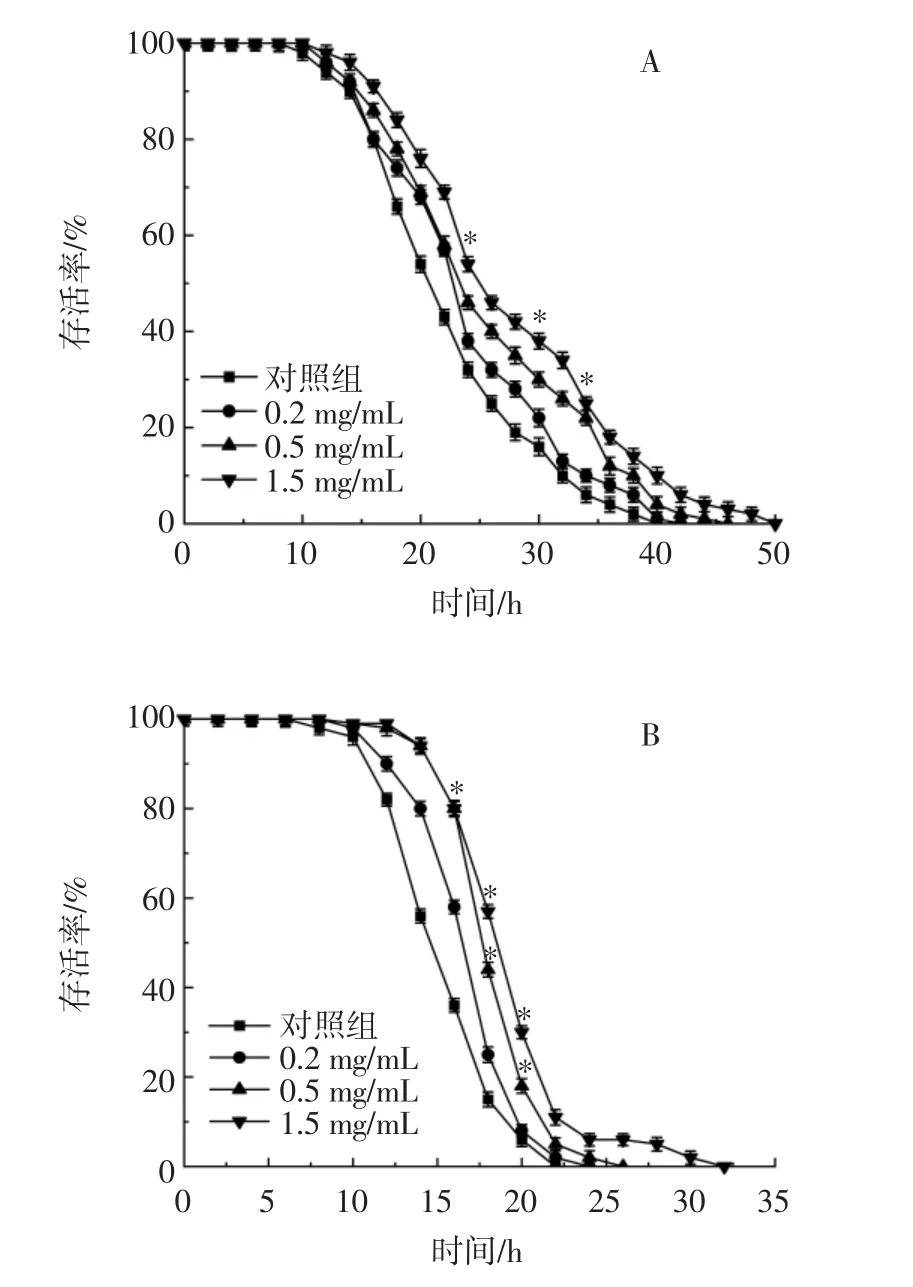
圖3 RE 對雌性果蠅百草枯和過氧化氫應激的影響Fig.3 Effects of RE on paraquat and H2O2 stress in female drosophila
在不同的生物模型中,壽命與壓力耐受性的增加密切相關[23]。正常代謝或環境應激下的氧化還原反應產生ROS,打破細胞內的氧化還原平衡,加速衰老。細胞內內源性抗氧化酶如SOD 和CAT,可以維持ROS的平衡。由圖3 A 可知,0.5、1.5 mg/mL RE 可延長果蠅的最大壽命。與對照組相比,1.5 mg/mL RE 平均壽命顯著增加了26.32%(P<0.05)。由圖3 B 可知,與對照組相比,0.5 mg/mL 和1.5 mg/mL RE 處理組分別延長最大壽命20.01%和50.20%(P<0.05)。以上結果表明,RE 對H2O2和百草枯誘導的氧化損傷具有保護作用。
2.6 RE 對腸道微生物的影響
RE 對雌性果蠅腸道微生物的影響見圖4。
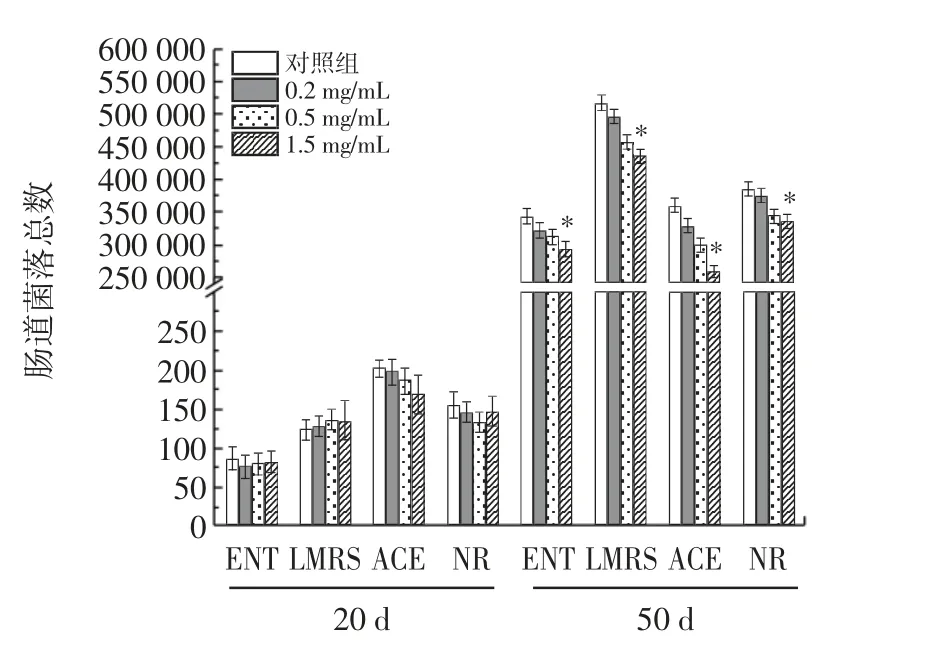
圖4 RE 對雌性果蠅腸道微生物的影響Fig.4 Effects of RE on intestinal microbiota of female Drosophila melanogaster
隨著機體年齡的增長,調節能力減弱,腸道微生物群結構不平衡,發生腸道屏障功能障礙,自由基積累[24]。近年來,腸道穩態被證明在決定果蠅的壽命方面起著重要作用[25]。由圖4 可知,飼喂RE 20 d 后,與對照組相比,RE 組的LMRS、ENT、ACE、NR 均無明顯差異。給予RE 50 d 后,與對照組相比,腸道內微生物數量顯著減少(P<0.05)。其中雌性果蠅干預RE 的濃度為1.5 mg/mL 時,與對照組比較,LMRS、ENT、ACE、NR 分別下調了15.56%、14.62%、28.31%和13.27%(P<0.05)。結果表明,RE 能夠維持年老雌性果蠅腸道微生物平衡,抑制衰老導致的腸道微生物異常增殖。
RE 對果蠅腸道屏障功能的影響見圖5。
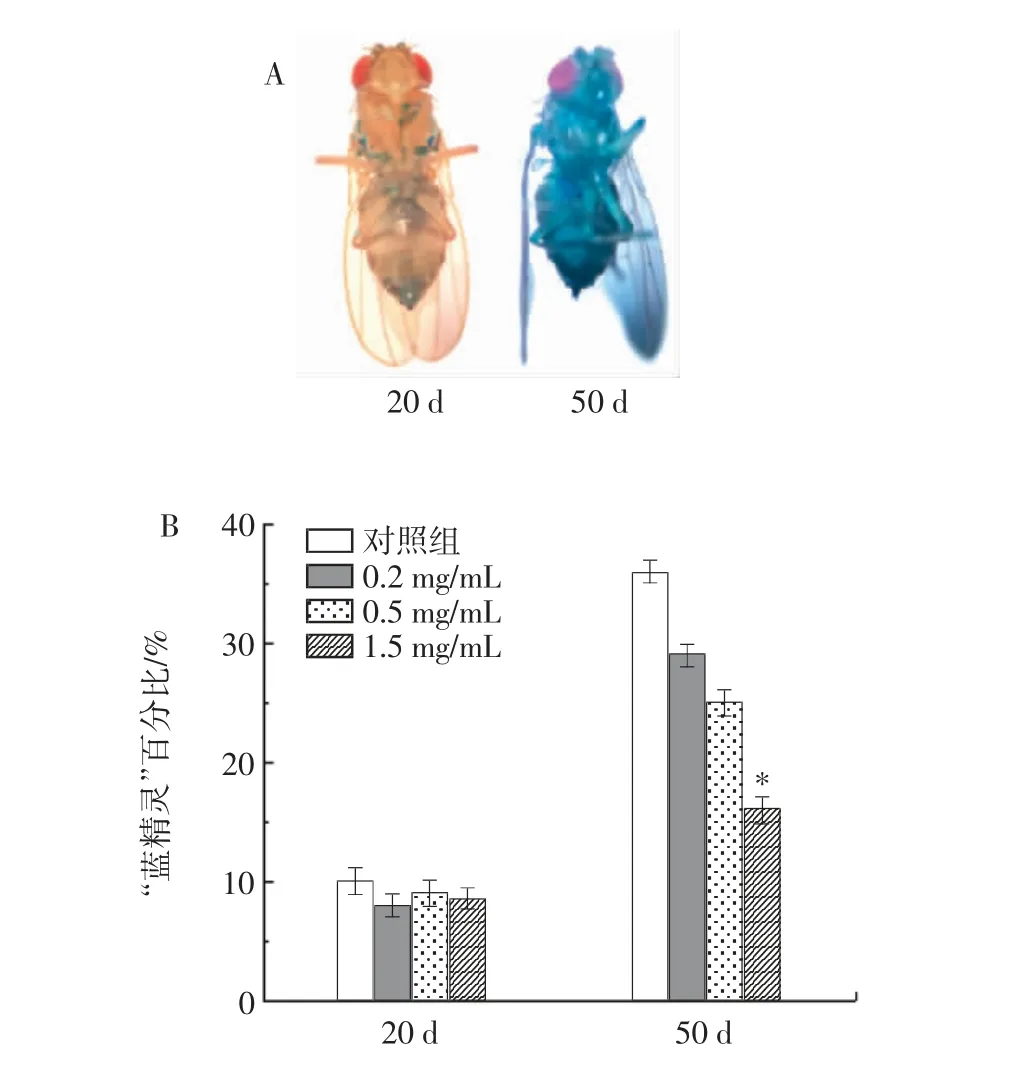
圖5 RE 對果蠅腸道屏障功能的影響Fig.5 Effects of RE on intestinal barrier function in Drosophila melanogaster
在衰老過程中,生理調節功能的下降會導致屏障功能的降低、腸道完整性的降低和通透性的增加。腸道穩態是決定果蠅壽命的因素之一。用一種非消化染料(FD&C blue NO.1)喂養果蠅,以觀察腸道組織的老化情況。如圖5 A 所示,20 d 齡的果蠅喂食藍色染料后,染料僅存在于前列腺和消化道。然而,50 d 齡的果蠅中藍色染料在全身清晰可見。這種全身藍色的果蠅即為“藍精靈”,通過計數“藍精靈”在整體樣本中所占的比例來反映果蠅的腸道老化程度,進一步反映其衰老程度。在圖5 B 中,隨著年齡的增長,對照組的“藍精靈”百分比增加,然而在50 d,與對照組相比,RE 處理的實驗組中藍精靈數量在減少,1.5 mg/mL RE 組減少了22.86%(P<0.05)。因此,RE 可通過改善果蠅的腸道通透性而保護腸道完整性。
2.7 RE 對ISCs 增殖的影響
RE 對雌性果蠅腸道干細胞增殖的影響見圖6 和圖7。
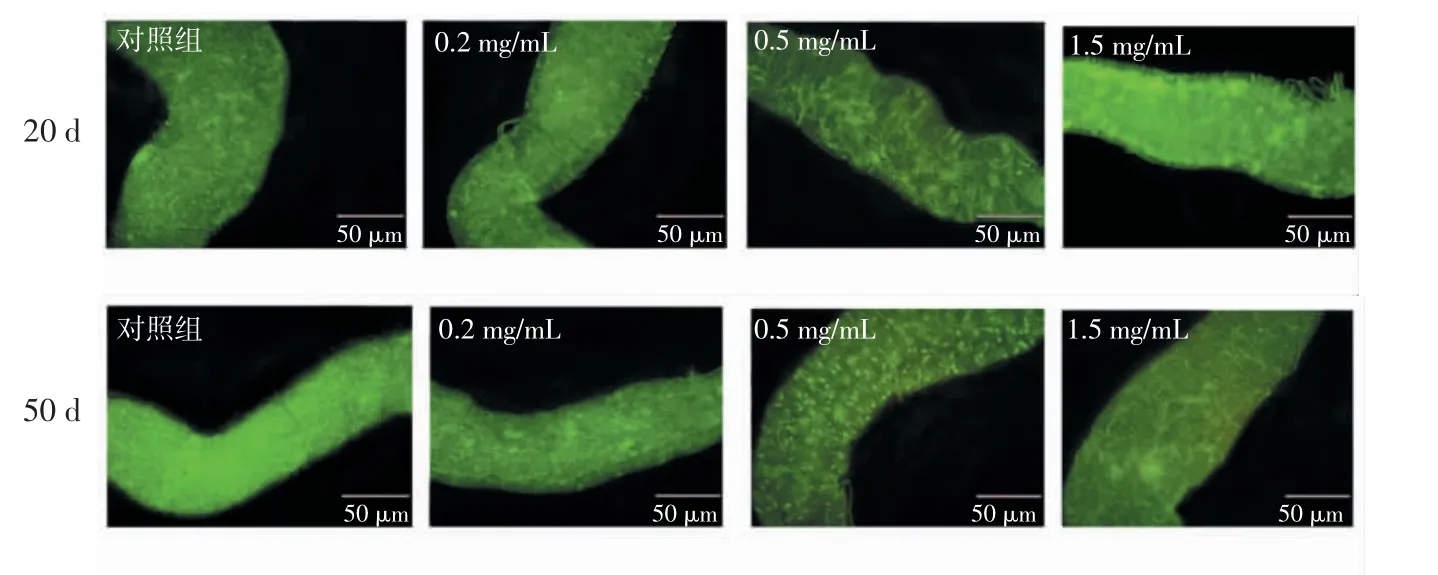
圖6 RE 對雌性果蠅20 d 和50 d 時腸道干細胞增殖的影響Fig.6 Effect of RE on intestinal stem cell proliferation of female drosophila at day 20 and 50
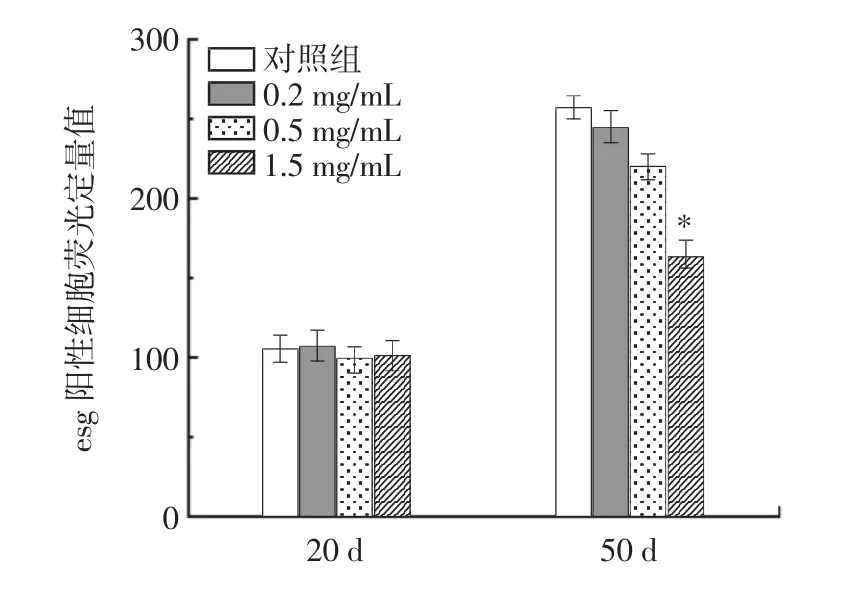
圖7 果蠅腸道干細胞熒光強度定量圖Fig.7 Quantitative fluorescence intensity of intestinal stem cells in drosophila
逐漸衰老果蠅的腸道屏障功能的喪失已被發現與果蠅的基因型和環境條件相關。在果蠅中腸組織穩態由沿著基底膜分布的多能ISCs 維持[26]。隨著果蠅的衰老,果蠅中腸上皮細胞會啟動再生機制,加速干細胞增殖,來維持受損細胞,但也會進一步導致干細胞異常增殖[27]。GFP 陽性細胞可以顯示ISCs 的增殖率,因為esg 在ISCs 和腸細胞中特異性表達[28]。因此,本文檢測了果蠅中腸中esg 的表達情況。圖7 顯示20d 時對照組和RE 組的增殖均保持正常,無顯著性差異(P >0.05)。隨著年齡的增長,ISCs 的增殖顯著增加。由圖7 可知,在老年果蠅(50 d)中,與對照組相比,1.5 mg/mL RE 處理組的esg 陽性細胞數量顯著減少了35.89%(P <0.05)。
2.8 RE 對果蠅抗氧化參數的影響
RE 對總SOD、Cu-Zn-SOD、CAT 活力和MDA 含量的影響見表5。RE 對果蠅抗氧化基因表達量的影響見圖8。
表5 RE 對總SOD、Cu-Zn-SOD、CAT 活性和MDA 含量的影響(±s)Table 5 Effects of RE on total SOD,Cu-Zn-SOD,CAT activity and MDA content(±s)
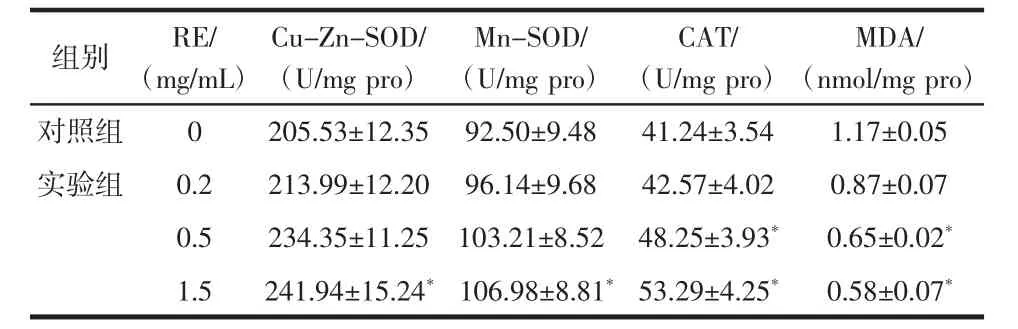
表5 RE 對總SOD、Cu-Zn-SOD、CAT 活性和MDA 含量的影響(±s)Table 5 Effects of RE on total SOD,Cu-Zn-SOD,CAT activity and MDA content(±s)
注:*表示與對照組相比差異顯著(P<0.05)。
MDA/(nmol/mg pro)對照組 0 205.53±12.35 92.50±9.48 41.24±3.54 1.17±0.05實驗組 0.2 213.99±12.20 96.14±9.68 42.57±4.02 0.87±0.07 0.5 234.35±11.25 103.21±8.52 48.25±3.93* 0.65±0.02*1.5 241.94±15.24* 106.98±8.81* 53.29±4.25* 0.58±0.07*組別 RE/(mg/mL)Cu-Zn-SOD/(U/mg pro)Mn-SOD/(U/mg pro)CAT/(U/mg pro)
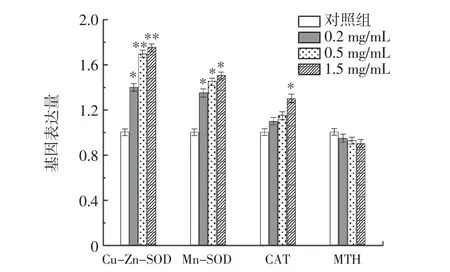
圖8 RE 對果蠅抗氧化基因表達量的影響Fig.8 Effects of RE on the expression of antioxidant genes in Drosophila melanogaster
由 表5 可 知,0.5 mg/mL RE 組Cu-Zn-SOD 和Mn-SOD 活性分別提高了14.02%和11.57%(P<0.05),1.5 mg/mL RE 組Cu-Zn-SOD 和Mn-SOD 活性分別提高了和17.71%和15.65%(P<0.05)。同樣,與對照組相比,RE 組的CAT 活性分別增加了3.22%、16.99%和29.22%。此外,0.5、1.5 mg/mL RE 組果蠅的MDA 含量分別顯著降低44.44%和50.42%(P<0.05)。如圖8 所示,RE 組的Cu-Zn-SOD(P<0.05)和Mn-SOD(P<0.05)的mRNA 表達水平高于對照組。與對照組相比,1.5 mg/mL 組的CAT 基因表達顯著增加(P<0.05)。同時,1.5 mg/mLRE組MTH 基因表達有所降低。結果表明,RE 不僅能增加與衰老相關的抗氧化酶的活性,而且能提高其mRNA的表達水平。
2.9 分子機制
RE 對雌性果蠅溶酶體熒光強度的影響及定量結果見圖9,RE 對胰島素通路和自噬基因的影響見圖10。
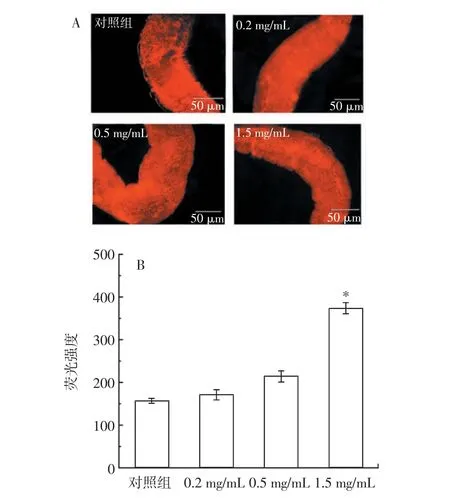
圖9 RE 對雌性果蠅溶酶體熒光強度的影響及定量結果Fig.9 Effect of RE on fluorescence intensity of lysosome and the number of lysosomes in female drosophila
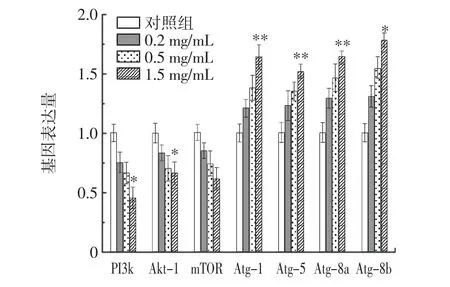
圖10 RE 對胰島素通路和自噬基因的影響Fig.10 Effects of RE on insulin pathway and autophagy gene
自噬是代謝穩態的強大啟動子,通過降解脂質過氧化、受損細胞器和病原體來維持穩態并防止退行性疾病[29]。自噬可調節腸道屏障防御、防止腸道菌群失衡,并在維持腸道穩態中發揮特定的作用[30]。為了研究RE 延長果蠅壽命的作用是否與激活自噬有關,通過溶酶體染色分析了RE 處理是否會導致自噬體和溶酶體的增加。研究發現,RE 處理之后腸道中自噬小體以劑量依賴性的方式增加(圖9)。Real-time PCR 結果顯示,1.5 mg/mL RE 處 理 后,Atg-1、Atg-5、Atg-8a 和Atg-8b 等自噬相關基因分別增加了67.21%、43.16%、53.23%(P<0.01)和45.07%(P<0.05)(圖10)。因此,以上結果表明RE 激活了自噬途徑。
在線蟲、果蠅和哺乳動物中,抑制胰島素途徑中與衰老密切相關的關鍵基因或蛋白可以有效延長壽命[31]。如圖10 所示,用1.5 mg/mL RE 處理果蠅后,PI3k、Akt-1 和mTOR 的mRNA 表達水平分別降低了16.04%、52.14%和40.07%,表明RE 可能通過胰島素信號通路調控壽命。
3 結論
添加一定劑量的RE 可以顯著延長雌性果蠅壽命,減緩因衰老導致的運動能力的下降,增強抗應激能力,減少了衰老引起的腸道屏障功能障礙和腸道菌群失衡,抑制腸道前體細胞的異常增殖,維持腸道穩態。RE 治療延長生命的可能機制是通過抑制胰島素通路和激活雷帕霉素通路因子mTOR 來激活自噬通路,改善抗氧化能力和腸道失衡。研究結果為迷迭香功能產品的后續開發和應用提供了理論基礎,但其確切機制尚不清楚,有待進一步探索。

