微波輔助提取蓮子心多糖的工藝優(yōu)化及其抗氧化活性研究
胡羅松,鄭青松,文雨欣,王和德,楊雄志,翟永貞,張霞,3,李冰,3*
(1.廣州酒家集團利口福食品有限公司,廣東 廣州 511442;2.華南理工大學食品科學與工程學院,廣東 廣州 510640;3.廣東省天然產(chǎn)物綠色加工與產(chǎn)品安全重點實驗室,廣東 廣州 510640)
從自然資源中分離提取出來的天然生物活性多糖因具有抗氧化[1]、抗炎[2]、降血糖[3]、提高機體免疫力[4]、抗菌[5]、抗病毒[6]、抗腫瘤[7]、調(diào)節(jié)腸道菌群[8]等生物活性而被人們廣泛關注,在保健食品和醫(yī)藥領域具有廣闊的應用前景。
蓮子心(Plumula nelumbinis)為睡蓮科(Nymphaeaceae)蓮屬植物蓮(Nelumbo nucifera Gaertn.)的成熟種子中間的綠色幼葉及胚根[9]。《中國藥典》收錄記載:蓮子心具有清心火、平肝火、清心安神等作用。蓮子心多糖是蓮子心中的主要化學成分之一[10],但國內(nèi)外關于蓮子心多糖的研究較少。目前關于蓮子心多糖的提取方法主要局限于熱水浸提法[11-12],新型提取方法(如超聲輔助提取、酶輔助提取和微波輔助提取等)應用較少。其中微波輔助提取法(microwave-assisted extraction,MAE)是一種短時間內(nèi)高效提取蓮子心多糖的新型輔助提取方法[13]。多糖提取過程中常常伴隨著色素類雜質(zhì)。大孔樹脂法常被用來去除多糖提取物中色素類雜質(zhì)[14]。本文首先利用響應面優(yōu)化方法對微波輔助提取蓮子心多糖的工藝進行優(yōu)化,然后利用大孔樹脂AB-8進行蓮子心多糖的脫色處理,最后對其抗氧化活性進行測定,建立一種高效提取蓮子心多糖的方法,得到一種具有較好抗氧化活性的蓮子心多糖,為開發(fā)天然的抗氧化產(chǎn)品提供了依據(jù)。
1 材料與方法
1.1 材料與儀器
干燥蓮子心:湘潭蓮子生產(chǎn)基地。利用小型中草藥粉碎機進行粉碎,得到蓮子心粉末備用;乙醇、苯酚、濃硫酸(均為分析純):國藥集團化學試劑有限公司;大孔樹脂AB-8:上海聯(lián)碩生物科技有限公司。
高速中草藥粉碎機(XL-20B型):廣州旭朗有限公司;微波萃取儀(Milestone Ethos):北京萊伯泰科儀器股份有限公司;旋轉(zhuǎn)蒸發(fā)儀(RV 10 auto FLEX):德國IKA公司;高速冷凍離心機(3-30KS):美國Sigma公司;真空冷凍干燥機(Wizard2.0):美國VirTis公司;紫外可見分光光度計(Carry 50 Conce):美國Varian公司。
1.2 試驗方法
1.2.1 蓮子心多糖的提取
取粉碎后的蓮子心粉末,以蒸餾水為提取溶劑,利用微波萃取儀提取得到蓮子心多糖提取液,離心(6 000 r/min,5 min)、抽濾(0.45 μm 水系膜),除去微小固體雜質(zhì)。減壓真空濃縮后,加入4倍體積的無水乙醇,4℃條件下,放置 12 h,6 000 r/min離心 3 min,取沉淀,冷凍干燥得到蓮子心粗多糖。
1.2.2 單因素試驗設計
1.2.2.1 微波功率對蓮子心多糖得率的影響
精確稱取1 g蓮子心粉末,加入25 mL去離子水[液料比 25 ∶1(mL/g)],分別在 300、400、500、600、700、800 W的功率下,微波輔助提取4 min,考察微波功率對蓮子心多糖得率的影響。
1.2.2.2 液料比對蓮子心多糖得率的影響
精確稱取 1g蓮子心粉末,分別加入 10、15、20、25、30mL 去離子水 [液料比分別為10∶1、15∶1、20∶1、25∶1、30 ∶1(mL/g)],在 600 W 下,微波輔助提取 4 min,考察液料比對蓮子心多糖得率的影響。
1.2.2.3 微波時間對蓮子心多糖得率的影響
精確稱取1 g蓮子心粉末,加入25 mL去離子水[液料比 25 ∶1(mL/g)],在 600 W 下,分別微波輔助提取 1、2、3、4、5、6 min,考察微波時間對蓮子心多糖得率的影響。
1.2.3 響應面優(yōu)化試驗設計
在單因素試驗結(jié)果的基礎上,選擇適合的因素水平,利用Box-Behnken試驗設計進行三因素三水平響應面優(yōu)化試驗,試驗因素和水平設計見表1。

表1 Box-Behnken試驗設計因素與水平Table 1 Box-Behnken experiment design factors and level
1.2.4 大孔樹脂脫色試驗
參考張玉等[14]的方法,利用AB-8大孔樹脂對蓮子心多糖進行脫色處理。取蓮子心多糖粉末,用蒸餾水配制成1 mg/mL蓮子心多糖溶液。設定脫色溫度40℃、脫色時間60 min、大孔樹脂添加量4 g,采用單因素試驗考察大孔樹脂添加量(2、3、4、5、6 g/20 mL)、脫色時間(20、40、60、80、100 min)、脫色溫度(30、40、50、60、70℃)對蓮子心多糖脫色率和保留率的影響。
1.2.5 多糖得率測定
利用苯酚-硫酸法對多糖含量進行測定,以葡萄糖為標準品繪制標準曲線。準確稱取1.000 g于105℃充分干燥的葡萄糖,溶于1 000 mL蒸餾水,制成1 mg/mL葡萄糖標準儲備液。繼續(xù)取1.0 mL葡萄糖儲備液稀釋至100 mL,得到100 μg/mL葡萄糖標準儲備液。精密量取 100 μg/mL 葡萄糖標準儲備液 0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL,分別置于試管中,加蒸餾水至2 mL。加入現(xiàn)配的6%苯酚溶液1 mL,搖勻,再加入95%濃硫酸5 mL,充分振蕩后于40℃保溫20 min,冷卻至25℃,利用紫外可見分光光度計在490 nm處測定吸光度。以葡萄糖濃度為橫坐標,吸光度為縱坐標繪制葡萄糖標準曲線[Y=0.025 5X-0.190 7(R2=0.998 8)],依據(jù)葡萄糖標準曲線可計算樣品多糖得率與純度,計算公式如下。
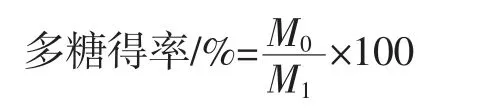
式中:M0為利用標準曲線計算得到的樣品中多糖質(zhì)量,g;M1為樣品的質(zhì)量,g。
1.2.6 抗氧化活性測定
1.2.6.1 DPPH自由基清除率的測定
參考Ma等[15]的方法并稍作修改。取脫色后的蓮子心多糖,溶于蒸餾水,配制0.2 mg/mL~2.0 mg/mL的多糖溶液,用乙醇配制60 μmol/L DPPH溶液,各取150 μL多糖樣品和DPPH溶液,加到96孔板,混合均勻后,暗處反應30 min,517 nm處測定吸光度。以蒸餾水代替樣品做空白對照,乙醇代替DPPH作本底對照,抗壞血酸(VC)作陽性對照。DPPH自由基清除率計算公式如下。
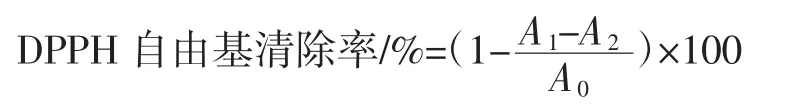
式中:A1為樣品吸光度;A2為本底對照吸光度;A0為空白對照吸光度。
1.2.6.2 ABTS+自由基清除率的測定
參考Chen等[16]的方法,配制7 mmol/LABTS溶液和2.45 mmol/L過硫酸鉀溶液,將二者等體積混合,置于暗處反應12 h。然后用無水乙醇稀釋,直至混合溶液在734 nm處吸光度在0.70±0.05,得到ABTS工作液。取20 μL脫色后蓮子心多糖溶液(0.2 mg/mL~2.0 mg/mL)與180 μL ABTS工作液混合,25℃振動孵化5 min,734 nm處測定吸光度。以蒸餾水代替樣品做空白對照,乙醇代替ABTS作本底對照,VC作陽性對照。ABTS+自由基清除率計算公式如下。
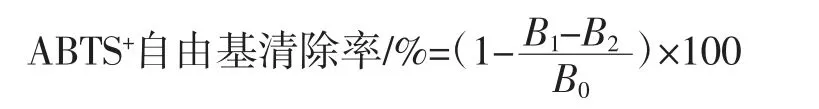
式中:B1為樣品吸光度;B2為本底對照吸光度;B0為空白對照吸光度。
1.2.6.3 超氧陰離子自由基清除率的測定
參考Liang等[17]的方法,配制0.1 mol/L的Tris-HCl緩沖溶液(pH8.2),6 mmol/L的鄰苯三酚溶液。取30 μL脫色后的蓮子心多糖溶液(0.2 mg/mL~2.0 mg/mL),加入150 μL緩沖溶液,25℃反應10 min,VC作為陽性對照。之后加入30 μL配制好的鄰苯三酚溶液,325 nm處測定吸光度(30 s測定一次,持續(xù)5 min)。超氧陰離子自由基清除率計算公式如下。
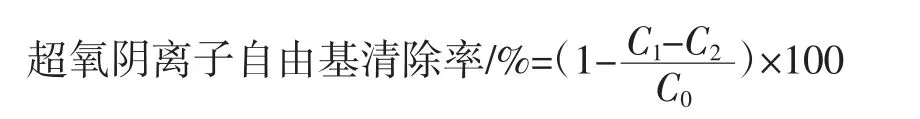
式中:C0為鄰苯三酚自氧化后的吸光度;C1為加入樣品后的吸光度。
1.2.7 數(shù)據(jù)處理
以上所有試驗至少重復3次,試驗結(jié)果采用平均值±標準差表示。所有數(shù)據(jù)均采用IBM SPSS 22.0進行統(tǒng)計分析,不同組數(shù)據(jù)采用單因素方差分析,并使用Origin 9.0軟件進行繪圖。顯著性水平為p<0.05。
2 結(jié)果與分析
2.1 多糖提取單因素試驗結(jié)果
2.1.1 微波功率對蓮子心多糖得率的影響
設定液料比為 25∶1(mL/g)、微波時間為 4 min,在300 W~800 W內(nèi),考察微波功率對蓮子心多糖得率的影響,結(jié)果如圖1所示。
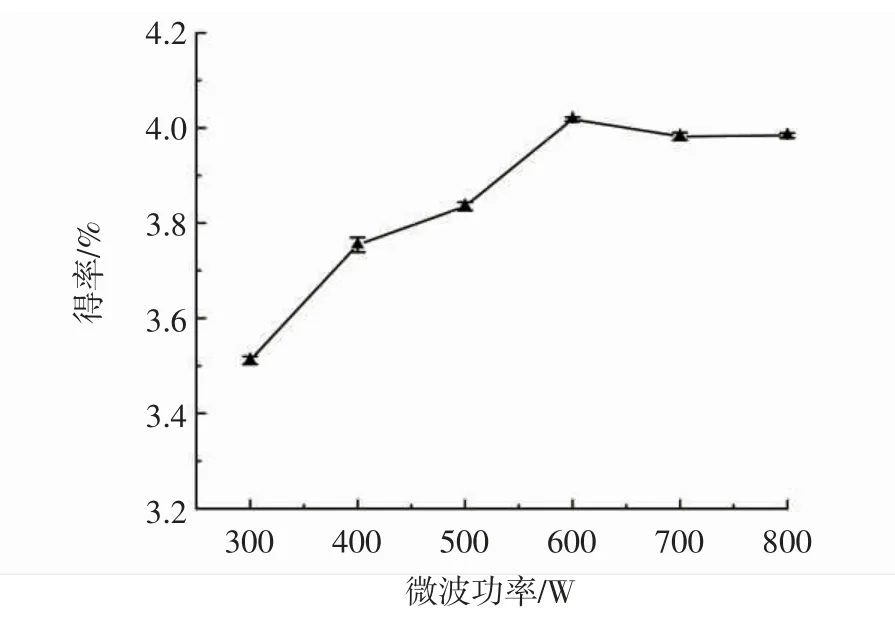
圖1 微波功率對多糖得率的影響Fig.1 The influence of microwave power on the yield of polysaccharide
如圖1所示,隨著微波功率的增加,蓮子心多糖得率逐漸上升,到600 W時得率最高,之后繼續(xù)增加微波功率,蓮子心多糖得率變化趨勢平穩(wěn)。提高微波功率,有利于促進多糖的滲出及擴散,但是微波功率達到一定時,多糖的滲出與擴散達到平衡,這時即使繼續(xù)增加微波功率也難以促進多糖的提取。所以,微波輔助提取蓮子心多糖的功率選擇600 W較為適宜。
2.1.2 液料比對蓮子心多糖得率的影響
設定微波功率為600 W、微波時間為4 min、在液料比 10∶1(mL/g)~30 ∶1(mL/g)內(nèi),考察液料比對蓮子心多糖得率的影響,結(jié)果見圖2。
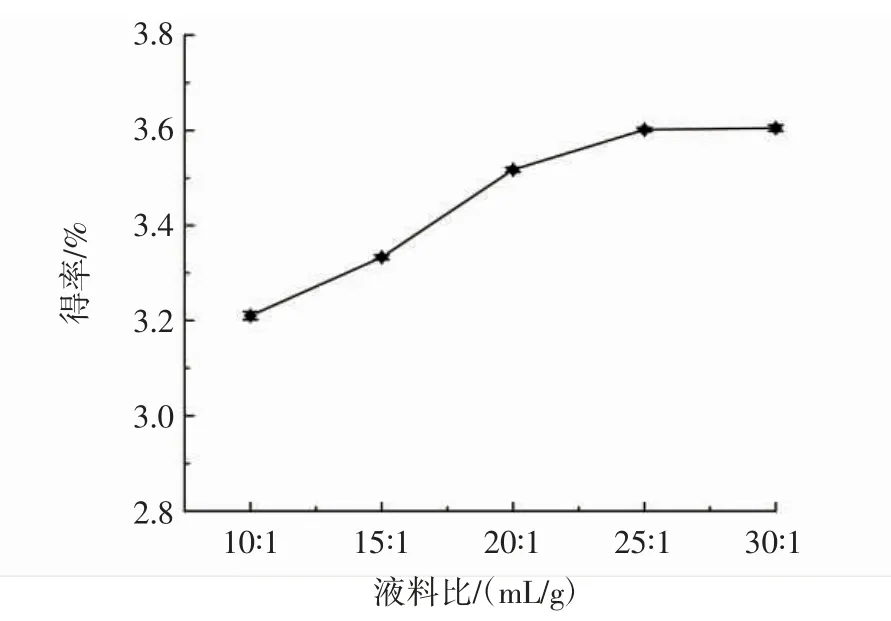
圖2 液料比對多糖得率的影響Fig.2 The influence of liquid-to-material ratio on the yield of polysaccharide
如圖2所示,隨著溶劑體積不斷增大,蓮子心多糖得率呈逐步上升的趨勢,在液料比大于25∶1(mL/g)時,多糖得率的變化趨勢趨于平緩。溶劑體積增加,有利于增加多糖濃度差,可促進多糖的擴散。但是,當多糖的擴散達到平衡時,再增加溶劑體積作用也不大,反而會增加后續(xù)濃縮工藝的壓力。因此,蓮子心多糖的液料比選擇25∶1(mL/g)較合適。
2.1.3 微波時間對蓮子心多糖得率的影響
設定微波功率為600 W、液料比為25∶1(mL/g)、在微波時間1 min~6 min內(nèi)考察微波時間對蓮子心多糖得率的影響,結(jié)果見圖3。

圖3 微波時間對多糖得率的影響Fig.3 The influence of microwave time on the yield of polysaccharide
如圖3所示,隨著微波時間的延長,蓮子心多糖得率上升趨勢明顯,在4 min時達到最大值,在4 min~6 min多糖得率基本不變。因此,考慮減少能量損耗和高效提取的目的,提取蓮子心多糖的微波時間在4 min左右較為合適。
2.2 響應面試驗結(jié)果與分析
2.2.1 響應面試驗結(jié)果
根據(jù)單因素試驗結(jié)果,利用Box-Behnken試驗設計進行三因素三水平響應面優(yōu)化,表2為試驗設計及結(jié)果。
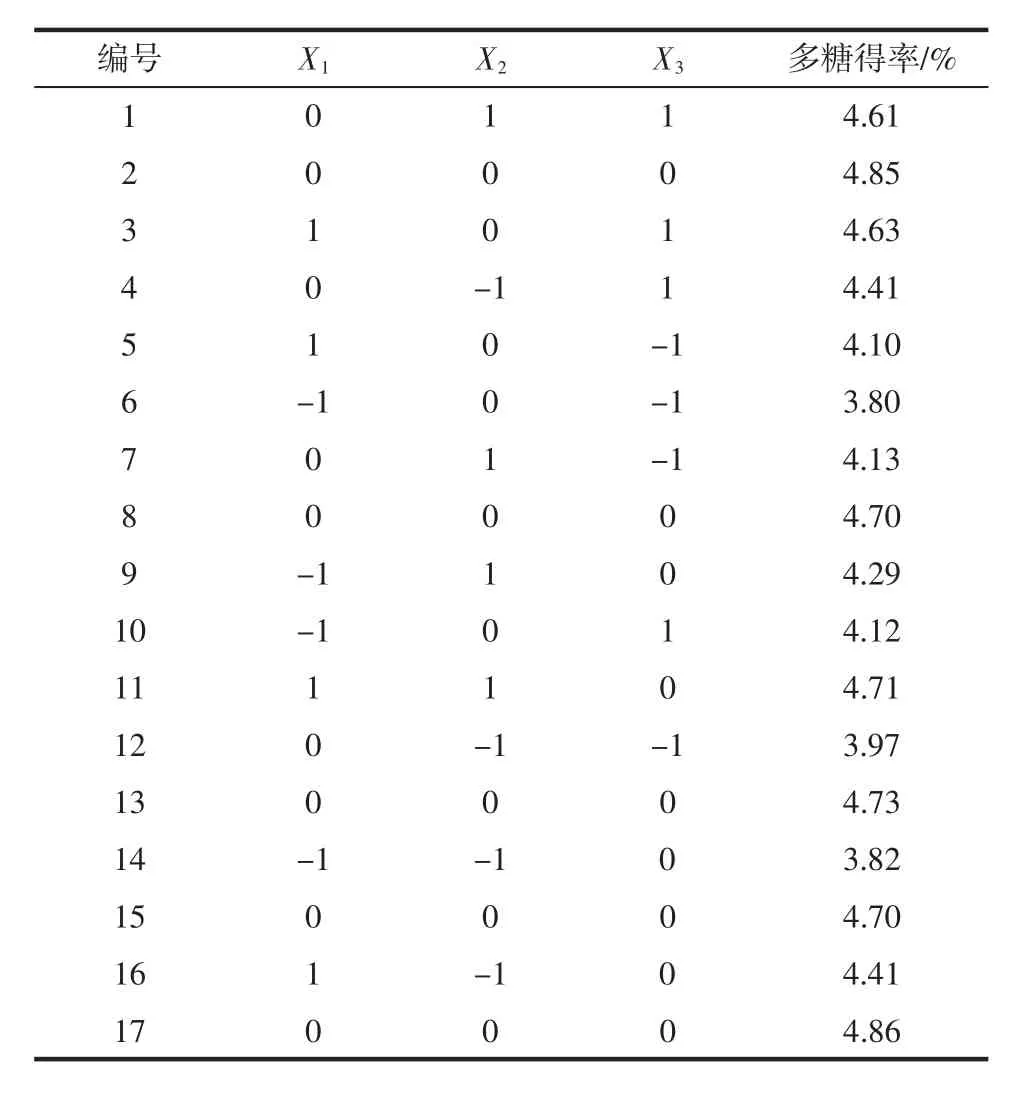
表2 Box-Behnken試驗設計及結(jié)果Table 2 Box-Behnken experiment design and results
通過多項式回歸分析得到一個二次多項式,可用來預測微波輔助提取蓮子心多糖的得率,回歸方程為Y=4.77+0.23X1+0.14X2+0.22X3-0.044X1X2+0.053X1X3-0.009 5X2X3-0.29X12-0.17X22-0.32X32。
方差分析和多元回歸分析如表3所示。
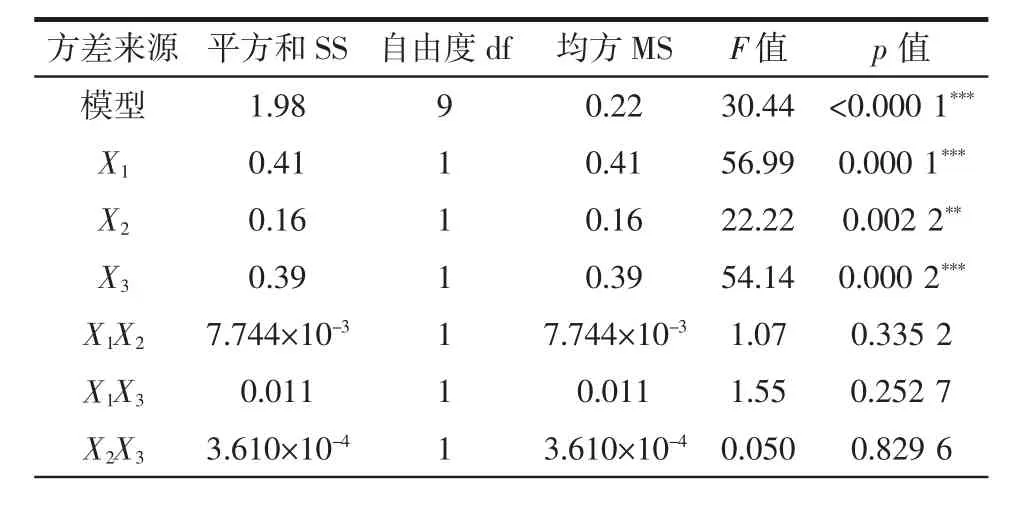
表3 回歸模型的方差分析Table 3 Analysis of variance table for regression model
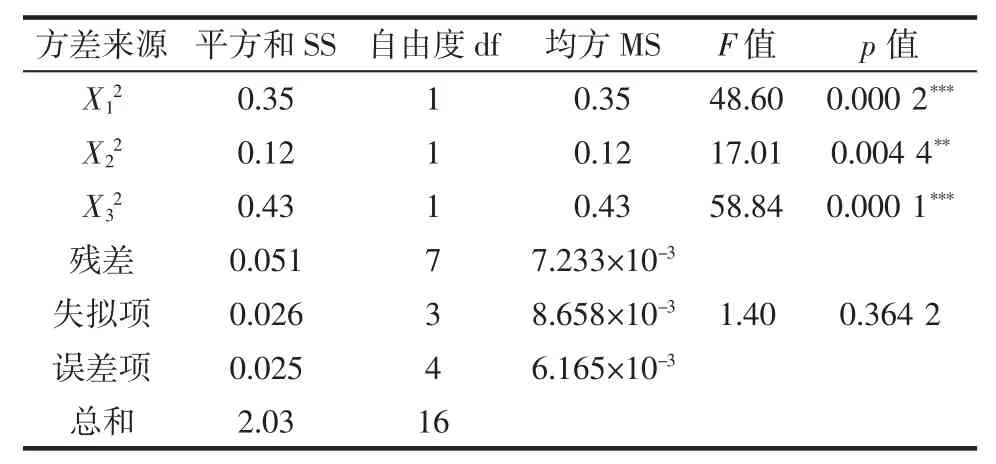
續(xù)表3 回歸模型的方差分析Continue table 3 Analysis of variance table for regression model
由表3可知,模型的F值為30.44,p值小于0.001,說明模型建立具有顯著性,并且模型的失擬項p>0.05,不顯著,說明可以通過該模型來預測微波輔助提取蓮子心多糖的最優(yōu)提取條件。在回歸模型中,X1、X3、X12、X32對蓮子心多糖得率的影響高度顯著,X2、X22對蓮子心多糖得率影響極顯著,而X1X2、X1X3、X2X3影響不顯著,說明3種因素本身均對蓮子心多糖得率有較大影響,但3種因素間的交互作用并不顯著。
2.2.2 響應面分析
響應面和等高線圖見圖4。

圖4 微波功率、液料比和微波時間對蓮子心多糖得率影響的響應面和等高線圖Fig.4 Response surfaces plots and contour plots showing the effects of microwave power,liquid-solid ration,extraction time,on the Plumula nelumbinis polysaccharide yield
由圖4可知,液料比和微波時間均對得率有較大影響,在28∶1(mL/g)和4.5 min附近時有最大得率,等高線圖呈現(xiàn)不明顯的橢圓狀,結(jié)合方差分析結(jié)果,二者之間相互作用并不顯著。在微波功率為680 W、微波時間為4.5 min時有最大得率,等高線圖為圓形,結(jié)合方差分析結(jié)果可知微波功率和微波時間相互作用不顯著。在液料比28∶1(mL/g),微波功率680 W時有最大的多糖得率,但二者的等高線圖呈圓形,說明料液比和微波功率相互作用不顯著。
2.2.3 響應面試驗模型的驗證
模型中最優(yōu)工藝條件為微波時間4.517 min、微波功率 680.73 W、液料比 28.48∶1(mL/g),在此條件下多糖得率為4.81%。考慮實際操作情況,將此工藝條件修正為微波時間4.5 min、微波功率680 W、液料比28∶1(mL/g),修正后的多糖得率為(4.84±0.11)%,與預測值4.81%的相對誤差為0.62%,驗證結(jié)果表明模型建立成功,并且此提取工藝合理可靠。
2.3 大孔樹脂脫色試驗
2.3.1 大孔樹脂添加量對蓮子心多糖脫色率和保留率的影響
大孔樹脂添加量對蓮子心多糖脫色率和保留率的影響見圖5。
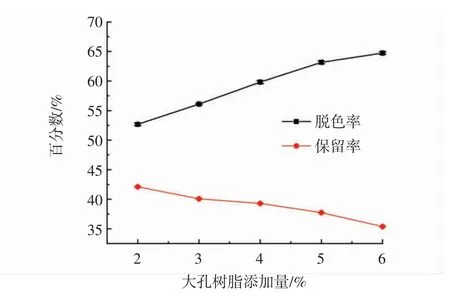
圖5 大孔樹脂添加量對蓮子心多糖脫色率和保留率的影響Fig.5 The effect of macroporous resin addition on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如圖5所示,隨著大孔樹脂添加量的增加,吸附色素能力增強,蓮子心多糖的脫色率逐漸增加,但同時多糖的保留率逐漸降低。因此,綜合考慮多糖脫色率和保留率,選取大孔樹脂添加量為4 g。
2.3.2 脫色時間對蓮子心多糖脫色率和保留率的影響
設定脫色溫度為40℃、大孔樹脂添加量為4 g,在脫色時間20 min~100 min內(nèi),考察脫色時間對脫色率和多糖保留率的影響,結(jié)果見圖6。

圖6 脫色時間對蓮子心多糖脫色率和保留率的影響Fig.6 The effect of decolorization time on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如圖6所示,蓮子心多糖的脫色率隨著脫色時間的延長逐漸增加,同時多糖保留率也隨著脫色時間的延長而降低,因此,為保證蓮子心多糖一定的脫色率和保留率,選定脫色時間為60 min。
2.3.3 脫色溫度對蓮子心多糖脫色率和保留率的影響
設定脫色時間為60 min、大孔樹脂添加量為4 g,在脫色溫度30℃~70℃內(nèi),考察脫色溫度對蓮子心多糖脫色率和保留率的影響,結(jié)果見圖7。

圖7 脫色溫度對蓮子心多糖脫色率和保留率的影響Fig.7 The effect of decolorization temperature on the decolorization rate and retention rate of Plumula nelumbinis polysaccharide yield
如圖7所示,隨著脫色溫度的升高,蓮子心多糖的脫色率平緩上升,同時多糖保留率也隨著溫度的升高逐漸降低。因此,為保證蓮子心多糖一定的脫色率和保留率,脫色溫度選取50℃。
經(jīng)過單因素試驗后,確定適宜的蓮子心多糖大孔樹脂AB-8脫色工藝條件為20 mL,1 mg/mL的蓮子心多糖大孔樹脂添加量4 g、脫色時間60 min和脫色溫度50℃。脫色率達到(65.12±0.88)%,多糖損失率為(30.33±0.58)%。
2.4 蓮子心多糖的抗氧化活性測定結(jié)果
2.4.1 DPPH自由基清除能力
蓮子心多糖的DPPH自由基清除能力結(jié)果見圖8。
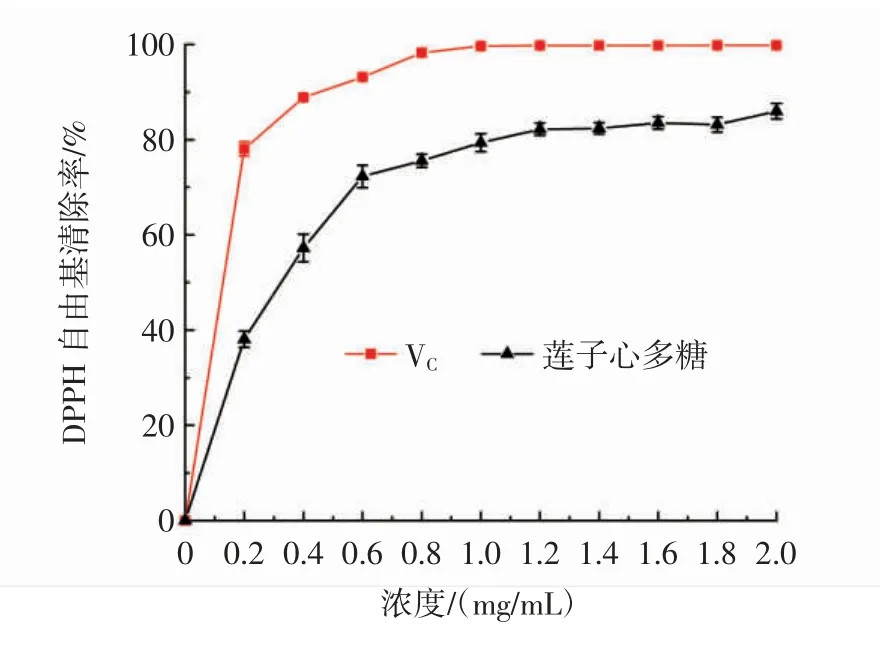
圖8 蓮子心多糖的DPPH自由基清除率Fig.8 DPPH radical scavenging ability of Plumula nelumbinis polysaccharide
如圖8所示,在0.2 mg/mL~2.0 mg/mL內(nèi),隨著濃度的增加,蓮子心多糖清除DPPH自由基的能力不斷增大。在濃度為2.0 mg/mL時,蓮子心多糖的DPPH自由基清除率達到最大值(86.01±1.63)%,可見,蓮子心多糖具有良好的DPPH自由基清除能力。此結(jié)果高于Khan等[18]從Porphyra haitanensis提取的多糖濃度為2 mg/mL時對DPPH自由基的清除率(34.63%)。
2.4.2 ABTS+自由基清除能力
蓮子心多糖的ABTS+自由基清除能力見圖9。
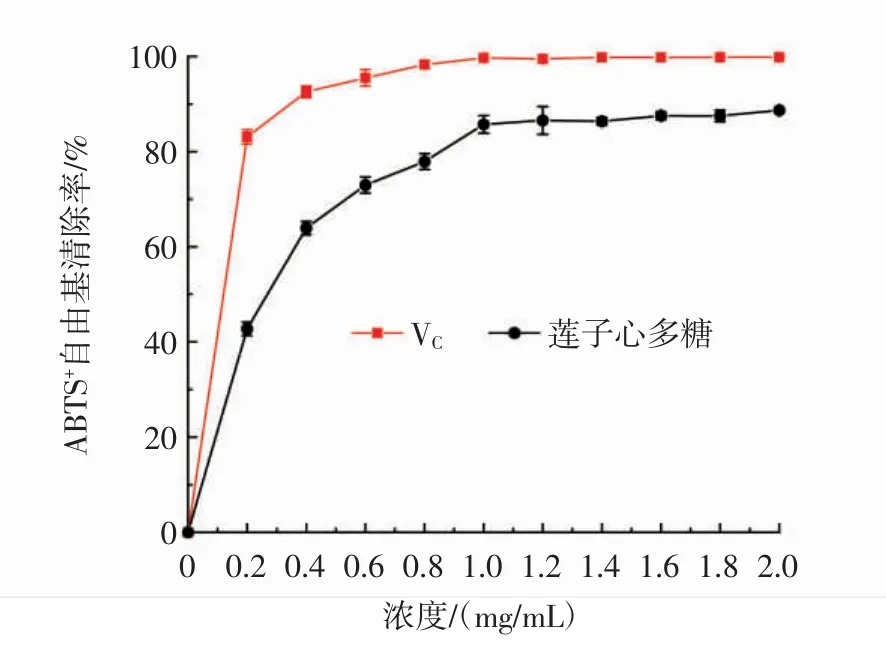
圖9 蓮子心多糖的ABTS+自由基清除率Fig.9 ABTS+radical scavenging ability of Plumula nelumbinis polysaccharide
如圖9所示,在0.2 mg/mL~2.0 mg/mL內(nèi),蓮子心多糖表現(xiàn)出良好的ABTS+自由基清除能力,并隨著樣品濃度的增加呈上升趨勢。蓮子心多糖的IC50值為0.23 mg/mL,在樣品濃度為2.0 mg/mL時,蓮子心多糖的 ABTS+清除率達到(88.67±0.47)%,高于部分其他來源的多糖,如Gu等[19]從Sagittaria sagittifolia L.中提取的多糖(濃度為5.0 mg/mL時,對ABTS+自由基清除率為91.19%)。
2.4.3 超氧陰離子自由基清除能力
蓮子心多糖的超氧陰離子自由基清除能力見圖10。
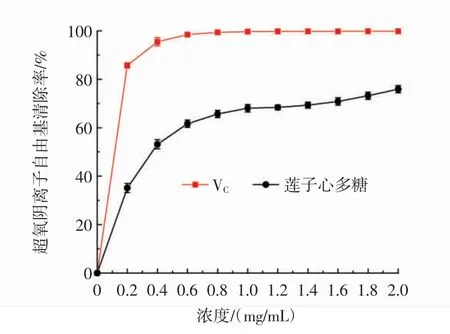
圖10 蓮子心多糖的超氧陰離子自由基清除能力Fig.10 Superoxide radical scavenging ability of Plumula nelumbinis polysaccharide
如圖10所示,在0.2 mg/mL~2.0 mg/mL內(nèi),隨著濃度的增大蓮子心多糖的超氧陰離子自由基清除率升高,其IC50值為0.28 mg/mL。在樣品濃度為2.0 mg/mL時,蓮子心多糖的超氧陰離子自由基清除率達到最高值為(75.92±1.51)%。以上結(jié)果說明蓮子心多糖的具有較好的超氧陰離子自由基清除能力,并且清除能力高于Chen等[20]從Bletilla striata須根中提取得到的多糖(濃度為5.0 mg/mL時,對超氧陰離子自由基清除率為72.27%)。
3 結(jié)論
經(jīng)過響應面優(yōu)化后,微波輔助提取蓮子心多糖的最佳工藝為微波時間4.5 min、微波功率680 W、液料比28∶1(mL/g),此時的多糖得率為(4.84±0.11)%。單因素優(yōu)化后的大孔樹脂脫色工藝為大孔樹脂添加量4 g、脫色時間60 min、脫色溫度50℃。所得蓮子心多糖對DPPH自由基、ABTS+自由基和超氧陰離子自由基清除率的IC50值分別為0.28、0.23 mg/mL和0.28 mg/mL。在樣品濃度為2.0 mg/mL時,蓮子心多糖的DPPH自由基清除率達(86.01±1.63)%,ABTS+自由基清除率達(88.67±0.47)%,超氧陰離子自由基清除率達(75.92±1.51)%,說明蓮子心多糖具有良好的DPPH自由基、ABTS+自由基和超氧陰離子自由基清除能力。本研究結(jié)果提供了一種高效提取蓮子心多糖的方法并為蓮子心多糖作為功能性原料用于食品提供了理論數(shù)據(jù)和技術(shù)支持。

