基于核心素養的高三化學深度復習課例研析
——以“離子反應”為例
鄭文昌 曹 星
一、背景分析
傳統的高三化學第一、二輪復習通常缺少基于學情、以提升學科核心素養為目標的、對知識進行整合的深度復習。學生的復習僅停留在對知識的簡單回顧,這種淺層次的復習會形成碎片化的知識、膚淺的理解和僵化的思維。而基于核心素養的深度復習是以化學核心素養為復習目標,挖掘課程內容中知識間的邏輯關系,找出這些知識內容在培育學科素養中所蘊含的功能價值,將這些內容優化重組形成復習專題或主題,以真實的情境為載體,以化學知識為解決問題的工具,以提出的實際問題為任務,引導學生主動參與,融入即時性評價,在解決問題的過程中深化對知識的理解,提升核心素養,其教學流程如圖1 所示。

圖1 基于核心素養的高三化學深度復習流程圖
科學教育的主要目的是培養和發展學生的認識素養。當一個學生具備良好的化學認識素養,他就能從客觀世界(復雜的社會現象和生活問題)抽取認識閥,對化學問題進行多角度分析,形成認識思路,養成學科能力。
“離子反應”是從微觀視角認識化學反應本質的重要核心概念,是培養學生“宏觀辨識與微觀探析”“變化觀念與平衡思想”的重要的知識內容。經過前期的學習與復習,學生基本掌握了“離子反應”相關知識,如電解質、非電解質等概念的辨析,離子方程式的書寫,離子共存等問題,對于平衡(電離平衡、水解平衡、沉淀溶解平衡)問題也比較熟悉。然而在復習過程中發現,學生在解決實際化學反應問題時不能主動從“平衡觀”“微粒觀”“變化觀”的視角來分析化學問題,不能基于新的問題情境定性和定量地分析化學反應的動態變化,存在化學認識素養的欠缺。“宏觀辨識與微觀探析”“變化觀念與平衡思想”是化學學科認識世界的重要視角,對“離子反應”的深度復習,有利于提升學生的認識素養。
二、復習目標的制定
(一)復習目標制定依據
1.基于“離子反應”課程內容特點分析。從“離子反應”課程內容(見表1)來看,主要涉及平衡(電離平衡、水解平衡、沉淀溶解平衡)問題,其中蘊含著平衡觀、微粒觀、變化觀、量變引起質變等學科觀念,對該知識內容的深度復習可使離子反應核心觀念結構化(見圖2),有利于培養學生“宏觀辨識與微觀探析”“變化觀念與平衡思想”核心素養,提升認識素養。
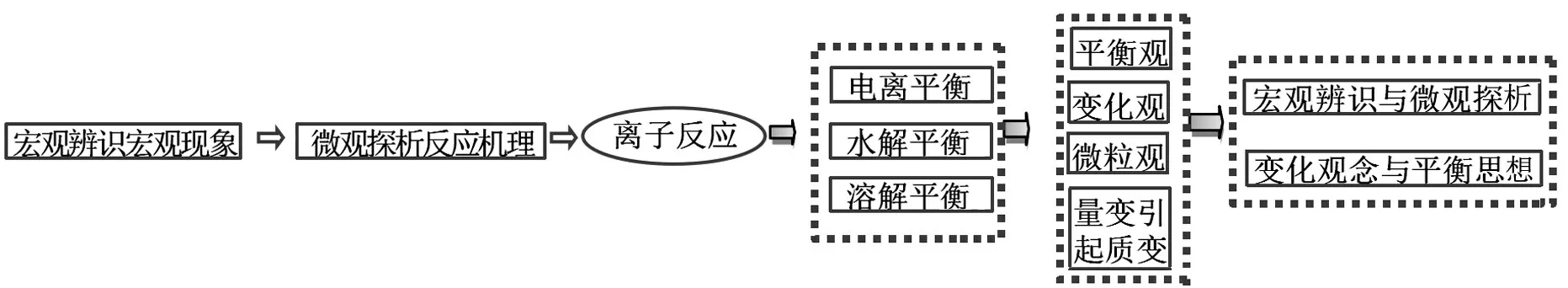
圖2 離子反應核心觀念結構圖
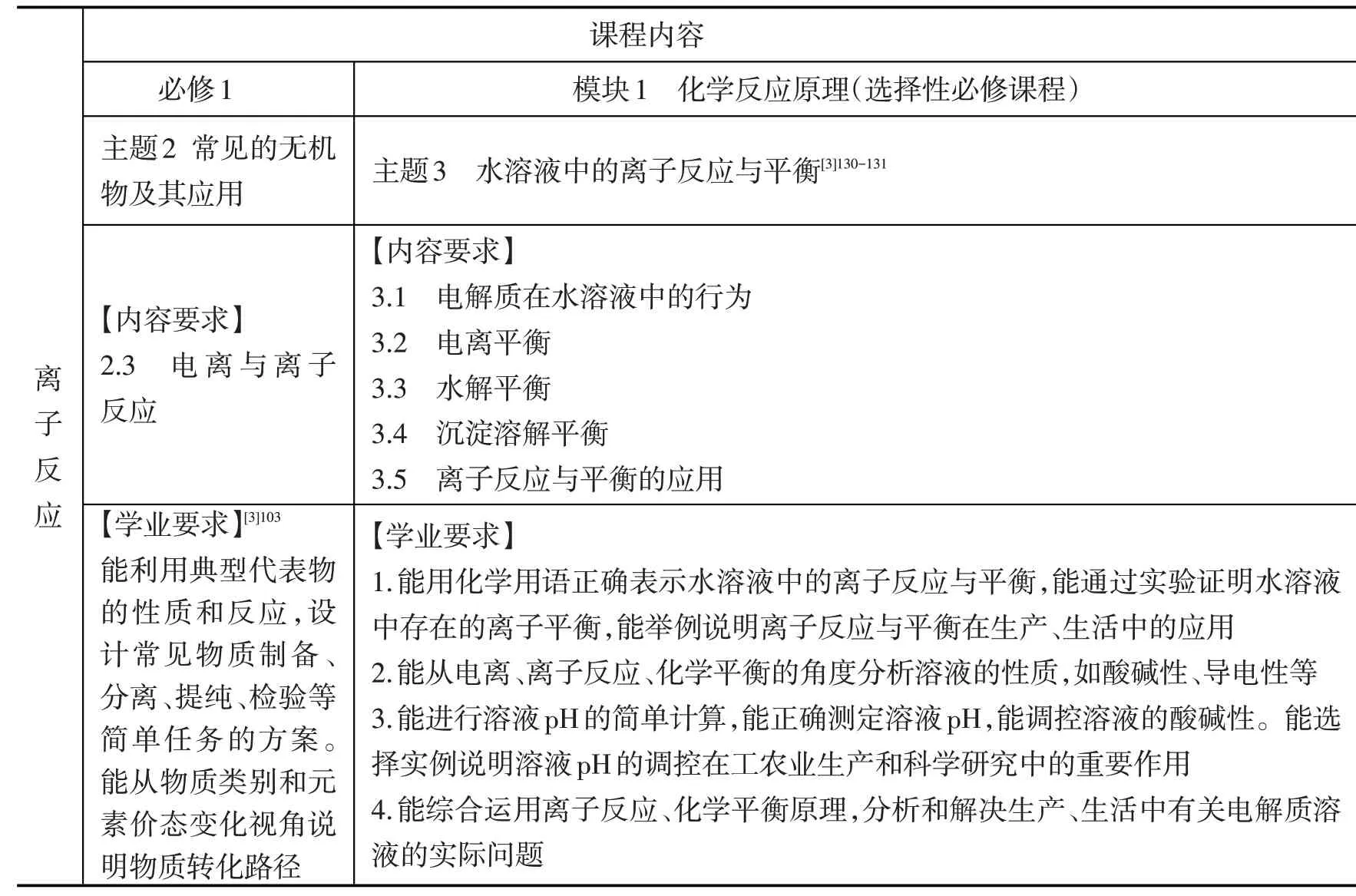
表1 《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課標》)“離子反應”課程內容及學業要求
2.基于“離子反應”與素養水平關聯分析。根據《課標》(2017年版)附錄1 對化學學科核心素養水平的劃分,對“離子反應”與素養水平的關聯進行了整理(見表2)。學業質量水平2是高中畢業生在本學科應該達到的合格要求,是化學學業水平合格性考試的命題依據,學業質量水平4 則是化學學業水平等級性考試的命題依據,本課復習目標的確定主要是以化學學業水平4 為依據。
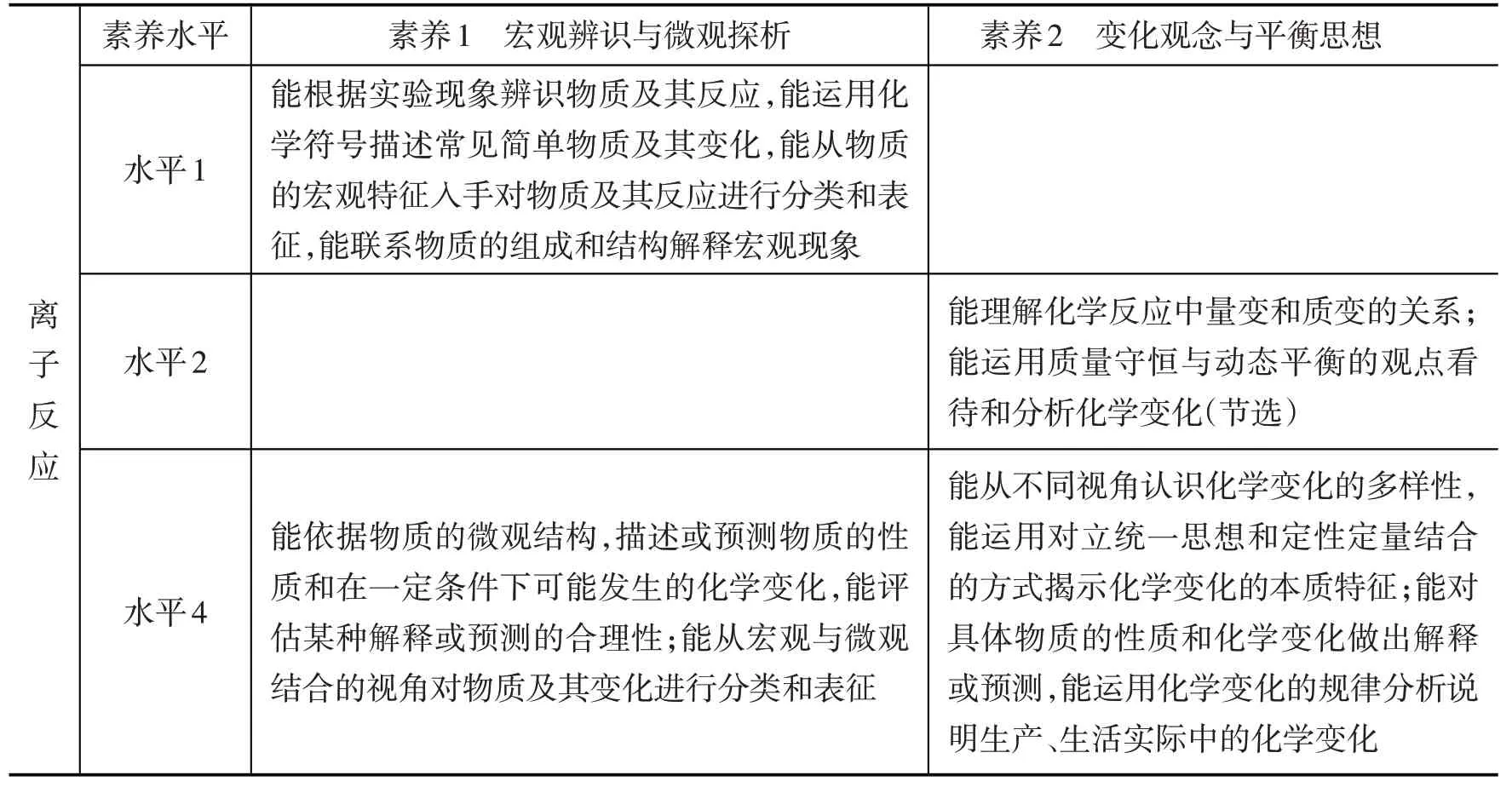
表2 “離子反應”與素養水平的關聯
3.基于學情進行分析。經過前期的復習,學生對離子反應及平衡知識比較熟悉,對“離子共存”“離子方程式的書寫”及利用平衡知識解決簡單的常規問題比較熟練,但是學生在解決化學實際反應問題時不能主動從“平衡觀”“微粒觀”“變化觀”的視角來分析,不能從不同視角認識化學變化的多樣性,不能運用對立統一思想和定性定量結合的方式來分析生產、生活實際中的化學變化。
(二)復習目標
1.通過典型的“離子共存”問題的討論,診斷學生“離子反應”知識關聯的程度,完善知識關聯,使“離子反應”知識的關聯結構化。
2.通過綜合運用離子反應,從動態平衡、微粒、定性與定量等視角分析和解決生產、生活中有關電解質溶液的實際問題,建立“離子反應”結構化的認識思路,拓展認識視角。
3.通過檢測練習的討論,診斷和評價應用“離子反應”結構化認識思路來解決問題的情況,運用對立統一思想和定性定量相結合方式來分析實際化學反應問題,提升學生認識素養。
三、教學過程
(一)在解決典型習題的過程中促進“離子反應”知識關聯結構化
設置任務情境1,通過任務1 的討論,讓學生自我發現知識儲備的不足,主動完善知識結構,使“離子反應”知識關聯結構化。
【任務情境1】下列離子組在溶液中都不能·大量共存,請同學們分析每組離子發生了哪類反應導致離子不能共存。
A.Fe、SCN、I、KB.K、Al、SO、MnO
C.H、NO、Fe、NaD.Cu、NH、Br、OH
【學生活動】分析每一選項中離子不能大量共存的原因,小結“離子反應”涉及的反應類型。
【教師活動】針對學生回答中存在的問題,用追問的方式引導學生發現自己儲備知識的不足。
【學生活動】構建“離子反應”涉及的反應類型及常見的氧化劑、還原劑、弱電解質、難溶物、配合物等知識。
【教師活動】以追問的方式引導學生思考:為什么題目中強調“大量”?H與OH會反應生成弱電解質水,為什么水溶液中H與OH會“共存”?讓學生深刻體會:“離子反應”的本質是離子的種類或數目發生了改變,它涉及到平衡移動等理論知識。
【學生活動】構建“離子反應”知識關聯結構模型,如圖3 所示。
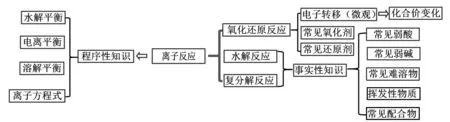
圖3 離子反應知識關聯結構模型
【教師評價】對學生構建的知識關聯模型給予點評、完善。
(二)在真實情境中設計問題鏈,在解決問題中促進認識思路結構化、核心觀念結構化
抓住“強制弱”“弱制強”的典型案例,設置梯度任務情境3、4、5,并根據任務情境設計層層深入的問題鏈作為學習任務,引導學生從定性與定量兩個方面來分析離子反應,讓學生從變化觀、平衡觀、量變引起質變的視角來認識離子反應,構建離子反應的認知思路。
【任務情境2】在試管1 和試管2 中分別加入2 mL 蒸餾水,在試管1 中加入少量粉末后試管中出現渾濁。
【學習任務1】試管1 中有Ca嗎?請設計實驗來驗證,并用沉淀溶解平衡的方程式來解釋原因。
【學生活動】預測試管1 是否有Ca,設計實驗驗證,書寫沉淀溶解平衡的方程式。

【任務情境3】在上述的試管1 中滴加鹽酸,渾濁變澄清。
【學習任務2】請同學們從沉淀平衡移動的視角定性分析加入鹽酸后CaCO濁液變澄清的原因。
【學生活動】宏觀現象微觀探析:從平衡移動的視角分析CaCO溶于鹽酸的離子反應。
【教師評價】學生是否有宏觀辨識與微觀探析的自覺性,與學生一起構建碳酸鈣溶于鹽酸的微觀探析模型,如圖4 所示。
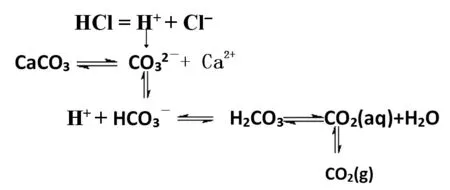
圖4 碳酸鈣溶于鹽酸定性微觀探析模型
【學習任務3】請大家從與角度定性分析碳酸鈣溶解的原因。
【學生活動】定性討論加入鹽酸前后與的大小,確定碳酸鈣沉淀溶解平衡移動的方向。
【教師活動】加入鹽酸之前,=(Ca)×(CO)=,加入鹽酸后,>,平衡向溶解的方向移動。
【學習任務4】已知:(CaCO)=2.8×10,HCO的=4.4×10、=4.7×10。請大家從平衡常數的角度定量分析碳酸鈣溶解的原因。
【學生活動】思考、計算、討論。
【教師活動】如果不考慮碳酸分解,可根據下面反應來計算平常數:
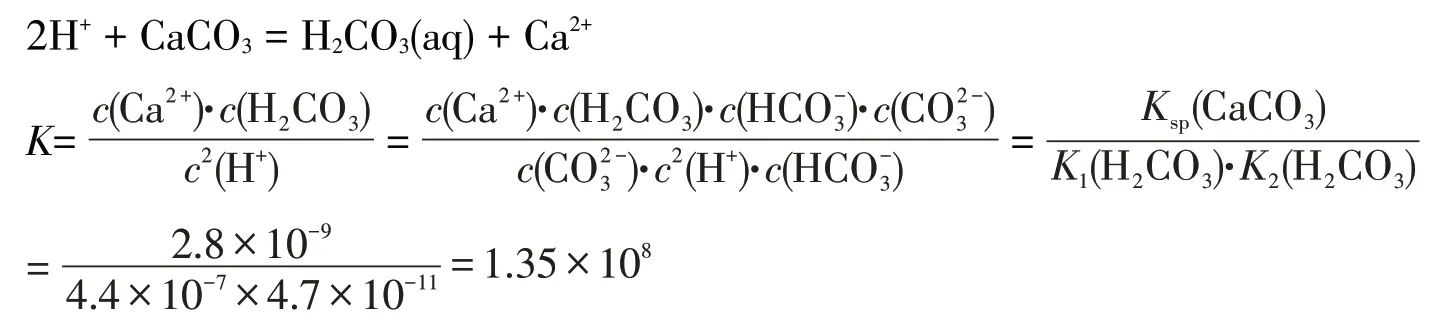
可見,在碳酸鈣濁液中加入鹽酸,生成了碳酸,此時平衡常數已經很大;若碳酸分解,反應生成二氧化碳和水,平衡常數會更大,所以碳酸鈣可以溶解在鹽酸中。
【學習任務5】碳酸鈣可溶于強酸鹽酸中,是否也能溶于醋酸等其他弱酸中?我們可以從哪些視角進行分析?
【學生活動】思考、討論。
【教師活動】我們可以從與、平衡常數的視角定性和定量分析平衡移動的可能性,從而判斷碳酸鈣是否可溶解于其他弱酸中。當然,反應可能受到酸的濃度等其他條件的影響,有興趣的同學可在課后進行討論。
【教師活動】上面我們討論的鹽酸與碳酸鈣反應生成碳酸、碳酸不穩定分解生成二氧化碳和水,其反應都屬于“強制弱”中強酸制弱酸的范疇。那么,弱酸能否制強酸呢?溶解度小的物質能否轉變成溶解度大的物質呢?
【任務情境4】演示實驗:把硫化氫氣體通入硫酸銅溶液中,有黑色固體生成。
【學習任務6】觀察實驗現象,分析反應產物,寫出反應的化學方程式和離子方程式。
【學生活動】觀察、思考,書寫反應化學方程式和離子方程式。
【教師評價】評價學生書寫的化學方程式和離子方程式,追問:硫化氫為弱酸,為什么可以用它制備強酸硫酸呢?
【學習任務7】請同學們從離子反應及平衡移動的視角定性分析HS 制備HSO的可能性。
【學生活動】思考、討論。
【教師評價】從反應Cu+HS=CuS↓+2H可知,銅離子促進了HS 在水溶液中的電離,通過圖5 的微觀分析模型體會銅離子促進HS 可能電離徹底的微觀過程。
【教師追問】從CuSO+ HS = CuS↓+ HSO可知,CuS 不溶于強酸硫酸中。圖5 從定性的視角分析反應的可能性說服力不夠,同學們能否從化學平衡常數的視角定量分析反應的可能性呢?
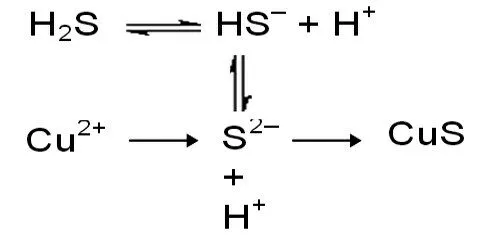
圖5 硫酸銅與硫化氫反應的微觀分析模型
【信息提示】298K 時,(CuS)=1.27×10,HS 的=9.1×10,=1.1×10。
【學生活動】思考、討論、計算。
【教師評價】根據Cu+HS=CuS↓+2H,可以計算其平衡常數如下:

平衡常數=7.88×10,很大,所以硫酸銅溶液與硫化氫氣體反應可以制得硫酸。
【學習任務8】HS 通入CuSO溶液中可制得硫酸,那么,HS 通入FeSO溶液中能否制硫酸呢?SO通入BaCl溶液中能否制鹽酸?我們可以從哪些視角進行分析和思考?
【學生活動】思考、交流討論、分享討論結果。
【教師評價】我們可從平衡移動、平衡常數的視角分析反應的可能性,再進行實驗驗證。
【學習任務9】CuS 不溶于強酸硫酸中,請分析其溶解于強酸硝酸的可能性,并設計實驗驗證。
【學生活動】思考、交流討論,實驗驗證。
【教師評價】同學們討論很深入,說明你們逐漸學會了從微觀及平衡移動的視角來分析離子反應。在CuS 中加入硝酸,硝酸把硫離子氧化成硫單質,促進平衡向溶解的方向移動,其微觀探析模型如圖6 所示。
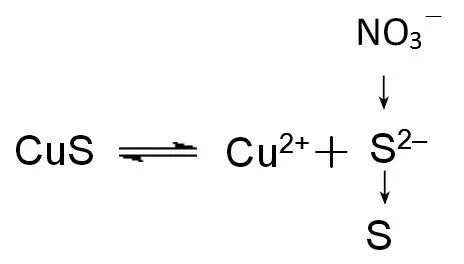
圖6 CuS溶于硝酸微觀探析模型
【任務情境5】重晶石(主要成分是BaSO)是制備鋇鹽的重要原料,但是BaSO不溶于酸,可用飽和NaCO溶液將其轉化為可溶于酸的BaCO。在298K 時,(BaSO)=1.07×10,(BaCO)=2.58×10。
【學習任務10】請用離子方程式來表征沉淀轉化的過程,分析(BaSO) = 1.07 × 10<(BaCO)=2.58×10,為什么BaSO可以轉為BaCO的原因。
【學生活動1】書寫離子方程式,定性分析生成BaCO沉淀的原因。
【學生活動2】計算比較BaCO的與的關系,定量分析BaSO轉化成BaCO的原因。
【教師評價】從圖7 可知,雖然BaSO的濁液中Ba濃度很小(通過計算可知),但是加入的飽和碳酸鈉溶液中CO濃度較大,可能會導致BaCO的>,所以會有BaCO沉淀的生成,促進BaSO的溶解。
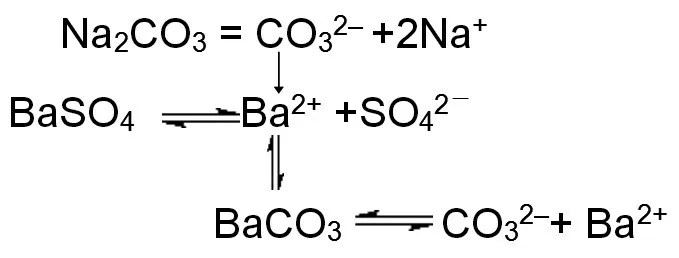
圖7 BaSO4轉化成BaCO3微觀探析模型
【教師追問】為什么碳酸鈉溶液要用飽和的?如果用稀的碳酸鈉溶液行不行,其中隱含著什么樣的辯證關系?
【師生小結提升】離子反應是從微觀的視角表征化學反應,更容易反映化學反應的本質。離子反應在水溶液中進行,往往存在動態平衡,我們應從變化觀、平衡觀的視角來分析離子反應,可以構建如圖8 所示的認知模型。
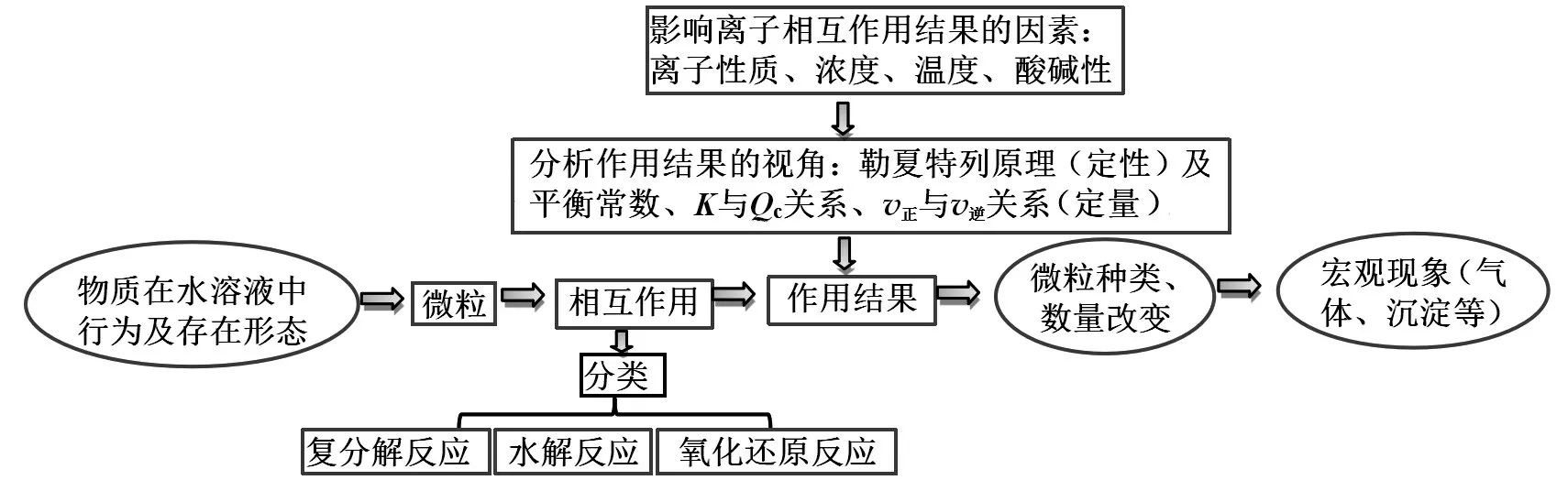
圖8 離子反應認識思路結構化模型
(三)設計課堂教學評價問題,檢測學生相關素養的形成
1.設計的“教學評價問題1”使用了教材中“弱制強”的案例,通過討論、分析、計算,讓學生思維外顯,評價學生能否從變化觀、平衡觀的視角定性、定量來分析離子反應。
【教學評價問題1】《化學1》(2014年蘇教版第6 版)第44 頁有這樣的一個描述:在空氣中,漂白粉中的次氯酸鈣與水蒸氣、二氧化碳發生反應,生成次氯酸與碳酸鈣,其化學方程式為CO+ HO + Ca(ClO)= CaCO↓+ 2HClO。有同學查文獻發現,在298K 時(HClO) = 3× 10,(HCO) = 4.3 × 10,(HCO) = 5.6 × 10。該同學認為,(HClO) = 3 × 10>(HCO)=5.6×10,生成物應該是Ca(HCO)才對。請同學們討論教材是不是弄錯了,為什么?(提示:(CaCO)=4.96×10)
2.設計的“教學評價問題2——在Co的作用下促進了HCO自偶電離”,可了解學生有沒有分析思路,考查學生認識離子反應的視角,評價學生“宏觀辨識與微觀探析”的素養。
【教學評價問題2】高考題(節選2013年全國新課標I 卷27 題第4 小題)回放:沉鈷工藝流程如圖9 所示,請寫出沉鈷的離子方程式,并從離子反應層面微觀探析產物產生的過程。

圖9 沉鈷工藝流程圖
雖然有些同學能正確寫出該化學方程式:Co+2HCO=CoCO↓+CO↑+2HO,實際上卻是根據質量守恒和電荷守恒來寫的。此題要求學生應能根據微觀探析模型來書寫離子方程式,如圖10 所示。
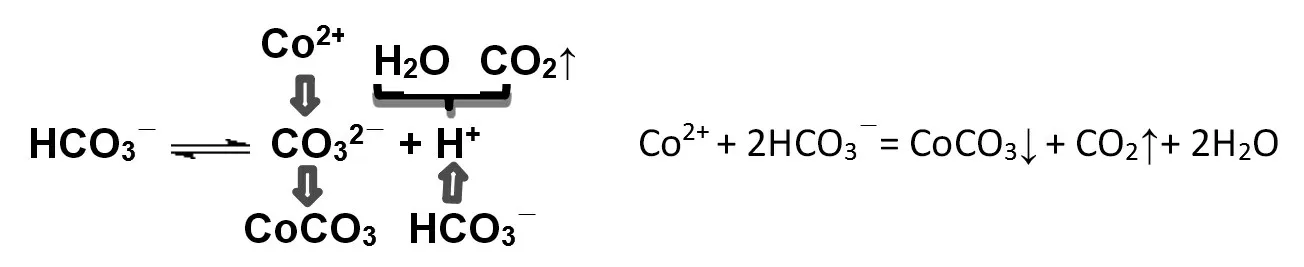
圖10 微觀探析模型與離子方程式
3.設計的“教學評價問題3”涉及水溶液反應體系中多離子的相互競爭平行反應問題,要求學生能從微觀視角構建反應歷程,檢測學生在認識離子反應時能否形成“變化觀”“平衡觀”“微粒觀”及“對立統一”的辯證認識思路,評價學生“宏觀辨識與微觀探析”的核心素養。
【教學評價問題3】高考題(2019年全國I 卷26 題節選)回放:硼酸(HBO)是一種重要的化工原料,廣泛應用于玻璃、醫藥、肥料等工藝。一種以硼鎂礦(含MgBO·HO、SiO及少量FeO、AlO)為原料生產硼酸及輕質氧化鎂的工藝流程如圖11 所示,請寫出在“沉鎂”中生成Mg(OH)·MgCO沉淀的離子方程式并從微觀視角構建反應過程。
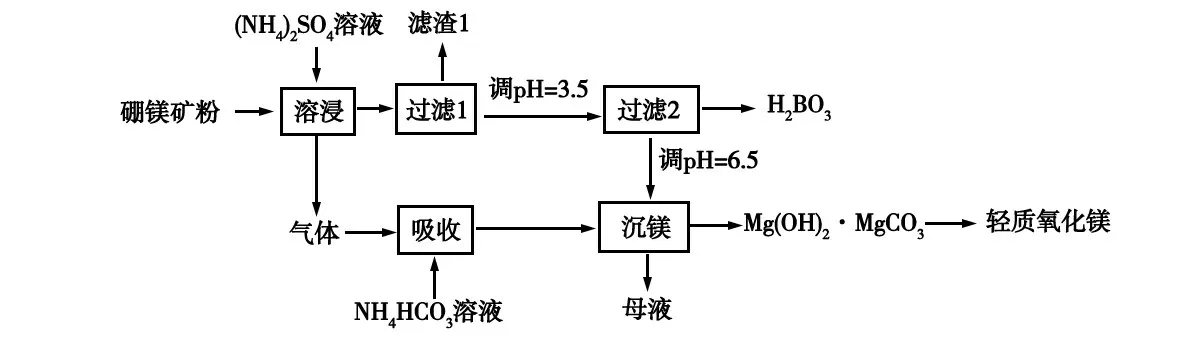
圖11 沉鎂的工藝流程圖
四、教學反思
(一)深度復習,促進復習內容結構化
教學內容結構化,有利于促進學生從化學學科知識向化學學科核心素養的轉化,而內容的結構化則是實現這種轉化的關鍵。
1.促進知識關聯結構化。本節課在教學過程(一)中以常見的離子共存問題為引子,引導學生討論“離子共存問題與哪些知識關聯”,追問“離子共存問題為什么強調‘大量’,為什么H與OH會反應生成水而不能共存,但是在水溶液中卻又同時存在H和OH”等問題,讓學生深刻體會離子反應是個動態反應,離子反應與平衡知識緊密關聯,建構離子反應知識關聯結構模型,促進知識關聯結構化。
2.促進認識思路結構化。在教學過程中,以碳酸鈣與鹽酸反應、漂白粉與漂白液暴露在空氣中變質等常見的真實情境為載體,創設實際問題鏈,引導學生從“宏微結合”“平衡移動”“定性與定量”相結合的視角再認識常見的化學反應問題,讓學生深刻領悟離子反應其實就是平衡移動的結果。拓展認識視角,建構離子反應結構化的認識模型,提升學生認識素養。
(二)“教、學、評”一體化,促進認識素養提升
在復習過程中,教師不是自導自演的“滿堂灌”,而是以學生在學習過程中遇到的實際問題為真實情境,“舊事重提”,設計新的問題鏈,引導學生從不同的視角分析解決“舊情境”中的新問題。采用追問與點評的教學方式,一環扣一環,把即時性評價嵌入“教”與“學”的過程中。特別是學生構建離子反應認識思路后,設置了教學評價問題環節,邊練邊評,以獲得復習目標達成的實證,實現“教、學、評”一體化。在整個教學過程中,引導學生構建離子反應知識關聯,構建微觀探析認知模型,促進學生認識思路結構化,提升學生認識素養。

