α-細辛醚通過調控NLRP3通路保護氧糖剝奪/再灌注損傷BV2細胞的研究
徐飛飛,崔 愷,王立有,管雅琪,劉 銘,李欽青,田雅娟,楚世峰,賀文彬
(1.山西中醫藥大學,中醫腦病學山西省重點實驗室,山西 太原 030619;2.中國醫學科學院藥物研究所,北京 100050)
隨著國家經濟水平的不斷發展,國民生活方式的改變以及高壓的生活節奏,在對近30年(1990—2017年)來影響中國人疾病負擔以及風險因素的大型分析中,腦卒中死亡率逐年升高,成為國民死亡的第一病因,嚴重威脅國民健康水平[1]。腦卒中(cerebral stroke),又稱中風,包括出血性卒中和缺血性卒中,臨床稱之為腦出血和腦梗死。其中缺血性腦卒中占腦卒中比例約為85%。缺血性腦卒中病因復雜、誘因多,溶栓治療和神經保護治療是目前臨床常用的兩類治療方法,但均無明顯療效。此外,溶栓治療后會誘導腦缺血部位繼發性損傷,使腦損傷更為嚴重[2]。
缺血性腦卒中是由于血管堵塞促使血流供應不足誘導的腦血管性疾病,因此中醫臨床常用活血藥和開竅藥作為主要治療藥物。其中,已有研究表明,開竅藥石菖蒲揮發油中的活性物質α-和β-細辛醚在改善缺血性腦卒中誘導的腦損傷中發揮了明顯作用[3-4]。石菖蒲(AcorustatarrinowiiSchott)來源于多年生草本植物石菖蒲的干燥根莖,其性辛,味苦,溫,歸胃、心經,具有化濕開胃、豁痰鎮咳、醒神益智等功效。石菖蒲化學成分多樣,包括揮發油、有機酸、萜類、黃酮以及氨基酸等成分。雖然揮發油僅占石菖蒲化學成分的0.7%~1.3%,但它是石菖蒲發揮藥理作用的有效成分。體內外研究發現,石菖蒲揮發油中β-細辛醚和α-細辛醚在神經系統疾病中有重要藥理活性,尤其在體內實驗中發現,β-細辛醚和α-細辛醚憑借其揮發油特性,能快速通過血腦屏障發揮作用。β-細辛醚和α-細辛醚互為同分異構體,藥代動力學研究發現β-細辛醚在機體內約22%可轉變為α-細辛醚(順式結構轉變為反式結構),使得β-細辛醚的藥理作用變得不明確。已有研究表明,α-細辛醚具有保護心腦血管細胞、抑制血小板聚集、降血脂等多種藥理活性及特點,這在防治腦血管疾病中具有重要意義[5-6]。
炎性反應作為缺血性腦卒中級聯反應中重要部分,在整個腦損傷過程中起到關鍵作用。炎性因子的過度釋放能夠誘導白細胞聚集,上調黏附因子阻塞微血管造成血管內皮細胞損傷,大量氧自由基釋放,從而引起氧化應激。在炎性反應與氧化應激的雙重作用下,血腦屏障破壞,腦組織含水量增多,加重腦損傷[7]。小膠質細胞作為腦內重要的免疫細胞,在腦損傷后迅速激活,釋放炎性因子進行組織修復;但過度激活后炎性因子釋放過量,導致炎性級聯反應的不斷發生。小膠質細胞激活后能夠向M1型與M2型極化,過度激活的小膠質細胞其M1型極化率不斷增加,促進炎性反應的發生,研究發現調節小膠質細胞M1型和M2型極化率能夠明顯降低腦缺血/再灌注造成的損傷。白細胞介素(interleukin,IL)是由免疫細胞分泌的一類炎癥相關細胞因子,其中IL-1β和IL-18是M1型小膠質細胞的分泌性標記物,NOD樣受體家族3(NOD-like receptors 3,NLRP3)炎性小體作為這兩種促炎因子重要的上游蛋白,調控其成熟與釋放。核因子-κB(nuclear factor-kappa B,NF-κB)通路作為IL-1β和IL-18雙向調節通路之一,其磷酸化能夠也能夠調節NLRP3的活化。已有研究證實,α-細辛醚能夠抑制鈣超載及其誘導的興奮性神經毒性,還能夠阻斷NF-κB激酶的降解途徑抑制NF-κB信號通路,進而減輕小膠質細胞介導的神經炎癥,降低了促炎介質腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β的產生[8-9]。本研究主要以氧糖剝奪/再灌注(oxygen and glucose deprivation/referfusion,OGD/R)建立腦缺血/再灌注損傷模型,通過測定小膠質細胞極型轉化及相關炎性蛋白的表達,評價α-細辛醚對腦缺血/再灌注損傷的小膠質細胞的保護作用機制。
1 材料與方法
1.1 材料與儀器小鼠小膠質瘤細胞株(BV2),購自中國醫學科學院基礎醫學研究所細胞資源中心。α-細辛醚(MXUO-AAQ4),中國食品藥品檢定研究院;連二亞硫酸鈉(分析純),天津市恒興化學試劑制造有限公司;DMEM高糖培養基(8020251)、胎牛血清(10099141),賽默飛世爾生物化學制品(北京)有限公司;無糖Earle’s平衡鹽液(G20609),上海源培生物科技股份有限公司;10×電轉液(D1060)、20× TBST緩沖液(T1082)、5×Tris-甘氨酸電泳緩沖液(T1070),北京索萊寶科技有限公司;胰蛋白酶(15H25C15)、蛋白酶抑制劑PMSF(15H14B78)、磷酸酶抑制劑混合物(14L09A83)、增強型RIPA裂解液(15I11B02)、羊抗兔IgG(BA1052)武漢博士德生物工程有限公司;p-NF-κB(SAB4301496)、NF-κB(SAB4502615)抗體,Sigma-Aldrich公司;TNF-α(183218)、TGF-β1/2(ab124894)、NLRP3(ab263899)、caspase 1(ab207802)、β-actin(ab8226)抗體,英國Abcam公司。SDS-PAGE凝膠試劑盒(15L15B38)、CCK-8試劑盒(15I28C60)、BCA蛋白濃度測定試劑盒(15F08A46)、特超敏ECL化學發光即用型底物(15I08A97),武漢博士德生物工程有限公司;IL-1β(MU30369)、IL-18(MU30380)、IL-10(MU30055)、IL-4(MU30385)ELISA試劑盒,武漢貝茵萊生物科技有限公司;ROS試劑盒,上海酶聯生物科技有限公司。VERSA max酶標儀(BNRO5709),上海美谷分子儀器有限公司;高速冷凍離心機(Heraeus Multifuge X1R),賽默飛世爾科技公司;全自動多色熒光及化學發光凝膠成像系統(ChampChemi Professional),北京賽智創業科技有限公司;電泳儀(DYY-6D),北京六一生物科技有限公司;電轉儀(TE77XP),豪沃生物科技(上海)有限公司。
1.2 方法
1.2.1細胞培養 BV2細胞用含10%胎牛血清(FBS)DMEM高糖培養基常規條件下(37 ℃、5 % CO2、飽和濕度、無菌條件)傳代培養。生長狀態良好后調整細胞密度約2×108L-1,取對數生長的BV2細胞接種于96孔板中培養24 h,以備藥物劑量篩選及模型建立方法對比。
1.2.2細胞給藥劑量及模型建立方法篩選 將細胞隨機分為正常組、α-細辛醚組(1、2、4、8、16 μmol·L-1)。各組細胞棄去廢液后,PBS清洗2遍,正常組細胞每孔加完全培養基100 μL,α-細辛醚組細胞每孔加含藥培養基100 μL,培養2 h。以CCK-8試劑盒檢測各組細胞活力,讀取吸光度值(OD值)進行統計分析篩選出合適藥物濃度。
本研究采用化學誘導法損傷BV2細胞。氧化代謝抑制劑主要選擇保險粉(連二亞硫酸鈉,Na2S2O4),無糖培養基選擇無糖厄爾平衡鹽溶液,又稱無糖Earle’s液(Earle's BSS,EBSS)。配制10、20、30 μmol·L-1劑量的含Na2S2O4無糖Earle’s液。避光條件下用無糖Earle’s液洗細胞2次,加入含Na2S2O4無糖Earle’s液處理,即為氧糖剝奪(OGD)。后換回含血清的DMEM培養基繼續培養,即為再灌注(referfusion,R),整個過程可模擬動物實驗中腦缺血/再灌注損傷模型,稱為氧糖剝奪/再灌注模型(OGD/R)。篩選構建OGD/R細胞模型合適的氧糖剝奪時間和再灌注時間,以及氧化代謝抑制劑Na2S2O4的劑量大小。首先取對數生長的BV2細胞接種于96孔板,細胞密度約2×108L-1,24 h后,以行或列為單位將細胞隨機分為6組,分別選取含有10、20、30 μmol·L-1劑量Na2S2O4的無糖Earle’s液對BV2細胞進行處理,處理時間(即氧糖剝奪時間)分別選取2 h和4 h,再灌注時間分別選取0、12和24 h。模型建立完成后由CCK-8試劑盒檢測各篩選條件下BV2細胞活力,選擇合適的Na2S2O4劑量及氧糖剝奪時間和再灌注時間,確定模型建立方法。
將對數生長的BV2細胞接種于96孔板24 h后,將細胞隨機分正常組、OGD/R組、α-細辛醚低、中、高劑量組(1、4、16 μmol·L-1);再以10 μmol·L-1Na2S2O4建立OGD/R模型,先將含有α-細辛醚的完全培養基預處理BV2細胞,2 h后再進行OGD/R模型建立。
1.2.3細胞分組及給藥 將對數生長的BV2細胞接種于96孔板,將細胞隨機分正常組、OGD/R組、α-細辛醚低、中和高劑量組;24 h后棄去廢液,均用PBS清洗2遍,正常組及模型組細胞換為新的完全培養基,α-細辛醚低、中、高劑量組換為分別含有1、4、16 μmol·L-1劑量α-細辛醚的完全培養基;2 h后棄去孔內細胞培養液,除正常組PBS清洗2遍,換為新的完全培養基,模型組及α-細辛醚組均用無糖Earle’s液清洗2遍,換為含有10 μmol·L-1劑量Na2S2O4的無糖Earle’s液;1.5 h后棄去孔內細胞培養液,各組細胞均換為新的完全培養基;12 h后進行細胞形態觀察,提取細胞上清液和細胞蛋白進行其余指標的檢測。
1.2.4酶聯免疫試劑盒檢測炎性因子水平 將對數生長的BV2細胞接種于6孔板,接種密度為2×108個·L-1,將細胞隨機分正常組、α-細辛醚對照組(16 μmol·L-1)、OGD/R組、OGD/R+α-細辛醚低、中和高劑量組(1、4、16 μmol·L-1);步驟同“1.2.3”細胞給藥操作方法。OGD/R模型建立后,吸取細胞上清液至離心管中,離心15 min(12 000 r·min-1,4 ℃),小心吸取上清,分裝后-20 ℃冷凍待用。按照ELISA試劑盒步驟以標準品濃度為Y軸,對應的標準品OD值為X軸,得到標準曲線;將各組測得OD值代入標準曲線中,即可得到相應的待測樣本中分泌因子IL-1β、IL-18、IL-10、IL-4及活性氧(reactive oxygen species,ROS)的濃度。
1.2.6免疫蛋白印跡法檢測炎性相關蛋白表達量 將吸取上清的6孔板中的細胞用冷的PBS清洗3遍,每孔加入已配制的細胞裂解液100 μL(細胞裂解液 ∶PMSF ∶磷酸酶抑制劑=100 ∶1 ∶1),于冰上用細胞刮刀刮至6孔板底部無貼壁細胞,收集到離心管中置于冰上充分裂解,離心30 min(12 000 r·min-1,4 ℃)。吸取上清分裝于新的EP管中,每組取10 μL用于測定蛋白濃度,剩余樣品加相應體積的5× Loading Buffer變性(100 ℃,10 min)。根據BCA試劑盒說明計算各組細胞蛋白濃度,求出細胞蛋白原濃度(細胞蛋白原濃度=計算的蛋白濃度×10×0.8)。根據細胞上樣量為20~60 μg,求得上樣體積(上樣體積=上樣量/蛋白原濃度)。
按說明書配膠,電泳,先80 V后轉120 V;結束后,轉膜2 h;后放入封閉液中,封閉2 h;用TBST洗液洗3×10 min,放入一抗孵育盒中,4 ℃過夜;洗膜3×10 min,用標記的二抗室溫孵育1 h,再洗膜3×10 min。將蛋白印跡膜放置凝膠成像系統暗室中,滴加ECL顯色液。ImageJ軟件分析曝光后所得條帶灰度值,計算目的蛋白。

2 結果
2.1 不同劑量α-細辛醚對BV2細胞活力的影響將1、2、4、8、16 μmol·L-1劑量的α-細辛醚作用于正常細胞2 h,與正常狀態下細胞相比,結果見Fig 1,與正常組細胞相比,1、2、4、8、16 μmol·L-1劑量的α-細辛醚進行2 h干預后,BV2細胞出現增殖趨勢(1.16±0.08vs1.00±0.13,1.13±0.18vs1.00±0.13,1.17±0.22vs1.00±0.13,1.12±0.09vs1.00±0.13,1.18±0.12vs1.00±0.13),但均無明顯差異(P>0.05)。所以α-細辛醚再1~16 μmol·L-1劑量范圍內進行藥物干預是安全的,本研究選用1、4、16 μmol·L-1作為α-細辛醚低、中、高劑量組進行研究。

Fig 1 Effect of different doses of α-asarone on cell vitality
2.2 OGD/R模型建立方法篩選結果篩選構建OGD/R細胞模型合適的氧糖剝奪時間和再灌注時間,以及氧化代謝抑制劑Na2S2O4的劑量大小,分別選取含有10、20、30 μmol·L-1劑量Na2S2O4的無糖Earle’s液對BV2細胞進行處理,及氧糖剝奪時間分別選取2 h和4 h,再灌注時間分別選取0、12和24 h,各組細胞活力結果詳見Tab 3。通過觀察10、20、30 μmol·L-1劑量的Na2S2O4,發現隨著劑量的不斷增加,細胞活力明顯降低;通過觀察腦缺血時間和再灌注時間,發現隨著隨著OGD和R時間的增加,細胞活力也明顯降低。根據以上結果,所以本研究選擇10 μmol·L-1劑量的Na2S2O4進行模型的建立,因各時間段OGD/R條件下BV2細胞活力過低(低于正常組的60%),所以腦缺血時間和再灌注時間仍需要篩選。

Tab 1 Comparison of cell vitality of different OGD/R model establishment methods
經過α-細辛醚給藥劑量及OGD/R模型方法篩選后,已確定α-細辛醚給藥劑量分為低、中、高劑量組(1、4、16 μmol·L-1);確定以10 μmol·L-1劑量的Na2S2O4建立OGD/R模型。將氧糖剝奪時間選為2和1.5 h,再灌注時間為12和24 h,再次進行篩選。將對數生長的BV2細胞接種于96孔板,分為正常組、OGD/R組、α-細辛醚低、中、高劑量組。
由Fig 2A結果可得,與正常組相比,模型組BV2細胞活力過低(0.47±0.16vs1.00±0.22;0.55±0.08vs1.00±0.19,P<0.01);與模型組相比,α-細辛醚給藥組無明顯差異。Fig 2B結果可得,與正常組相比,模型組BV2細胞活力接近于60%(0.55±0.05vs1.00±0.08;0.60±0.06vs1.00±0.19,P<0.01);與模型組相比,OGD 1.5 h+R 24 h條件下α-細辛醚給藥組無明顯差異,OGD 1.5 h+R 12 h條件下α-細辛醚中、高劑量組細胞活力明顯提高(0.72±0.05vs0.60±0.06,P<0.05;0.80±0.09vs0.60±0.06,P<0.01)。綜上,OGD/R模型篩選結果,氧糖剝奪2 h或再灌注24 h條件下BV2細胞損傷過于嚴重,所以可將氧糖剝奪時間定為1.5 h,再灌注時間定為12 h,在此條件下,模型組細胞活力約為正常組細胞的60%,符合模型建立的標準。且α-細辛醚也表現出明顯的提高細胞活力的作用,這一結果表明,α-細辛醚預處理能夠明顯改善對OGD/R模型誘導的細胞損傷,促進損傷細胞的恢復。

Fig 2 Effect of α-asarone on cell vitality of OGD/R model cells
2.3 細胞一般形態變化如Fig 3所示,正常組BV2細胞在正常未激活狀態下生長狀態良好,胞體飽滿立體,胞間偶見突觸連接,背景清晰;α-細辛醚對照組細胞細胞數目及胞間突觸連接增多;OGD/R模型組細胞細胞數目減少,細胞碎片增多,出現胞體較大的“阿米巴樣”細胞,且背景不清晰;α-細辛醚低、中、高劑量組細胞隨著給藥劑量的增加,“阿米巴樣”細胞減少,胞體逐漸立體飽滿。從細胞形態結果可直觀顯示,α-細辛醚對正常細胞具有一定的促增殖作用;α-細辛醚預處理對腦缺血/再灌注損傷模型細胞有一定保護作用。

Fig 3 Effect of α-asarone morphological changes on damaged cells of OGD/R model
2.4 BV2細胞促炎因子與抗炎因子水平
2.4.1促炎因子IL-1β及IL-18水平 建立IL-1β標準品梯度濃度與對應OD值標準曲線,標準曲線方程式為Y=491.66X-14.302,R2=0.9944;建立IL-18標準品梯度濃度與對應OD值標準曲線,標準曲線方程式為Y=375.28X-20.713,R2=0.9917。
將各組OD值為X值代入標準曲線中求Y值,即得到各組細胞分泌的促炎因子IL-1β和IL-18的濃度(ng·L-1),結果見Fig 4。與正常組相比,模型組細胞分泌的促炎因子IL-1β水平明顯升高,約為正常組細胞的2倍(400.5±28.25vs192.8±18.63,P<0.01);與模型組相比,α-細辛醚低、中、高劑量組細胞分泌的IL-1β水平明顯降低(314.2±9.05vs400.5±28.25,301.5±9.17vs400.5±28.25,281.0±12.45vs400.5±28.25),差異均有統計學意義(P<0.01)。與正常組相比,模型組細胞分泌的促炎因子IL-18水平明顯升高(263.7±20.66vs143.5±27.25,P<0.01);與模型組相比,α-細辛醚低劑量組細胞分泌的IL-18水平降低(231.3±17.18vs263.7±20.66,P>0.05);α-細辛醚中、高劑量組均表現出極明顯差異(P<0.01),IL-18水平降低明顯(210.9±16.45vs263.7±20.66,201.2±21.81vs263.7±20.66)。

Fig 4 Effect of α-asarone on IL-1β and IL-18 in OGD/R model cells
根據以上結果,可以發現α-細辛醚對正常細胞炎性因子的水平無影響;OGD/R模型損傷后,BV2細胞的促炎因子水平急劇上升,α-細辛醚預處理能夠明顯降低腦缺血/再灌注損傷BV2細胞促炎因子IL-1β和IL-18的釋放,并且呈量效關系,以α-細辛醚高劑量(16 μmol·L-1)效果最佳。
2.4.2抑炎因子IL-10及IL-4水平 建立IL-10標準品梯度濃度與對應OD值標準曲線,標準曲線方程式為Y=585.37X-25.179,R2=0.994 4;建立IL-4標準品梯度濃度與對應OD值標準曲線,標準曲線方程式為Y=191.01X-16.792,R2=0.994 5。結果見Fig 5。與正常組相比,模型組細胞分泌的抑炎因子IL-10水平升高(308.3±24.61vs242.3±27.47,P<0.001);與模型組相比,α-細辛醚低劑量組細胞分泌的IL-10水平有升高趨勢(336.4±27.87vs308.3±24.61),無明顯差異(P>0.05);α-細辛醚中、高劑量組細胞分泌的IL-10水平較模型組明顯升高(358.5±13.58vs336.4±27.87,P<0.01;392.3±49.89vs336.4±27.87,P<0.01)。與正常組相比,模型組細胞分泌的促炎因子IL-4水平明顯升高(118.2±12.36vs95.59±17.95,P<0.01);與模型組相比,α-細辛醚低、中劑量組細胞分泌的IL-4水平明顯升高(136.3±8.29vs118.2±12.36,135.1±10.70vs118.2±12.36,P<0.05);α-細辛醚高劑量組也表現出明顯差異(139.3±8.00vs118.2±12.36,P<0.01)。

Fig 5 Effects of α-asarone on IL-10 and IL-4 in OGD/R injured cells
根據以上結果,可以發現α-細辛醚對正常細胞炎性因子的水平無明顯影響;OGD/R模型損傷后,BV2細胞的促炎因子水平急劇上升外,同時抑炎因子的水平也呈上升趨勢;α-細辛醚預處理能夠明顯升高腦缺血/再灌注損傷BV2細胞抑炎因子IL-10和IL-4的釋放,并且呈量效關系,以α-細辛醚高劑量(16 μmol·L-1)效果最佳。
與正常組細胞相比,模型組細胞IL-1β、IL-18和IL-10、IL-4均升高,說明正常BV2細胞在OGD/R激活后,向M1型和M2型均有明顯轉化趨勢。α-細辛醚預處理的損傷細胞,除了能夠明顯降低促炎因子水平之外,還能夠明顯提升抑炎因子水平,α-細辛醚能夠降低活化的BV2細胞向M1型轉化,促進其向M2型轉化,起到抗炎作用。
2.4.3促炎介質TNF-α和抑炎因子TGF-β蛋白表達量 如Fig 6所示,與正常組相比,OGD/R模型組細胞TNF-α蛋白表達量有升高趨勢(1.209±0.095vs1.000±0.076);與模型組相比,α-細辛醚對TNF-α蛋白表達量有降低趨勢(0.945±0.131vs1.209±0.095,0.903±0.068vs1.209±0.095,0.925±0.131vs1.209±0.095),其中α-細辛醚中劑量組與高劑量組表現出明顯差異(P<0.05),α-細辛醚低劑量組差異無顯著性(P>0.05)。與正常組相比,OGD/R模型組細胞TNF-α蛋白表達量有升高趨勢(1.808±0.277vs1.000±0.183),差異明顯(P<0.01);與模型組相比,α-細辛醚對TGF-β蛋白表達量有降低趨勢(2.008±0.120vs1.808±0.277,2.509±0.177vs1.808±0.277,2.554±0.312vs1.808±0.277),其中α-細辛醚中劑量組與高劑量組表現出差異有顯著性(P<0.05),α-細辛醚低劑量組差異無顯著性(P>0.05)。

Fig 6 Effect of α-asarone on expression of TNF-α and TGF-β in OGD/R model cells
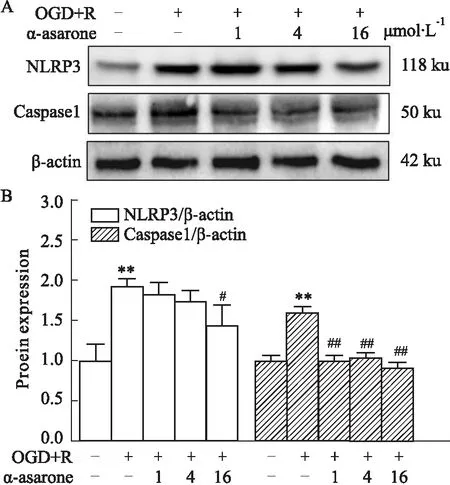
Fig 7 Effect of α-asarone on expression of NLRP3 and caspase 1 in OGD/R model cells

Fig 8 Effect of α-asarone on expression of p-NF-κB in OGD/R model cells
由上述結果可得,α-細辛醚對腦缺血/再灌注損傷BV2細胞能夠起到抗炎作用,與ELISA檢測結果一致。綜上,通過對6種M1型和M2型極型分泌性標記物的檢測,發現α-細辛醚可以降低M1型分泌性標記物的分泌,促進M2型分泌性標記物的分泌,所以α-細辛醚對OGD/R誘導的細胞損傷能夠起到明顯的改善作用,可能與調節活化的小膠質細胞的M1、M2極型轉化有關。
2.5 炎癥小體NLRP3及caspase 1蛋白表達量與正常組相比,OGD/R模型組細胞NLRP3蛋白表達量有明顯升高趨勢(1.918±0.104vs1.000±0.207);與模型組相比,各劑量α-細辛醚預處理后NLRP3蛋白表達量有降低趨勢,其中α-細辛醚低劑量組和中劑量組差異無顯著性(1.826±0.149vs1.918±0.104,1.728±0.1451vs1.918±0.104,P>0.05),α-細辛醚高劑量組明顯降低(1.439±0.246vs1.918±0.104,P<0.05)。與正常組相比,OGD/R模型組細胞caspase 1蛋白表達量升高(1.603±0.071vs1.000±0.066),差異有顯著性(P<0.01);與模型組相比,α-細辛醚低、中、高劑量均對caspase1蛋白表達量差異有降低趨勢(1.004±0.067vs1.603±0.071,1.036±0.065vs1.603±0.071,0.906±0.069vs1.603±0.071,P<0.01)。
由上述結果可得,α-細辛醚能夠降低NLRP3和caspase 1蛋白表達。
2.6 核轉錄因子NF-κB的蛋白表達量與正常組相比,OGD/R模型組細胞p-NF-κB蛋白表達量升高(1.554±0.123vs1.000±0.114);與模型組相比,α-細辛醚低、中、高劑量對NF-κB蛋白表達量降低(1.113±0.068vs1.554±0.123,1.027±0.1822vs1.554±0.123,1.042±0.182vs1.554±0.123)(P<0.05或P<0.01),結果表明,腦缺血/再灌注損傷后BV2細胞出現了NF-κB的過度磷酸化,而α-細辛醚改善OGD/R模型誘導的細胞損傷與其降低NF-κB磷酸化有關。
2.7 ROS活性測定結果如Fig 9所示,與正常組相比,模型組細胞ROS活力明顯升高(21.92±3.37vs10.22±2.02,P<0.001);與模型組相比,α-細辛醚低、中、高劑量組細胞ROS活性明顯降低(14.84±1.18vs21.92±3.37,12.04±2.634vs21.92±3.37,10.98±2.088vs21.92±3.37),均表現出明顯差異(P<0.01)。該結果表明,Na2S2O4結合無糖培養基誘導BV2細胞線粒體損傷,能夠產生過量的ROS,各劑量α-細辛醚對線粒體損傷后ROS的活力有抑制作用,通過減少細胞質中過多的ROS產生,以降低其對線粒體及細胞的損傷。

Fig 9 Effect of α-asarone on ROS activity of OGD/R model cells
3 討論
局部小膠質細胞在缺血發作后幾分鐘內被激活,腦缺血后48~72 h出現小膠質細胞增殖高峰,損傷后可持續數周,并產生大量的促炎介質,包括IL-1β和TNF-α,加劇腦組織損傷。然而,多種證據表明,激活的小膠質細胞在缺血性腦卒中中起著雙重作用,激活的小膠質細胞能產生多種神經營養因子,這些因子參與腦組織的修復,還能夠保護大腦免受興奮性毒性損傷。越來越多的研究認為,引起此現象的原因是由于的小膠質細胞在激活狀態下的細胞極型轉化[8]。在病理條件下,活化的小膠質細胞能極化為M1型(促炎作用)和M2型(抑炎或保護作用)。M1型小膠質細胞分泌促炎細胞因子,如TNF-α、IL-1β、IL-18和NO等,加重炎癥和組織損傷。相反,M2型小膠質細胞分泌抗炎細胞因子,如TGF-β、IL-4、IL-10和RELM-α等,此外還能夠分泌VEGF、BDNF和PDGF等,通過抑制炎癥促進組織恢復。Kanazawa等[10]認為以促進小膠質細胞向M2型轉化為基礎的治療可能是腦卒中的保護性治療策略。
體外實驗研究腦缺血/再灌注損傷主要以建立OGD/R模型為主,該模型通過氧糖剝奪建立腦缺血條件下缺糖缺氧的培養細胞環境,再通過復糖復氧模擬再灌注環境[11]。本研究采用化學試劑 Na2S2O4抑制線粒體氧化磷酸化過程,結合無糖Earle’s液模擬缺糖缺氧環境,但現在研究中對于Na2S2O4劑量及氧糖剝奪/再灌注的時間選擇不一,所以本研究增加了劑量篩選實驗,確定以10 μmol·L-1劑量的Na2S2O4建立OGD/R模型,氧糖剝奪/再灌注時間分別為1.5 h與12 h。
IL-1β、IL-18作為M1型小膠質細胞的分泌型標記物,本研究對BV2細胞培養液中的促炎因子IL-1β、IL-18進行水平檢測。發現OGD/R模型細胞分泌的炎性因子比正常細胞明顯升高,而α-細辛醚預處理的損傷細胞分泌的炎性因子明顯降低;同時,本研究也檢測了抑炎因子IL-10、IL-4水平,發現與正常細胞相比,OGD/R模型細胞分泌的抑性因子明顯升高,而α-細辛醚預處理的損傷細胞分泌則更高。該結果與Ding等[12]以及Chen等[9]的研究結論相一致,所以可認為α-細辛醚預給藥能夠保護BV2細胞,通過降低促炎因子,同時升高抑炎因子水平發揮抗炎作用,從而減輕OGD/R造成的細胞損傷。不過,在Jiang等[13]測得抑炎因子的結果與本研究相反,他們的研究結果顯示損傷細胞與正常細胞相比其抑炎因子水平呈降低趨勢,出現該結果的原因可能是本研究采用的是小鼠小膠質瘤細胞(BV2細胞),該細胞在活化條件下,向促炎型(M1型)和抑炎型(M2型)均有轉化,所以跟正常細胞相比其炎性因子和抑炎因子都會表現出升高趨勢。此外,通過對各組BV2細胞蛋白中促炎介質TNF-α及抑炎介質TGF-β進行蛋白表達量測定,得到與ELISA檢測相同的結果。可以認為OGD/R損傷后BV2細胞過度激活,向M1型和M2型轉化,雖然M2型作起到抗炎作用,但M1型細胞大量釋放促炎因子,所以BV2細胞M1型極化率明顯高于M2型,仍使得損傷細胞處于過度炎性反應中;α-細辛醚預處理能夠使OGD/R損傷后激活的BV2細胞向M2型極化,釋放抑炎因子,從而平衡促炎因子過多誘導的炎性反應來保護細胞。
IL-1β、IL-18作為炎癥反應的重要參與者,它們的激活和分泌與兩條通路密切相關,即 NLRP3炎性小體和 NF-κB信號通路[14]。其中,NLRP3炎癥小體是一種大分子多復合蛋白體,NLRP3炎癥小體最廣泛的特征是控制IL-1β、IL-18前體蛋白pro-IL-1β/18的關鍵節點。激活后的NLRP3炎癥小體在接頭蛋白ASC的幫助下募集pro-caspase 1,將其剪切成為有活性的caspase 1,活化后的caspase 1能夠將pro-IL-1β/-18剪切成為有活性的IL-1β、IL-18,促進炎性反應的發生。NLRP3與caspase 1作為IL-1β、IL-18上游調節其分泌的蛋白分子。多數體內外研究發現,通過抑制NLRP3的活化能夠降低炎性反應發生,減輕腦缺血/再灌注損傷。并且,近年來大量證據表明,調節NLRP3的活性是改善腦卒中的潛在治療手段[15]。本研究通過測定NLRP3及caspase 1表達量,發現與正常細胞相比,OGD/R模型細胞NLPR3及caspase 1蛋白表達量明顯升高,而α-細辛醚預處理能降低它們的過度激活,可以認為α-細辛醚預處理對OGD/R損傷BV2細胞的保護作用,及α-細辛醚能夠起到的抗炎作用,與調節NLRP3炎癥小體的活化有關。
NF-κB作為一種多向性轉錄調節蛋白,在腦缺血/再灌注損傷中的作用機制主要通過促進炎癥的發生發展來實現。腦缺血時小膠質細胞中的NF-κB被激活后,促使IL-1β、IL-18、TNF-α等炎性因子表達。同時這些促炎因子又可以激活NF-κB,從而使該過程在腦細胞間不斷擴散,加重炎癥反應。研究發現,NF-κB作為炎性通路TLR/NF-κB的參與蛋白,也能上調NLRP3蛋白的表達,促進NLRP3炎性小體的激活[14]。本研究通過測定NF-κB及其磷酸化蛋白表達量,發現α-細辛醚能明顯OGD/R損傷后BV2細胞出現的NF-κB過度磷酸化。綜上,可以認為NLRP3炎性小體和NF-κB經典信號通路均參與到α-細辛醚調節炎性反應改善腦缺血/再灌注損傷的作用機制中。不過,α-細辛醚是作為炎性蛋白抑制劑發揮作用,還是在對炎性蛋白上游調控因子產生作用?這些可以簡單從OGD/R細胞模型建立的原理推測。
本研究主要采用的是Na2S2O4進行OGD/R細胞模型的建立,其原理主要是通過抑制線粒體產生ATP,作為氧化代謝抑制劑起到細胞除氧的作用。由此看來,線粒體是病理改變最先發生的細胞器。研究表明,活性氧,尤其是來自線粒體的活性氧,參與了NLRP3炎癥物質的激活。并且,許多NLRP 3炎癥小體激活劑都能在多種細胞中觸發線粒體活性氧的產生[16]。 線粒體作為ROS產生的部位,損傷后其能產生大量ROS,而過高水平的ROS又能刺激線粒體和NLRP3,促進其激活后發揮促炎作用[17-18]。本研究經過ROS檢測,Na2S2O4結合無糖培養基誘導BV2細胞線粒體損傷,能夠產生過量的ROS,α-細辛醚對線粒體損傷后ROS的活力有抑制作用,通過減少細胞質中過多的ROS產生,以降低其對線粒體及細胞的損傷。
綜上,α-細辛醚能夠改善氧糖OGD/R導致的BV2細胞損傷,其作用機制可能與調節NLRP3炎癥小體及BV2細胞M1型與M2型轉化有關。相對于OGD/R損傷細胞,α-細辛醚預干預能夠提高細胞活力,減輕受損細胞產生的ROS活性,抑制NF-κB的磷酸化,以降低NLRP3炎癥小體的過度活化;降低caspase 1對促炎因子前體pro-IL-1β/18的剪切,進而降低IL-1β與IL-18的分泌,促進抑炎因子IL-10與IL-4的分泌,起到保護細胞的抗炎作用。