黃芩苷聯合京尼平苷治療結直腸癌關鍵靶點BOP1的分子對接機制研究Δ
張天澤,陳 靜,張 偉,趙 彧,孫付軍,郭紅梅,邵 露,張樂林,林慧彬,李克明#
(1.北京中醫藥大學中醫學院,北京 100029; 2.青島市中醫醫院(青島市海慈醫院)藥劑科,山東 青島 266033; 3.青島市中醫醫院(青島市海慈醫院)肛腸科,山東 青島 266033; 4.山東省中醫藥研究院中藥藥理研究所,濟南 250014; 5.山東省中醫藥研究院中藥炮制研究所,濟南 250014; 6.山東省中醫藥研究院中藥資源研究所,濟南 250014)
結直腸癌(colorectal cancer,CRC)是人類消化道中常見的惡性腫瘤之一,其發病率在全球惡性腫瘤中居第2位[1]。在我國,每年新增CRC患者數為37.6萬例,死亡19.1萬例,且呈逐年升高趨勢。多數患者在確診時已經為晚期患者,5年存活率僅為13.1%,轉移是晚期CRC患者常見的死亡原因之一。多項研究結果表明,增殖阻斷1蛋白(BOP1)調節多種類型腫瘤的發生、上皮間質轉化、遷移、轉移和耐藥性[2-3]。課題組前期研究發現,BOP1可通過調節c-Jun 氨基端蛋白激酶(JNK)通路促進CRC細胞遷移和侵襲,而敲低后可抑制JNK信號通路介導的遷移和侵襲過程[4]。因此,BOP1是CRC細胞侵襲和遷移的重要調節因子,研究控制腫瘤細胞轉移的新分子可能為CRC的治療提供有效的方法。CRC的發生發展由多個階段組成,西藥長期治療容易產生多藥耐藥性,化療手段會極大程度地影響患者自身免疫系統,而使用中藥天然藥物輔助治療不良反應少,可在一定程度上逆轉腫瘤多藥耐藥[5]。黃連解毒湯為中醫名方,源自《外臺秘要》引崔氏方,在臨床被用于瀉火解毒;現代研究結果發現,黃連解毒湯中黃芩苷、京尼平苷為其干預與逆轉腫瘤多藥耐藥的有效成分。研究結果顯示,黃芩苷和京尼平苷組合是黃連解毒湯抗腫瘤及逆轉腫瘤多藥耐藥的主要物質基礎,且黃芩苷10 μg/mL、京尼平苷20 μg/mL對腫瘤細胞增殖的抑制作用明顯[6-8]。本研究通過分子對接技術,探究黃芩苷聯合京尼平苷對CRC關鍵靶點BOP1的抑制作用,為黃芩苷聯合京尼平苷的進一步開發與應用提供理論基礎。
1 資料與方法
1.1 供受體的獲取及分子模擬過程
AlphaFold數據庫(https://alphafold.ebi.ac.uk/)使用機器學習方法將來自蛋白質數據庫的現有蛋白質結構知識和序列比對以及物理和幾何約束的信息匯總在一起,以提供蛋白質結構的預測原子模型[9-10]。其人源BOP1蛋白(UniProt ID:Q14137)原始序列文件經Maestro 11.9軟件處理還原為3D模型,通過“Protein Preparation Wizard”套件自動分配鍵序、添加氫、與金屬形成零級鍵、將硒代甲硫氨酸轉化為甲硫氨酸、添加缺失的側鏈、創建可能的二硫鍵、刪除與配位點距離超過50 nm的雜基團,并在pH為7.0時產生雜質子化狀態,最后使用OPLS3e力場進行限制最小化,直到重原子的均方根誤差(RMSD)收斂達到3 nm。
配體小分子黃芩苷和京尼平苷分別以“baicalin”和“geniposide”在PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)中檢索,以獲取其“*.sdf”結構文件。并導入Maestro 11.9軟件中,使用“LigPrep”套件,添加金屬結合態,并產生互變異構體;保留了特定的手性,每個結構最多產生4個立體異構體。生成在pH為5.0~9.0下的最低能量分子狀態。
1.2 活性位點模擬及對接
通過SiteMap算法在域-域界面識別表觀遺傳蛋白的小分子結合位點,將活性部位等效為白色格點,并確定排序靠前的潛在受體結合位點作為該蛋白的最終活性位點[11]。通過“Receptor Grid Generation”套件確定對接盒子區域大小以及中心位置,以供配體小分子對接。
1.3 結合模式分析
蛋白質-配體相互作用譜分析(protein-ligand interaction profiler,PLIP)是由德國德累斯頓工業大學開發的一款基于Python 3的開源工具(https://github.com/pharmai/plip),可用于識別蛋白質受體與其配體之間的非共價相互作用[12]。將“配體-受體”對接態分子導入PLIP平臺,通過結構準備、功能表征和基于規則的匹配的相互作用過濾將結構氫化,并提取配體與其結合位點輸出特征數據,最后進行相互作用檢測和可視化。
2 結果
2.1 蛋白3D模型還原與檢驗
下載BOP1原始序列,整理為“MAGSAGAGATAAPSVAPG LAASGPGLGPGPGPGPPLLCTSPLSHSTGSASGVSASGGSVPSGL GASGSASSGAAAGGAGGGGAGALAAGGHSGILLTTGGGVGAST PCPATGMASAAIGAGTAGASSAGGAIAATVGAVPLGTTAAPPH VGTALAGAAITLPLATAAGLAGPLALMAAPATTATVGAPMTGA ALALTAGGVALVAALGSGGPGAVGPAPTGPAVAPPSGAVMIHP VTAAPAALASPIPSLVGLGLVSAMVHAILMGTIGPAAPAAPTPSP TALTAGGAPAAVLGAHLMHVPAPLLALPGHAGSTAPPPGTLLS GGGALATGGGGPGGALLSPLPALPPSLAAVPATGAPIGGAPGA CLALTLCPAGALMAVAVAPGALIPLLPAPAALGPPPTCGALVT AGHSALVACLSVSPGGGTLVSGSAAGSLALTGVATAACVATVP VGGVVLSVATAPSPAVCLVAAAVGASVLLLAPALGAALVAGST AGLLSAPVPPGGPPLGPAATLGASGGGAGVGLALAICHGLPVT GVTTHGAGATLAVVLATGGHTGVLIHGLSAAASGSPPAASHGG VGAVAPHPAAPPLLVASGASVALTHLLAGGLTLLLMPACLTVSS LAVHPAGAAVICGSTASLLVTPALALSTLPTAMLAHHLLALAAV APHPATPLPASGSAAGSVIVCHGMVTAALLGAPLLVPVLVLLG HVLTAALGVLAVIPHPTGPTVPSSGAAGTVALPT”,導入Maestro 11.9軟件進行處理,結構還原后的預測對齊誤差見圖1。圖1表示,當預測結構和真實結構在殘基y上對齊時,位置(x,y)處的顏色表示AlphaFold 在殘基x處的預期位置誤差。依據軟件算法對還原的結構打分,產生每個殘基的置信度分數(pLDDT)并分為4級:非常高(pLDDT≥90),確信(pLDDT為70~<90),低(pLDDT為50~<70),非常低(pLDDT<50。處理后的BOP1大部分殘基pLDDT均>90,代表模型置信程度非常高,可以用于對接研究,處理后的條帶模型和表面模型結構見圖2。
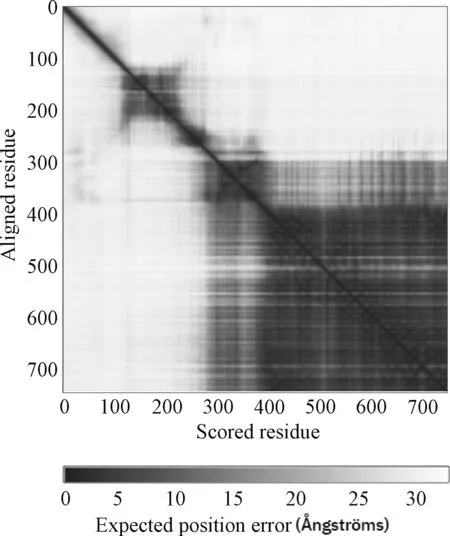
圖1 構建蛋白預測對齊誤差Fig 1 Constructed protein prediction alignment error
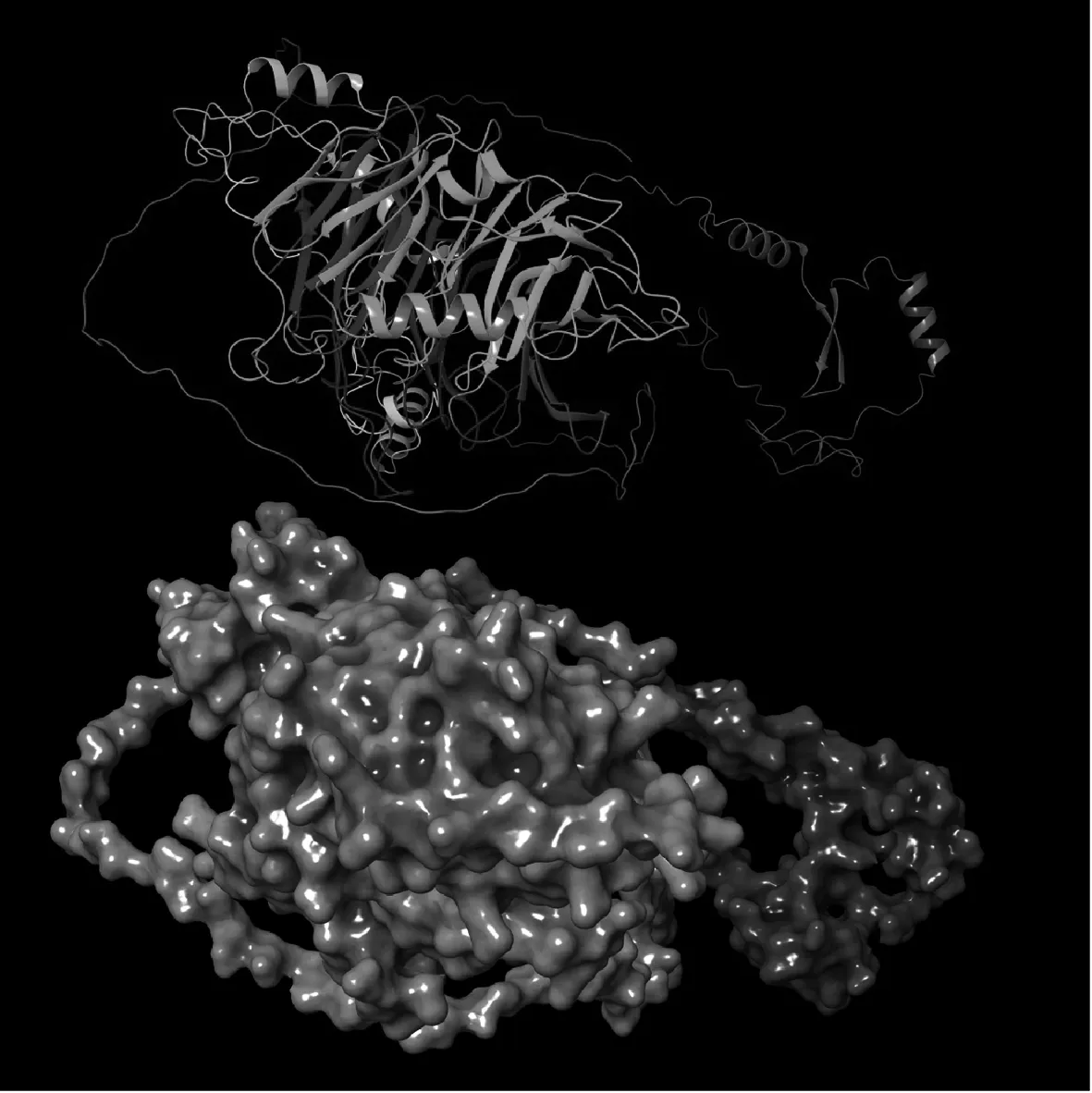
圖2 還原BOP1蛋白的條帶模型和表面模型示意圖Fig 2 Schematic diagram of the band model and surface model of the reduced BOP1 protein
2.2 高精對接盒子設置
使用SiteMap算法檢查涉及識別和修改蛋白標記的多個域的結構,確定了域-域接口處的5處潛在結合位點,并按置信度命名為site1—site5。選用site1處位點計算生成對接盒子,進行下一步的對接,見圖3。
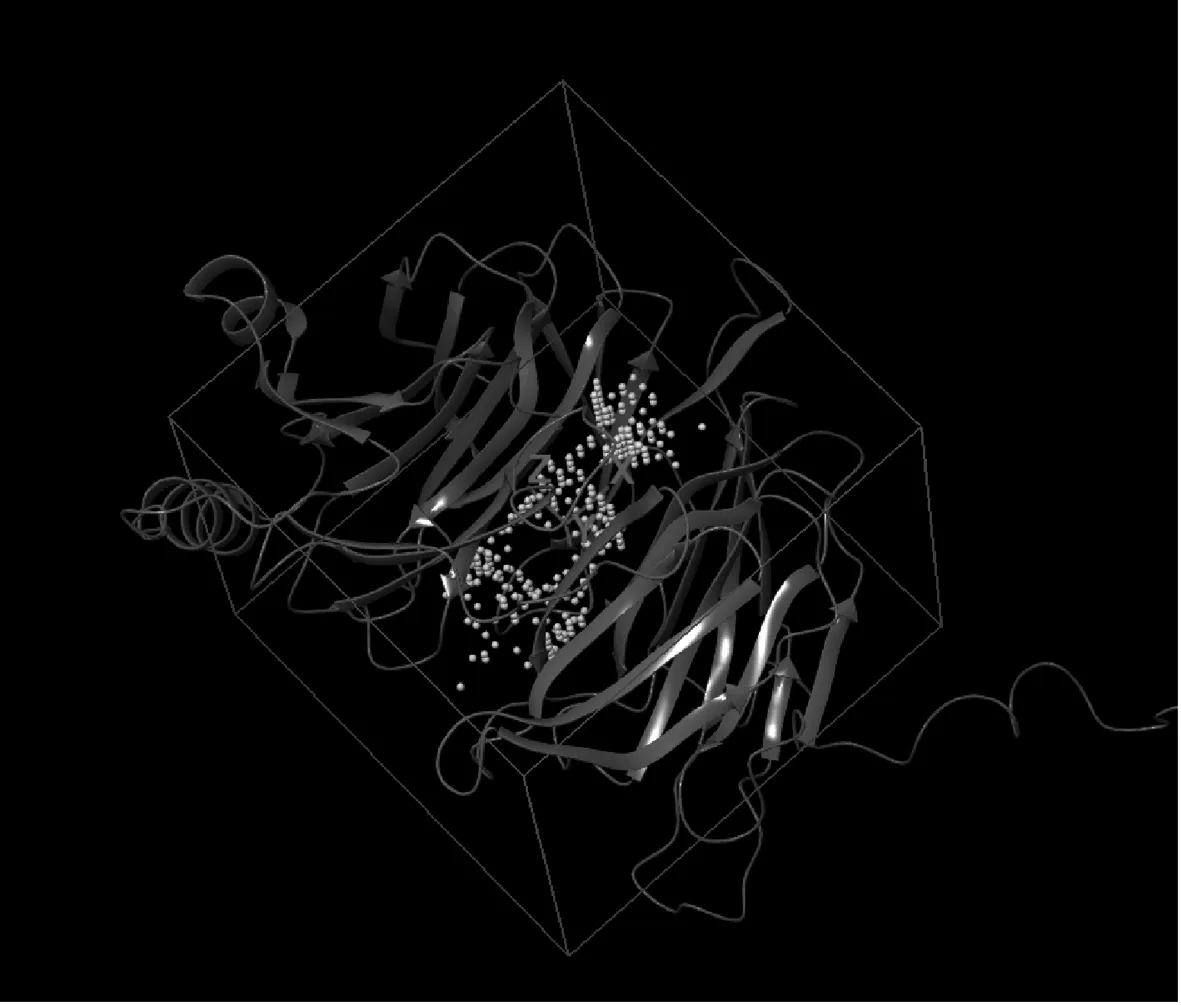
圖3 計算site1結合位點域與對接盒子示意圖Fig 3 Schematic diagram of calculating site1 binding site domain and docking box
2.3 對接結果及結合模式
通過Glide算法計算黃芩苷與BOP1靶點對接結合分數為-6.401,京尼平苷與BOP1靶點對接結合分數為-6.241。通過PLIP分析,黃芩苷與BOP1生成了10個氫鍵相互作用、1個疏水作用和1個鹽橋(見表1),其3D結合模式圖見圖4(A),對接細節見圖4(B);京尼平苷與BOP1生成了6個氫鍵相互作用(見表2),其3D結合模式圖見圖4(C),對接細節見圖4(D)。
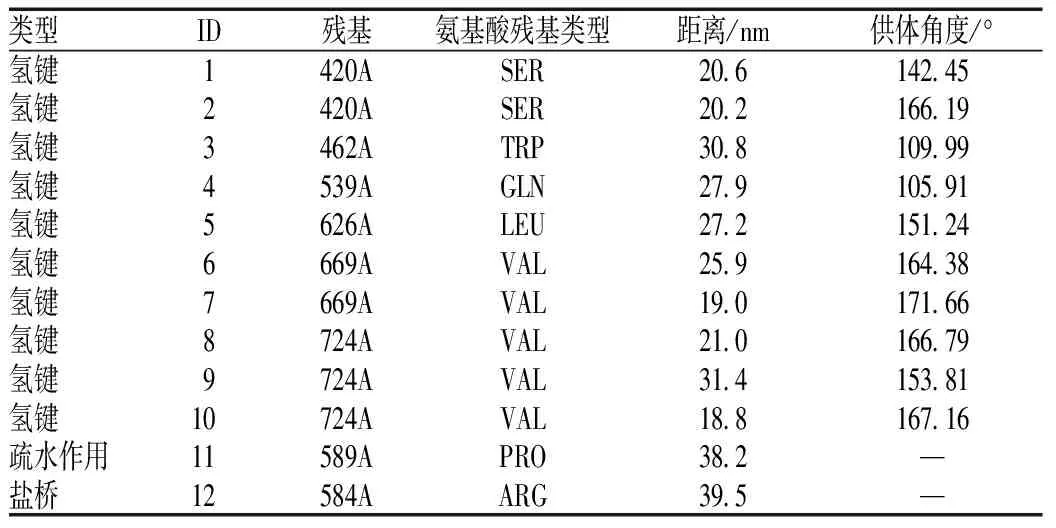
表1 黃芩苷與BOP1對接的相互作用力Tab 1 Interaction force between baicalin and BOP1 docking
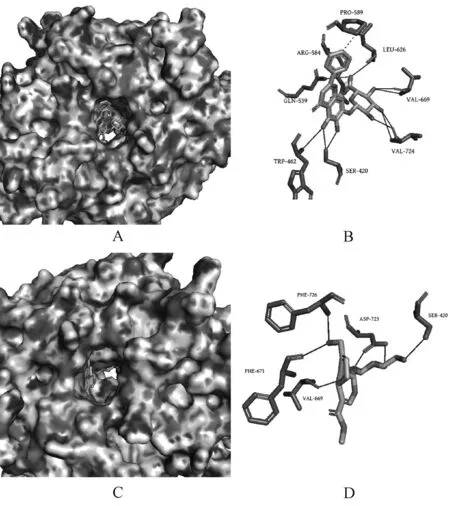
A.黃芩苷與BOP1的3D結合模式圖;B.黃芩苷與BOP1的對接細節圖;C.京尼平苷與BOP1的3D結合模式圖;D.京尼平苷與BOP1的對接細節圖A.3D binding pattern of baicalin and BOP1;B.details of the docking of baicalin and BOP1;C.3D binding pattern of geniposide and BOP1;D.details of the docking of geniposide and BOP1圖4 黃芩苷和京尼平苷與BOP1的分子對接模式圖Fig 4 Molecular docking pattern of baicalin and geniposide with BOP1
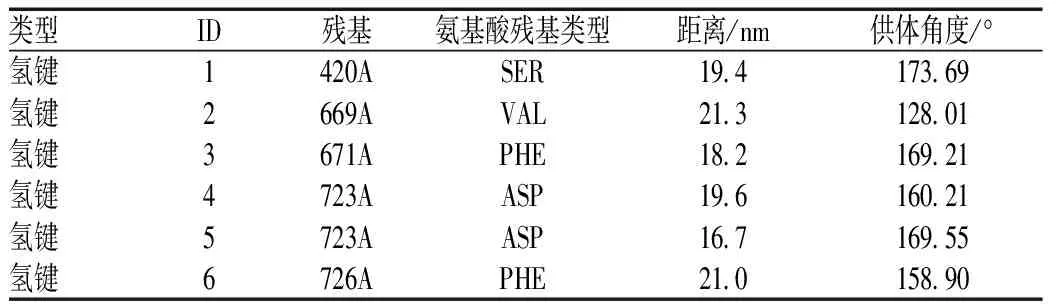
表2 京尼平苷與BOP1對接的相互作用力Tab 2 Interaction force between geniposide and BOP1 docking
3 討論
CRC為常見的消化道惡性腫瘤,據統計,其在世界范圍內的患病率為5%,我國的CRC患者數在全球CRC患者中占比高達31%,且<50歲人群的CRC發病率以每年2%的速度增長,肝轉移和肺轉移是致死的重要原因[13-15]。前期課題組的實驗研究結果表明,黃連解毒湯的抗腫瘤作用與其含有的黃芩苷、京尼平苷有關[7-8]。因此,對黃芩苷聯合京尼平苷的抗CRC作用機制進行分析,對于降低患者風險、抑制腫瘤擴散有著重要意義。BOP1為WD40蛋白家族的成員,具有4個WD重復基序,包括732個氨基酸,在真核生物中高度保守,已被確定為60S核糖體生物發生和核糖體RNA加工的重要調節因子[16]。據報道,BOP1是在幾種惡性腫瘤中表達紊亂,并參與促進腫瘤的發生和發展[17-18]。課題組前期研究結果表明,BOP1通過JNK通路促進人CRC細胞遷移和侵襲,因此,BOP1可以用作各種腫瘤的有前途的分子預后生物標志物,在各種惡性腫瘤中的表達將導致不同的臨床結果[4]。經檢索發現,BOP1暫無已發表的可用的3D結構,因此,本研究基于人源BOP1蛋白(UniProt ID:Q14137)的原始序列文件建模其蛋白結構用于對接,經檢驗構建的模型置信程度非常高,可以用于后續的精細對接研究。
本研究基于分子對接技術,探索黃芩苷聯合京尼平苷的抗CRC作用靶點BOP1的調節作用。在Glide對接算法中,受體-配體親和力越強,構象越穩定,其靶點對接結合分數的絕對值越大;絕對值>4.25代表有結合活性,>5.0代表有較強的結合活性[19-20]。從結果來看,黃芩苷、京尼平苷與BOP1靶點對接結合分數分別為-6.401、-6.241,均具有較好的結合活性,在一定程度上說明了二者能夠通過結合BOP1,從而實現一定的生理功能。
SiteMap是一種新技術,用于識別潛在的結合位點并預測其在先導發現應用中的成藥性,以及在先導優化應用中表征結合位點和批判性評估預期配體[21]。在大規模驗證測試中,SiteMap的結果中有>98%的部分來自與配體緊密結合的位點,還可以準確地區分結合配體的位點和不結合的位點。本研究使用SiteMap分析計算了BOP1的5個可能活性位點,其中site1的置信度最高,因此,選用site1處位點作為BOP1的活性位點與配體對接。
隨著蛋白質結構數據的增長,配體與其目標分子之間的分子相互作用的分析變得越來越重要,并對藥物發現產生重大影響。PLIP可提供高質量圖像、PyMOL會話文件(*.pse)來生成自定義圖像和可解析的結果文件,促進了后續數據處理的效率。在動力學方面,黃芩苷和京尼平苷均能完美對接到BOP1的計算活性位點site1處,且能通過生成大量氫鍵穩固對接關系。氫鍵是有機體內最常見的一種作用力,在生物結構、功能和構象動力學中起著不可或缺的作用,是地球上生命進化的基礎。有研究結果表明,親水或帶電蛋白質表面存在水分子時,氫鍵斷裂的自由能高達1.67 kJ/mol。因此,筆者認為黃芩苷、京尼平苷與BOP1對接主要依靠生成的氫鍵相互作用。
綜上所述,有了豐富的對接數據,可以深入了解黃芩苷、京尼平苷如何與靶標BOP1相互作用。這些相互作用模式的詳細表征對于了解藥物分子識別、蛋白質功能或開發和優化先導化合物至關重要,因此被廣泛應用于對接后處理、抑制劑設計以及藥物定位等[22-23]。基于此,本研究探索了黃芩苷聯合京尼平苷通過影響BOP1治療CRC的可能,對臨床用藥有一定的參考意義。計算機理論研究結果并不能完全還原真實情況,因此,課題組會進一步采用實驗驗證該結果。

