木犀草素對癲癇持續狀態幼鼠海馬組織神經細胞保護作用的機制研究
周琴 孔海波 王艷茹 何保梅
癲癇持續狀態(status epilepticus,SE)可導致以海馬組織為主的腦損傷,其病理學基礎包括細胞凋亡與壞死[1]。由于SE后的細胞凋亡具有可調控性,故其研究日益受到重視[2]。筆者團隊前期研究發現,在SE大鼠的海馬組織中,Toll樣受體4(Toll-like receptor 4,TLR4)/NF-κB信號通路被激活,進一步促進了下游炎癥因子的釋放,提示免疫炎癥反應參與了SE后的腦損傷[3]。木犀草素是存在于多種植物中的一種天然黃酮類物質,具有抗炎、抗氧化、抑制凋亡等多種生物藥理學作用[4]。本研究通過構建發育期SE幼年大鼠(下稱幼鼠)模型,并使用木犀草素干預,旨在研究木犀草素是否可通過TLR4/NF-kB信號通路抑制SE后幼鼠腦內海馬組織的免疫炎癥反應及細胞凋亡,從而起到腦保護的作用。
1 材料和方法
1.1 實驗動物 21日齡清潔級雄性SD幼鼠156只,體重50~80g,購于浙江中醫藥大學實驗動物中心[合格證號:SYXK(浙)2020-0024]。幼鼠飼養在杭州鷹旸生物醫藥研發中心動物實驗室,相對濕度70%,溫度25℃,晝夜照明12 h/12 h變化。本實驗經杭州鷹旸生物醫藥研發中心實驗動物倫理委員會批準(倫理批準編號:EYOUNG-20201124-04)。
1.2 試劑和儀器 主要試劑:氯化鋰(批號:K73036)、匹羅卡品(批號:K80477)均購于美國Fluka公司;溴化甲基東莨菪堿(批號:S8502)購于美國Sigma公司;木犀草素(批號:B20888)購于上海源葉生物科技有限公司;逆轉錄試劑盒(批號:CW2569)購于江蘇康為世紀生物科技有限公司;SYBR Premix Ex Taq Ⅱ(批號:RR820A)購于日本Takara公司;BCA蛋白定量試劑盒(批號:pc0020)、蛋白marker(批號:PR1910)均購于北京Solarbio科技有限公司;TLR4一抗(批號:AF7017)和二抗(批號:S0009)均購于美國Afinity公司。TUNEL試劑盒(批號:G1501)購于武漢Servicebio生物科技有限公司。主要儀器:Micro17R低溫高速離心機購自美國Thermo公司;CFX Connect實時熒光定量PCR儀購自美國BIO RAD公司;EPS300電泳儀、EPS300電泳槽、VE186轉膜儀均購自浙江天能公司;610020-9Q化學發光儀購自上海勤翔科學儀器有限公司;RM2016病理切片機購自上海徠卡儀器有限公司;Nikon Eclipse C1正置熒光顯微鏡、Nikon DS-U3成像系統均購自日本尼康公司。
1.3 動物分組與模型制作 (1)動物分組:按照隨機數字表法將幼鼠分為對照組12只、模型組48只、木犀草素1組(低劑量20 mg/kg)48只和木犀草素2組(高劑量50 mg/kg)48只,其中模型組、木犀草素1組和木犀草素2組在癲癇發作后的1、2、3和7 d分別處死12只幼鼠。(2)SE模型制作:采用氯化鋰-匹羅卡品法制作幼鼠SE模型,幼鼠先予127 mg/kg氯化鋰,所有給藥方式均為腹腔注射,18 h后給予1 mg/kg溴化甲基東莨菪堿,30 min后予100 mg/kg匹羅卡品。幼鼠癲癇發作程度分級[5]:0級,無驚厥發作;Ⅰ級,面部抽動;Ⅱ級,節律性點頭;Ⅲ級,前肢陣攣抽搐;Ⅳ級,全身強直伴站立;Ⅴ級,全身強直陣攣。驚厥程度達Ⅳ級以上,持續達30 min,且驚厥后幼鼠一般狀況良好的為合格幼鼠模型。幼鼠癲癇發作30 min時給予1 mg/kg阿托品和400 mg/kg水合氯醛,SE后幼鼠給予光照取暖,30 min后予以0.9%氯化鈉注射液和10%葡萄糖注射液各10 ml/kg。對照組以0.9%氯化鈉注射液取代匹羅卡品,其余用藥均同模型組。木犀草素1組和木犀草素2組在幼鼠驚止后30 min,予不同劑量的木犀草素(20、50 mg/kg),此后每天重復注射1次,直到處死。
1.4 幼鼠腦標本的采取及制作 幼鼠經腹腔注射400 mg/kg水合氯醛麻醉,斷頭完整分離出海馬,右側放入-80℃液氮中保存;左側置于4%多聚甲醛中固定,脫水、石蠟包埋。
1.5 幼鼠海馬組織中TLR4、NF-κB、半胱氨酸門冬氨酸特異性蛋白酶3(cysteine-containing aspartate-specific proteases-3,Caspase-3)、TNF-α mRNA表達水平檢測 采用qRT-PCR法。取右側海馬標本制作勻漿,TRI Reagent法提取總RNA,按照逆轉錄試劑盒說明書進行逆轉錄反應。以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參,反應條件:95 ℃,10 min變性;95 ℃,15 s;60 ℃,60 s;40次循環。引物序列見表1。采用2-ΔΔCt法計算TLR4、NF-κB、Caspase-3、TNF-α相對表達量。

表1 引物序列(5'-3')
1.6 幼鼠海馬組織中TLR4蛋白表達水平檢測 采用Western blot法。經液氮研磨后的右側海馬標本放入離心管,蛋白定量采用BCA蛋白定量試劑盒,取等量緩沖液與樣本混勻后進行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳,并轉移到聚偏二氟乙烯(PVDF)膜上,5%脫脂奶粉室溫封閉2 h,加一抗后4℃孵育過夜,TBST洗膜10 min×3次,加二抗孵育1 h,TBST洗膜10 min×3次,最后曝光、顯影。目的蛋白的表達水平以TLR4蛋白條帶與內參GAPDH條帶的灰度值比值來表示。
1.7 幼鼠海馬組織神經細胞凋亡情況檢測 采用TUNEL法。取石蠟切片,定位于海馬CA1區,常規脫蠟脫水后,用蛋白酶K消化,滴加平衡緩沖液,孵育20 min,棄去緩沖液,滴加適量TDT酶、dUTP、buffer按1∶5∶50比例混合液,37℃孵育2 h,DAPI復染細胞核。最后熒光顯微鏡觀察并采集圖像,顯色藍色為正常細胞,綠色為陽性的凋亡細胞。神經細胞凋亡率=陽性的凋亡細胞數/總細胞數×100%。
1.8 統計學處理 采用SPSS 16.0統計軟件。計量資料以表示,方差齊性時,多組間比較采用單因素方差分析,兩兩比較采用SNK-q檢驗;方差不齊時,多組間比較采用Kruskal-WallisH檢驗,兩兩比較采用Dunnett's T3檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 癲癇發作后1、2、3和7 d各組幼鼠海馬組織中TLR4、NF-κB、Caspase-3、TNF-α mRNA表達水平比較 與對照組比較,癲癇發作后1、2、3和7 d模型組幼鼠海馬組織中TLR4、NF-κB、Caspase-3、TNF-α mRNA表達水平均升高(均P<0.01);與模型組比較,癲癇發作后1、2、3和7 d木犀草素2組幼鼠海馬組織中TLR4、NF-κB、Caspase-3、TNF-α mRNA表達水平均降低(均P<0.05);癲癇發作后3和7 d木犀草素1組幼鼠海馬組織中TLR4 mRNA表達水平均降低(均P<0.05),癲癇發作后1和3 d木犀草素1組幼鼠海馬組織中Caspase-3 mRNA表達水平均降低(均P<0.05),癲癇發作后3 d木犀草素1組幼鼠海馬組織中TNF-α mRNA表達水平降低(P<0.01),見表2。
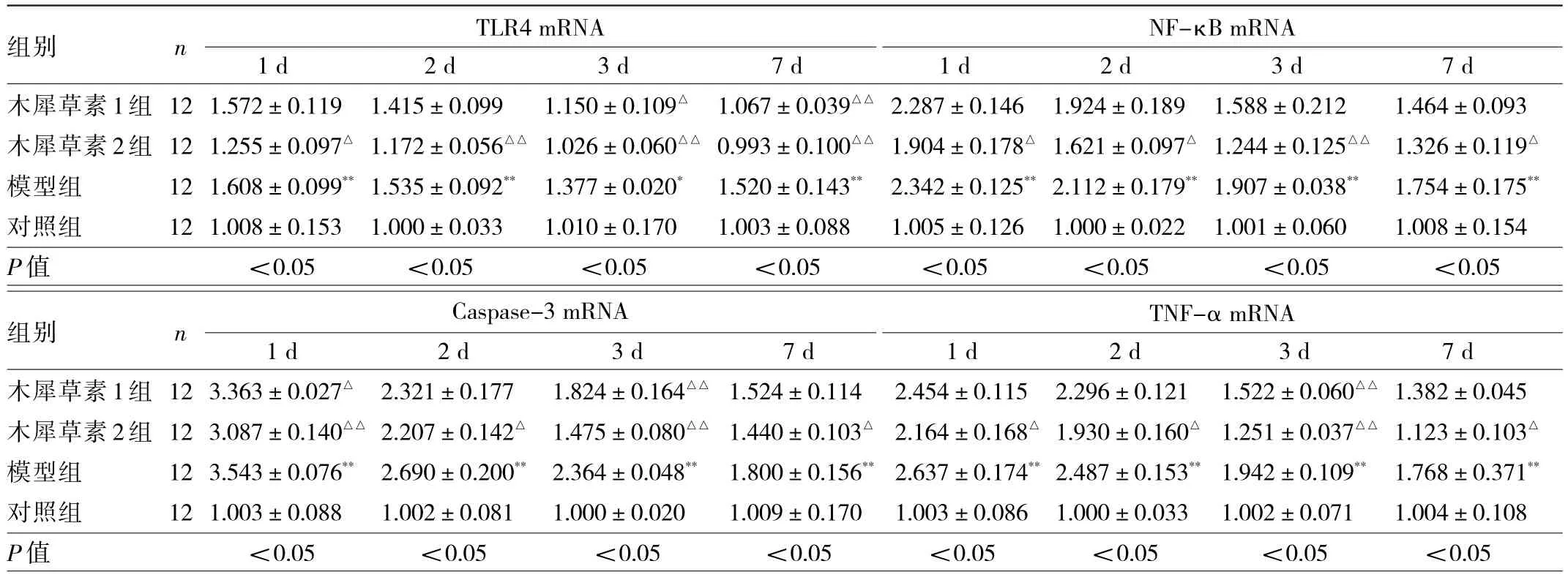
表2 癲癇發作后1、2、3和7 d各組幼鼠海馬組織中TLR4、NF-κB、Caspase-3、TNF-α mRNA表達水平比較
2.2 癲癇發作后1、2、3和7 d各組幼鼠海馬組織中TLR4蛋白表達水平比較 與對照組比較,癲癇發作后1、2、3和7 d模型組幼鼠海馬組織中TLR4蛋白表達水平均升高(均P<0.01)。與模型組比較,癲癇發作后1、2、3和7 d木犀草素2組幼鼠海馬組織中TLR4蛋白表達水平均降低(均P<0.01),僅在癲癇發作后7 d木犀草素1組幼鼠海馬組織中TLR4蛋白表達水平降低(P<0.05),見圖1和表3。

圖1 癲癇發作后1、2、3和7 d各組幼鼠海馬組織中TLR4蛋白表達的電泳圖
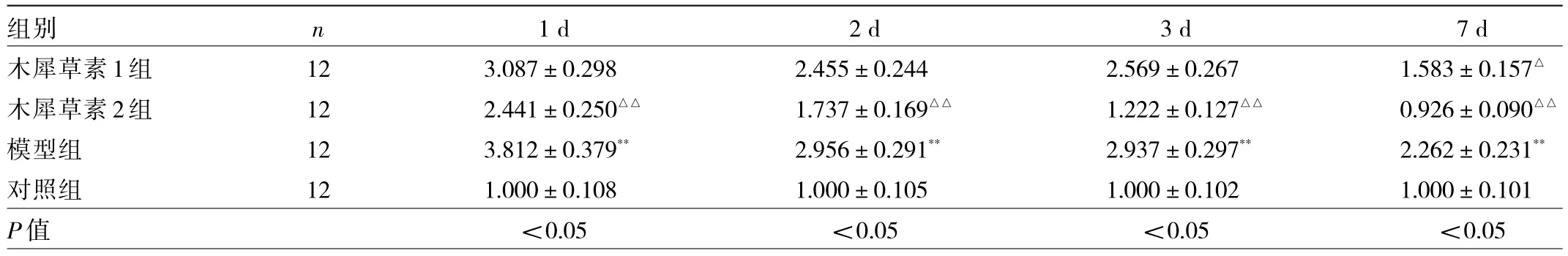
表3 癲癇發作后1、2、3和7 d各組幼鼠海馬組織中TLR4蛋白表達水平比較
2.3 癲癇發作后1、2、3和7 d各組幼鼠海馬組織神經細胞凋亡率比較 與對照組比較,癲癇發作后1、2、3和7 d模型組幼鼠海馬組織神經細胞凋亡率均升高(均P<0.01);與模型組比較,癲癇發作后1、2、3和7 d木犀草素2組幼鼠海馬組織神經細胞凋亡率均降低(均P<0.01),癲癇發作后2、3和7 d木犀草素1組幼鼠海馬組織神經細胞凋亡率均降低(均P<0.05),見圖2和表4。
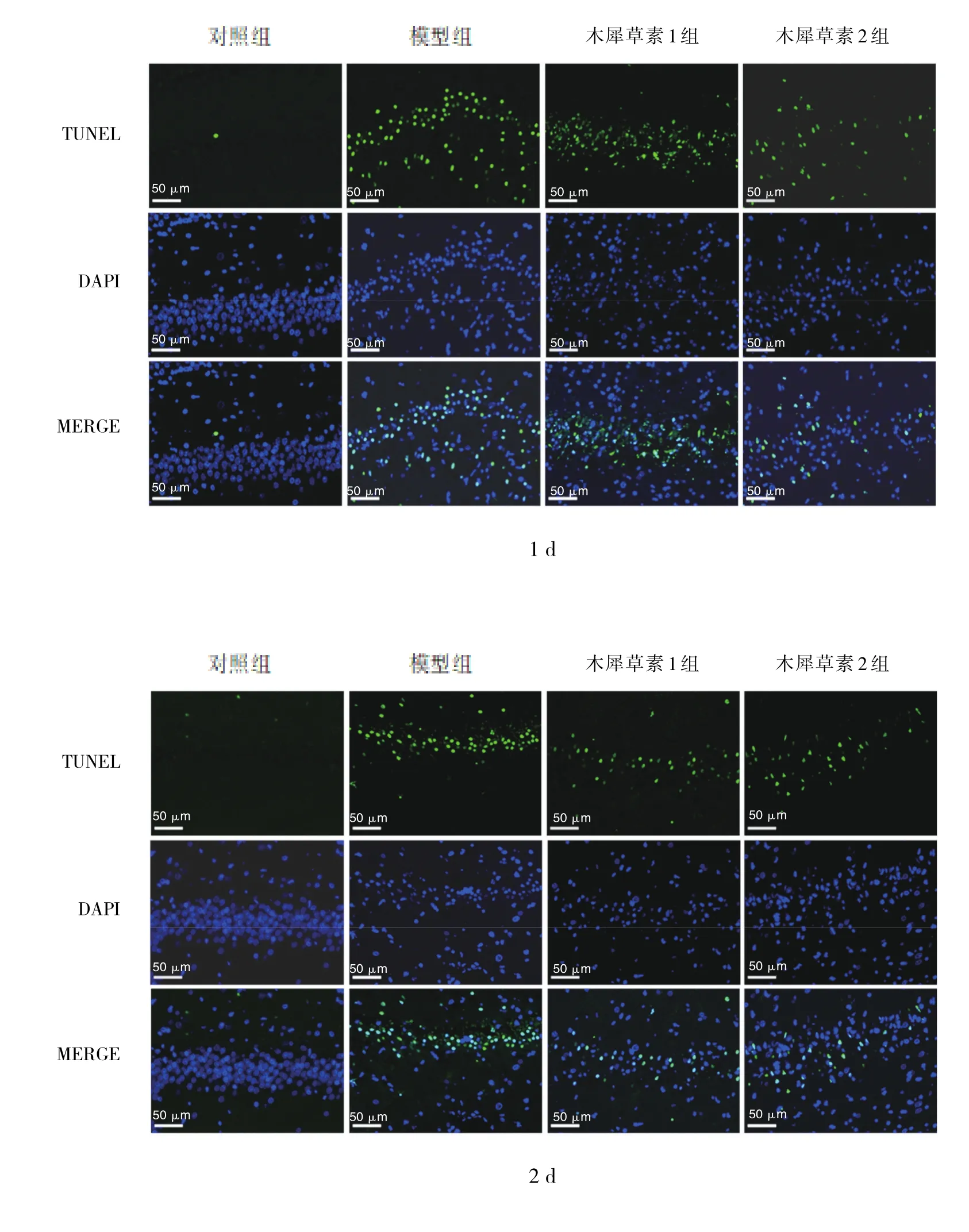

圖2 癲癇發作后1、2、3和7 d各組幼鼠海馬組織神經細胞凋亡表達情況(TUNEL染色,×400)
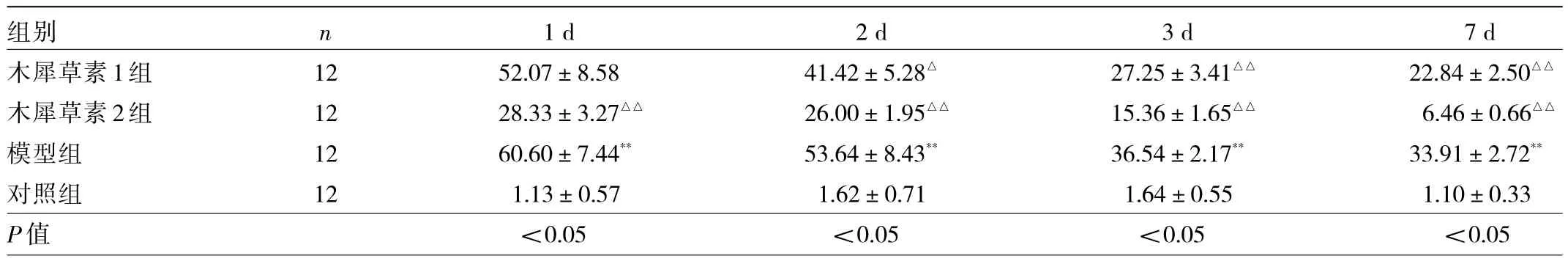
表4 癲癇發作后1、2、3和7 d各組幼鼠海馬組織神經細胞凋亡率比較(%)
3 討論
SE是小兒時期最常見的中樞神經系統急危重癥之一,可引起學習、記憶和認知損害,給患兒的生活造成極大影響[6]。海馬是癲癇發作后腦損傷的重要部位,其主要病理特征是過度的免疫炎癥,以及神經細胞的壞死、凋亡、丟失等[7],抑制海馬區免疫炎癥反應及神經細胞凋亡,對于預防及減輕癲癇發作后的腦損傷至關重要。
TLR4是重要的天然免疫受體,參與了中樞神經系統損傷后的免疫應答[8]。研究發現,TLR4可表達于癲癇小鼠海馬區的神經膠質細胞和神經元中[9],通過抑制TLR4可預防毛果蕓香堿誘發的大鼠癲癇發作[10]。本實驗結果顯示,SE幼鼠海馬組織中TLR4 mRNA和蛋白表達水平均升高,在驚厥后24 h達到高峰。此結果說明,在SE后的幼鼠海馬組織中,TLR4被迅速激活。同時,本實驗也發現,癲癇發作后1、2、3和7 d幼鼠海馬組織中NF-κB、TNF-α mRNA表達水平均升高,其變化趨勢與TLR4基本一致,提示NF-κB在癲癇發作后也迅速活化,并促使TNF-α的合成與釋放。這一結果說明,TLR4/NF-κB通路參與了幼鼠SE后海馬內的免疫炎癥反應。
近年來,木犀草素的神經保護作用日益得到重視[11]。Lin等[12]研究發現木犀草素可以減少海人酸所致癲癇大鼠的海馬損傷,減輕癲癇發作的程度,通過減少谷氨酸水平,減輕炎癥反應。在戊四氮所致大鼠和小鼠癲癇模型中,使用木犀草素可以減輕癲癇的發作時間和強度,減輕癲癇后期的認知損害,減少腦神經的氧化應激損傷[13-14]。本實驗觀察到,經高劑量的木犀草素干預后,海馬組織中TLR4、NF-κB、TNF-α表達水平均有降低,而低劑量的木犀草素干預效果欠佳。這一結果提示,木犀草素可通過抑制TLR4/NF-κB通路,減輕癲癇發作后海馬的免疫炎癥反應,且高劑量的抑制效果更佳。
Caspase-3在海馬組織凋亡中起最后樞紐作用,是激活凋亡途徑最關鍵的執行蛋白酶[15]。本實驗發現,在癲癇發作后24 h Caspase-3 mRNA的表達已迅速達到高峰,此后隨時間的延長表達水平逐步下降,其變化趨勢與檢測到的神經細胞凋亡率一致,這一結果表明,SE后幼鼠海馬區出現了細胞凋亡的過度激活。在癲癇造模后給予高劑量的木犀草素干預,海馬組織中Caspase-3表達水平及神經細胞凋亡率均降低,而低劑量抑制效果有限,提示高劑量的木犀草素能更好地抑制幼鼠SE后海馬組織神經細胞中Caspase-3的激活,減少神經細胞凋亡。
綜上所述,木犀草素可減輕SE幼鼠海馬組織的炎癥反應和細胞凋亡,其機制可能是通過調控TLR4/NF-κB通路來達到神經保護作用。

