酒精性骨質疏松癥和酒精性肝病的相關性研究
魏海濤 劉瑞 荀偉 王敏 劉中陽 張文龍 王晶
1內蒙古科技大學包頭醫學院第二附屬醫院骨二科,包頭 014030;2內蒙古科技大學包頭醫學院第一附屬醫院骨二科,包頭 014010;3內蒙古科技大學包頭醫學院第二附屬醫院消化科,包頭 014030
骨質疏松癥是一種以骨量減低、骨組織微結構損壞,導致骨脆性增加、易發生骨折為特征的全身性骨病,其病理機制中的主要因素可能是遺傳因素和環境因素之間的相互作用[1]。近年來,臨床中常見長期飲酒者骨質疏松癥較正常人加重現象[2],且伴發多器官損害,其中酒精性肝病與酒精性骨質疏松相伴隨最為常見,但其關系如何,具體發病機制怎樣尚無確切報道。本文研究了健康對照組、酒精性肝病、酒精性骨質疏松與血清骨鈣素(osteocalcin,OC)、25-羥基維生素D[25(OH)D3]及腫瘤壞死因子 α(tumor necrosis factor-α,TNF-α)的關系,旨在探討酒精性骨質疏松、酒精性肝病的關系,并深入研究其發病機制。
資料與方法
1、一般資料
回顧性研究2016 年3 月至2020 年12 月內蒙古科技大學包頭醫學院第一附屬醫院及第二附屬醫院收治的122 例飲酒超過5年,折合乙醇量男性≥40 g/d,女性≥20 g/d 的患者為研究對象,男82例,女40例,年齡(40.0±14.6)歲。至少符合骨質疏松癥2017 年《原發性骨質疏松癥診療指南》[1]或2018 年《酒精性肝病防治指南(2018 年更新版)》[3]中的一項。排除標準:1年內有骨折史;惡性腫瘤病史;內分泌系統疾病所致的骨代謝異常;近期或長期服用影響骨代謝藥物者;有其他肝臟疾病病史。所有研究對象均知情同意。
所有研究對象根據骨密度檢查結果、肝功能檢測結果及腹部彩超分為3組,酒精性肝病組45例,酒精性肝病合并骨質疏松癥組42例,酒精性骨質疏松癥組35例。選擇同期性別及年齡相匹配的體檢健康者45例,納入健康對照組。
2、方法
采用雙能X 射線骨密度測定儀測量骨密度,并采用全自動生化分析儀進行肝功測定,使用放射免疫法檢測血清OC、25(OH)D3 及TNF-α 及腹部彩色多普勒對于肝臟及其他腹部臟器進行檢測。
3、統計學分析
采用SPSS 24.0 建立數據庫并進行數據分析,符合正態分布的計量資料以均數±標準差()表示,多組比較采用F檢驗,組間比較采用獨立樣本t檢驗,以P<0.05 為差異有統計學意義。
結 果
酒精性骨質疏松組、酒精性肝病組、酒精性肝病伴骨質疏松組的OC、25(OH)D3均不同程度地低于健康對照組,酒精性肝病伴骨質疏松組OC、25(OH)D3 均低于酒精性骨質疏松組和酒精性肝病組,差異均有統計學意義(均P<0.05),酒精性骨質疏松組OC、25(OH)D3雖低于酒精性肝病組,但差異均無統計學意義(均P>0.05)。酒精性骨質疏松組、酒精性肝病組、酒精性肝病伴骨質疏松組TNF-α 均不同程度地高于健康對照組,酒精性肝病伴骨質疏松組高于酒精性骨質疏松組和酒精性肝病組,酒精性骨質疏松組低于酒精性肝病組,差異均統計學意義(均P<0.05)。見表1。
表1 4組研究對象的TNF-α、OC、25(OH)D3水平比較()
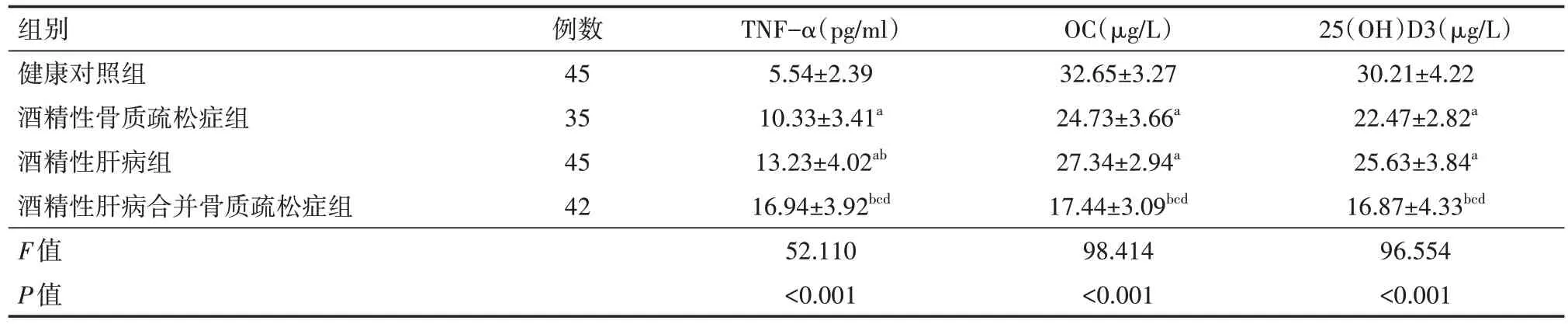
表1 4組研究對象的TNF-α、OC、25(OH)D3水平比較()
注:根據骨密度檢查結果、肝功能檢測結果及腹部彩超分為酒精性肝病組、酒精性肝病合并骨質疏松癥組、骨質疏松癥組,健康對照組為體檢健康者;OC為血清骨鈣素,25(OH)D3為25-羥基維生素D,TNF-α為腫瘤壞死因子α;與健康對照組相比,aP<0.05,cP<0.01,與酒精性骨質疏松癥組比,bP<0.05,與酒精性肝病組相比,dP<0.05
25(OH)D3(μg/L)30.21±4.22 22.47±2.82a 25.63±3.84a 16.87±4.33bcd 96.554<0.001組別健康對照組酒精性骨質疏松癥組酒精性肝病組酒精性肝病合并骨質疏松癥組F值P值例數45 35 45 42 TNF-α(pg/ml)5.54±2.39 10.33±3.41a 13.23±4.02ab 16.94±3.92bcd 52.110<0.001 OC(μg/L)32.65±3.27 24.73±3.66a 27.34±2.94a 17.44±3.09bcd 98.414<0.001
討 論
骨是一個動態器官,成骨細胞和破骨細胞動態平衡是維持其功能的必需條件,失衡將會導致各種骨病的發生。長期飲酒影響骨轉換,易導致人類骨量減少和骨質疏松癥[4]。試驗表明乙醇抑制成骨細胞的活性和增殖,并且呈劑量依賴性[5-6]。乙醇是酒精的主要成分,可直接損傷成骨細胞;乙醇代謝產物乙醛,與蛋白質形成穩定的毒性復合物,其可較長時間內存在于組織中并產生間接損傷;乙醇及乙醛不但直接或間接地抑制成骨細胞生長,還抑制其前體細胞的形成。試驗表明乙醇抑制成骨細胞的活性和增殖,并與飲酒劑量有相關性。目前研究表明酒精性骨質疏松癥發病機制有以下途徑:(1)乙醇可作用于成骨細胞,減少骨的形成[7];(2)乙醇作用于破骨細胞,增強骨的轉化[8];(3)乙醇作用于骨前體細胞,抑制分化;(4)乙醇通過影響肝腎功能、糖及蛋白質代謝及內分泌等其他途徑[9-11]。
骨鈣素是成骨細胞分泌的酸性蛋白,在骨基質中含量特別豐富,不易受骨吸收因素等的影響,反映成骨細胞的活性和骨形成的能力,尤其是新形成成骨細胞的活動狀態,被骨質疏松癥診斷指南中認可的骨形成標志物之一[12]。本次研究中,酒精性骨質疏松組、酒精性肝病組、酒精性肝病伴骨質疏松組的OC均不同程度地低于健康對照組,酒精性肝病伴骨質疏松組低于酒精性骨質疏松組和酒精性肝病組,且差異均有統計學意義(均P<0.05),酒精性骨質疏松組雖低于酒精性肝病組,但差異無統計學意義(P>0.05)。產生此現象的原因可能為:(1)酒精性肝病患者肝功能損傷導致維生素K 缺乏引起骨鈣素的合成減少;(2)乙醇及代謝產物直接或間接的毒性作用于骨細胞及肝細胞造成損傷[13];(3)乙醇代謝過程中刺激機體產生某些炎性細胞因子,進而損害不同靶器官[14-15]。
維生素D(vitamin D,VitD)是骨質疏松鈣磷代謝調節指標,25(OH)D3 由肝臟產生,是血液循環系統中較為穩定的VitD,其含量可以用于評估機體內VitD 的總水平;其代謝產物1,25(OH)2D3 能夠促進小腸細胞合成鈣結合蛋白,從而增加小腸黏膜對鈣的吸收,增加磷吸收;1,25(OH)2D3還能增加近端腎小管對鈣、磷的重吸收,升高血鈣水平,并增加骨密度。生理劑量時,1,25(OH)2D3 可直接調控骨的礦物質代謝,進而促進骨基質形成及類骨質礦化。大劑量時,1,25(OH)2D3促進破骨細胞生成,加快骨吸收。本次研究中,酒精性骨質疏松組、酒精性肝病組、酒精性肝病伴骨質疏松組的25(OH)D3 均不同程度地低于正常對照組,酒精性肝病伴骨質疏松組低于酒精性骨質疏松組和酒精性肝病組,且差異均有統計學意義(均P<0.05),酒精性骨質疏松組雖低于酒精性肝病組,但差異無統計學意義(P>0.05)。分析其具體原因可能為:(1)人體無法自體合成25(OH)D3,須從外界獲得;長期飲酒造成腸道菌群紊亂,易導致吸收減少,進而導致骨質疏松的可能。(2)飲酒可導致肝代謝能力下降,引起VitD 缺乏,正常骨小梁的礦化能力被破壞、骨質軟化、骨小梁骨折[16]。體內25(OH)D3 缺乏可加重酒精性肝病病情進展,主要機制包括代謝和遺傳兩方面:血清25(OH)D3 缺乏加重乙醇破壞肝細胞膜的完整性及加速消耗還原性谷胱甘肽,導致肝細胞變性壞死[17];血清25(OH)D3缺乏增強了乙醇誘導的脂質過氧化反應,以及強化三酰甘油在肝臟內合成和沉積的誘導效應,促使體內產生各種細胞因子,可加重肝臟脂肪變性及纖維化程度;25(OH)D3 缺乏影響控制機體氧化應激水平的相關基因表達,導致肝臟的抗氧化應激能力降低[18-20]。
在乙醇相關的肝損害和骨質疏松的研究報道中我們發現大量相同的細胞因子如TNF-α、轉化生長因子(TGF)-β、白細胞介素(IL)-6、IL-1 等[21-25],說明兩者發病機制存在一定的聯系。本研究發現,酒精性骨質疏松組、酒精性肝病組、酒精性肝病伴骨質疏松組的TNF-α 均不同程度地高于健康對照組,酒精性肝病伴骨質疏松組高于酒精性骨質疏松組和酒精性肝病組,酒精性骨質疏松組低于酒精性肝病組,且差異均有統計學意義(均P<0.05)。文獻報道TNF-α等炎癥因子可通過抑制多種疾病共有信號通路Wnt途徑調控細胞增殖[26-29];TNF-α 亦可以引起肝細胞及成骨細胞的程序性壞死導致酒精性肝病及酒精性骨質疏松;綜上考慮TNF-α參與了酒精性肝硬化及骨質疏松的發生、發展,其可能是二者發病的共同機制。
綜上所述,我們考慮酒精性肝病、酒精性骨質疏松在發病過程中呈相輔相成的作用。OC、25(OH)D3、TNF-α 可能為其共同的發病機理,其既是發病的始動因素,又是其導致的結果。在臨床中我們診治酒精性疾病時應關注其伴隨疾病,以達到對患者的全面診治;更應對患者進行心理疏導及生活指導,幫助他們及早戒酒,健康生活,規避危險因素,減少疾病發生及快速進展。
利益沖突所有作者均聲明不存在利益沖突

